Голодування стимулює біосинтез 2-AG в тонкому кишечнику: роль холінергічних шляхів
Микола В. ДіПатріціо
1 Відділ біомедичних наук, Каліфорнійський університет, Ріверсайд, Медичний факультет, Ріверсайд, Каліфорнія;
2 Кафедра анатомії та нейробіології Каліфорнійського університету, Ірвін, Медична школа, Ірвін, Каліфорнія;
Мікі Ігараші
2 Кафедра анатомії та нейробіології Каліфорнійського університету, Ірвін, Медична школа, Ірвін, Каліфорнія;
Від'я Нараянасвамі
2 Кафедра анатомії та нейробіології Каліфорнійського університету, Ірвін, Медична школа, Ірвін, Каліфорнія;
Конор Мюррей
2 Кафедра анатомії та нейробіології Каліфорнійського університету, Ірвін, Медична школа, Ірвін, Каліфорнія;
Джозеф Ганкайко
2 Кафедра анатомії та нейробіології Каліфорнійського університету, Ірвін, Медична школа, Ірвін, Каліфорнія;
Емі Рассел
2 Кафедра анатомії та нейробіології Каліфорнійського університету, Ірвін, Медична школа, Ірвін, Каліфорнія;
Кван-Мук Юнг
2 Кафедра анатомії та нейробіології Каліфорнійського університету, Ірвін, Медична школа, Ірвін, Каліфорнія;
Даніеле Піомеллі
2 Кафедра анатомії та нейробіології Каліфорнійського університету, Ірвін, Медична школа, Ірвін, Каліфорнія;
3 Кафедра фармакології Каліфорнійського університету, Ірвін, Медичний факультет, Ірвін, Каліфорнія;
4 Кафедра біологічної хімії Каліфорнійського університету, Ірвін, Медичний факультет, Ірвін, Каліфорнія; і
5 Відкриття та розробка лікарських засобів, Istituto Italiano di Tecnologia, Генуя, Італія
Анотація
парасимпатичний та симпатичний відділи вегетативної нервової системи важливим чином сприяють регуляції енергетичного балансу (5). Дослідження на мишах показали, що активація центральних рецепторів меланокортину-4, які зменшують годування і є критично важливою для підтримання енергетичного обміну (53), інгібує холінергічні парасимпатичні прегангліонарні нейрони в дорсальному руховому ядрі блукаючого середовища (DMV) і активує симпатичні прегангліонарні нейрони в спинному мозку (44). Докази свідчать, що холінергічні сигнали з еферентного блукаючого нерва контролюють периферійні механізми сигналізації кишечника та мозку, які регулюють харчування. Наприклад, введення периферично обмеженого мускаринового ацетилхолінового рецептора (mAchR) антагоніста атропіну метил нітрату пригнічує годування після швидкого (33), а також підставне споживання рідкої дієти у щурів (25). Можлива інтерпретація цих результатів полягає в тому, що периферичні mAchR беруть участь у контролі споживання їжі, але механізми, за допомогою яких така регуляція може відбуватися, залишаються невідомими.
МАТЕРІАЛИ І МЕТОДИ
Тварини
Дорослих самців щурів Спраг-Доулі (250–300 г) купували у Чарльз-Рівер (Вілмінгтон, Массачусетс) і розміщували при кімнатній температурі (22 ° С) у підвісних клітках із дротяним дном, щоб запобігти копрофагії під час експериментів з позбавленням їжі. Тварини утримувались на 12: 12-годинному циклі світло-темно (світло світилося о 06:30 та вимикалося о 1830) і мали вільний доступ до води та стандартних гранул чау-гризу (Harlan Teklad 2020, Північна Америка), за винятком випадків, коли відзначали під час позбавлення їжі експерименти (всім надано вільний доступ до води). Всі експерименти розпочались о 0900. Всі процедури відповідали рекомендаціям Національного інституту охорони здоров’я щодо догляду та використання лабораторних тварин і були схвалені Інституційним комітетом з догляду та використання тварин Каліфорнійського університету, Ірвін.
Хімічні речовини та графік введення
Харчові ефекти інгібування кишкових м3 mAchR і CB1R
Всі тварини (n = 10) отримували обробку носієм (тобто внутрішньодуодельний сольовий розчин по 1 мл та внутрішньоочеревинний ДМСО при 0,5 мл/кг за 20 хв до повторного годування після 24-годинного голодування) у перший день тестування та в останній день тестування . Середні значення для прийому за 1 год повторної подачі після кожної обробки носієм, які статистично не відрізнялись (25,1 ± 1,6 та 22,3 ± 1,9 г/кг маси тіла; t-тест Стьюдента, двосторонній P = 0,28), були усереднені для статистичних порівняння проти медикаментозного лікування. Потім тварин поділяли на дві підгрупи (n = 5/група): підгрупа A отримувала DAU5884 (100 нмоль в/в) та AM6545 (10 мг/кг в/в), а підгрупа B - DAU5884 (100 нмоль в/в) та внутрішньочеревно DMSO-носій. На наступний день тестування підгрупа А отримала DAU5884 (300 нмоль ідентифікатора) та внутрішньоочеревинний DMSO-носій, а підгрупа B отримала DAU5884 (300 нмоль ідентифікатора) та AM6545 (10 мг/кг внутрішньовенно). В останній день медикаментозного лікування всі тварини отримували внутрішньодуоденальний сольовий розчин та внутрішньочеревно AM6545 (10 мг/кг внутрішньовенно).
Інтрадуоденальна інфузія макроелементів
Щурів позбавляли їжі протягом 24 год, а потім вводили зі швидкістю 0,5 мл/хв протягом 10 хв у дванадцятипалу кишку за допомогою носія (стерильний фізіологічний розчин) або рівнокалорійних (загальна кількість 10 ккал) концентрацій інтраліпіду, сахарози або пептону. . Тканини збирали (див. “Обробка тканин”) через 30 хв після початку інфузій.
Операції
Інтрадуоденальні катетери.
Піддіафрагмальна ваготомія.
Усі щури були підготовлені до операції, як зазначено вище (див. Інтрадуоденальний катетер). Шлунок і селезінку обережно втягували, а дорсальний і вентральний відділи блукаючого нерва під діафрагмою ізолювали дрібними щипцями і відшаровували від стравоходу. Два шви наклали на 1,5 см один від одного на кожному відділі блукаючого (загалом чотири шви), а всю нервову тканину між кожним набором швів виділили та видалили за допомогою тонких ножиць. На контрольних підставних хірургічних операціях тварини проходили ті самі процедури, що описані вище, за винятком того, що блукаючий нерв не маніпулював і залишався цілим. М'язова стінка живота була закрита, як зазначено вище (див. Інтрадуоденальний катетер). Тестування розпочали після 7–10 днів відновлення після операції.
Обробка тканин
Екстракції ліпідів.
Всім тваринам знеболювали ізофлураном під час збору тканини, а потім тонку кишку або інші органи швидко видаляли і промивали PBS і заморожували в рідині N2. До швидкого заморожування слизову оболонку товстої кишки відокремлювали від серози шляхом вишкрібання предметним склом. Потім усі тканини зберігали при -80 ° C до часу обробки. Заморожені тканини зважували та гомогенізували в 1,0 мл метанолу, що містить такі внутрішні стандарти: [2 H8] -2-AG (Cayman Chemical, Ann Arbor, MI) та динонадекадієноїн (Nu-Chek Prep, Elysian, MN). Ліпіди екстрагували хлороформом (2 об.) І промивали водою (1 об.). Органічні фази збирали та фракціонували за допомогою хроматографії на колонці з силікагелем з відкритим шаром, як описано раніше (3). Елюйовані фракції сушили під N2 і відновлювали в 0,1 мл хлороформу: метанолу (1: 3) для рідинної хроматографії/мас-спектрометрії (LC/MS).
Вимірювання 2-AG.
Вимірювання 1-стеароїлу, 2-арахідоноїлу-sn-гліцерину.
Ми використовували систему Agilent 1100-LC, поєднану з детектором MS Ion-Trap XCT, поєднаним з ESI (Agilent Technologies). Види діацилгліцерину (DAG) розділяли за допомогою колони Poroshell C18 (75 × 2,1 мм ID, 5 мкм), елюйованої градієнтом метанолу (0,5% оцтової кислоти, 5 нМ ацетату амонію) у воді (0,5% оцтової кислоти, 5 нМ амоній ацетат) (від 60 до 100% метанолу через 6 хв, 100% через 6–8 хв, 100–60% через 8–9 хв та 60% через 9–10 хв) при швидкості потоку 1,0 мл/хв. . Температуру колонки підтримували на рівні 30 ° C. Напруга капілярів була встановлена на рівні 3,5 кВ, а напруга на скиммері - на рівні 40 В. N2 використовувались як сушильний газ при швидкості потоку 10 л/хв, температурі 350 ° С і тиску небулайзера 60 фунтів на квадратний дюйм Як газ зіткнення використовували гелій, а амплітуду фрагментації встановлювали на рівні 1,3 В. Види DAG ідентифікували в режимі позитивної іонізації, виходячи з їх часу утримування та властивостей MS 2, використовуючи справжні стандарти (Nu-Chek Prep) як посилання. Багаторазовий моніторинг реакцій використовували для отримання тандемних спектрів повного сканування вибраних іонів 1-стеароїл, 2-арахідоноїл-sn-гліцерин (SAG). Екстраговані іонні хроматограми використовували для кількісного визначення 1-стеароїлу, 2-арахідоноїл-sn-гліцерину (m/z = 667,8> 383,2) та динонадекадієноїну (m/z = 667,8> 373,5), який використовували як внутрішній стандарт.
RT-PCR
Статистичний аналіз
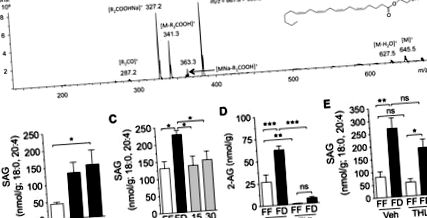
Результати виражаються як середнє значення ± SE. Значимість розбіжностей між групами оцінювали за допомогою t-критерію Стьюдента та одностороннього ANOVA з подальшим Newman-Keuls або post-hoc оцінкою Даннета, або двостороннього ANOVA з подальшим Newman-Keuls або Sidak post hoc оцінки, коли це доречно для порівняння засобів, коли ANOVA виявила суттєві відмінності. Відмінності вважалися суттєвими, якщо P рис. 1A; P Рис. 1B; P Рис. 1C; P Рис. 1D). Щоб визначити окремі макроелементи, які можуть бути відповідальними за контроль рівня 2-AG тонусної кишки, ми імплантували катетери щурам та вводили в дванадцятипалу кишку окремі макроелементи (рівнокалорійні, 10 ккал) через 24 години позбавлення їжі. Усі макроелементи однаково знижували рівень 2-АГ протягом 30 хв інфузії, порівняно з інфузією на носії (рис. 1Е): жир (Інтраліпід, Р, рис. 2А). Як видно з 2-AG (рис. 1B), рівні SAG в тонусі зростали після позбавлення їжі, досягаючи статистичної значущості через 24 год, порівняно з тваринами, що вільно годували (рис. 2B; P рис. 2C; P рис. 2C; P рис. . 2D; P Рис. 2D; не значуще). На відміну від його впливу на 2-AG (рис. 2D), THL не суттєво впливав на рівень SAG (рис. 2E, не суттєво), що узгоджується з пригніченням активності DGL. Результати свідчать про те, що шлях DGL є критично важливим для утворення 2-AG в слизовій оболонці тонкої кишки.
Шлях діацилгліцерилу ліпаза-альфа (ДГЛ) регулює 2-АГ під час голодування та повторного годування. A: ідентифікація 1, стеароїлу, 2-арахідоноїл-sn-гліцерину (SAG) у слизовій оболонці тонкої кишки щурів за допомогою рідинної хроматографії/тандемної мас-спектрометрії (LC/MS/MS). Рясний фрагмент [MNa-R1COOH] + (m/z = 383,2) був обраний для кількісного визначення рівнів SAG у слизовій оболонці тонкої кишки. B: часовий курс дефіциту їжі на рівні SAG у слизовій оболонці тонкої кишки. FF позначається відкритими брусками; FD позначається закритими смугами. * P Рис. 3A; P Рис. 3A; не суттєвий). У ваготомізованих щурів, позбавлених їжі, також спостерігався знижений рівень 2-AG в товстій кишці, порівняно з позбавленими їжі штучними контролями (рис. 3A; P рис. 3B; P рис. 3B; незначно; n = 4–6) . Крім того, у позбавлених їжі щурів, оброблених атропіном, виявляли значно нижчі рівні 2-AG в товстій кишці порівняно з щурами, які не отримували їжу, обробленими транспортними засобами (рис. 3B; P рис. 3C, мозочок використовували як позитивний контроль). Внутрішньодуоденальне введення низької дози (300 нмоль) селективного антагоніста м3, DAU 5884, знижувало рівень 2-AG в порожній кишці у щурів, позбавлених їжі протягом 24 годин (рис. 3E; P, рис. 3E; n = 5). Висновки в сукупності дозволяють припустити, що позбавлення їжі викликає вироблення 2-AG у верхніх кишках, стимулюючи холінергічну активацію рецепторів м3.
Рецептори M3 опосередковують орексигенну сигналізацію 2-AG в кишечнику
Холінергічний контроль сигналізації ендоканабіноїдів у кишечнику. Вважається, що еферентний блукаючий нерв вивільняє ацетилхолін на м3 мускаринових рецепторів ацетилхоліну у товстій кишці щурів. У свою чергу, під час посту активація м3 мускаринових ацетилхолінових рецепторів призводить до збільшення продукції 2-AG через діацилгліцериновий ліпазний шлях. 2-AG активує місцеві канабіноїдні рецептори CB1 і стимулює живлення, і, таким чином, пропонується бути периферичним сигналом голоду. СІ, тонкий кишечник.
Ендоканабіноїдні сигнали у верхній частині тонкої кишки сприяють надходженню їжі (12). Раніше ми повідомляли, що дегустація харчових жирів, але не білків або вуглеводів, ініціює вироблення ендоканабіноїдів 2-AG та анандаміду у товстій кишці щурів, що годують фальшиво (10). Внутрішній вплив мононенасичених або ненасичених вільних жирних кислот (тобто олеїнової та лінолевої кислот відповідно) збільшує рівень ендоканабіноїдів в тонусі, що, в свою чергу, активує місцеві CB1R і сприяє подальшому споживанню жиру (10, 11). Дійсно, внутрішньодуоденальне введення антагоніста CB1R римонабанта або внутрішньочеревне введення периферично обмежених антагоністів CB1R URB447 (26) та AM6545 (7) перешкоджало штучному живленню (10, 11). Важливо, що хірургічне порушення блукаючого нерва запобігало збільшенню рівня ендоканабіноїдів під час штучного годування жиру, тим самим припускаючи, що холінергічна нейромедіація контролює вироблення ендоканабіноїдів у товстій кишці, що, в свою чергу, генерує позитивний зворотний зв'язок мозку для стимулювання прийому жирна їжа.
Залишається визначити конкретні молекулярні та нервові шляхи, за допомогою яких тонусні CB1R сигналізують мозку для стимулювання харчування. Факти свідчать про те, що ендоканабіноїди можуть не взаємодіяти безпосередньо з CB1R на аферентному блукаючому тілі, оскільки миші, нульові для CB1R на селективних волокнах блукаючого тіла, не мали змін у масі тіла (51). Однак 2-AG може побічно взаємодіяти з блукаючим нервом через проміжний вісник, такий як CCK. Цілком ймовірно, що ендоканабіноїди можуть інгібувати вивільнення CCK з кишечника, що функціонально затримує припинення прийому їжі. Дійсно, ентероендокринні I клітини, які продукують і секретують CCK, експресують мРНК для CB1R (48), а інгібування mAchR з атропіном посилює вивільнення CCK у відповідь на годування щурів (29). Крім того, подібно до 2-АГ у кишечнику, рівень циркуляції греліну зростає пропорційно часу від останнього прийому їжі у людей та гризунів (2, 23). Важливо, що шлункові клітини, які продукують і секретують грелін, містять CB1R, а інгібування CB1R з римонабантом зменшує виділення греліну у щурів, але лише після позбавлення їжі (41).
Повідомлення різняться щодо ефективності лише ваготомії для зменшення ваги у гризунів та людей (19, 30, 42, 52). Отже, подальші дослідження мають вирішальне значення для визначення ролі конкретних гілок блукаючого тіла у контролі ваги тіла та потенційних відмінностей між гризунами та людиною у цій реакції. Тим не менше, люди, які перенесли лапроскопічну перев'язку шлунка в поєднанні з ваготомією тулуба, повідомили про відсутність суб'єктивних відчуттів голоду, незважаючи на відсутність змін у збільшенні маси тіла порівняно з обстежуваними, які мали лише шлункову смугу (27). Цей результат дозволяє припустити, що ваготомія може зменшити активність шляхів, що сприяють голоду, у людей за допомогою механізму, який включає зниження сигналізації про ендоканабіноїди в кишечнику; проте перевірку цієї гіпотези ще належить провести. Крім того, слід зазначити потенційні застереження щодо інтерпретації результатів експериментів з ваготомії у цій статті, враховуючи відомі порушення спорожнення шлунка, споживання їжі та маси тіла, які виникають після повної піддіафрагмальної ваготомії у гризунів.
Перспективи та значення
Представлені тут результати показують, що подібно до дегустації дієтичних жирів (10, 11), голодування стимулює вироблення 2-АГ у слизовій оболонці тонкої кишки та стимулює годування. Це свідчить про те, що опосередкований 2-AG ендоканабіноїдний сигнал у кишечнику може бути загальним сигналом голоду, який ініціюється за кількох поведінкових та метаболічних умов. Важливо, що наші висновки також свідчать про те, що холінергічна нейромедіація - можливо, контрольована еферентним блукаючим нервом - бере участь у контролі годування за допомогою механізму, який вимагає активації м3 mAchR у кишечнику, локальної мобілізації 2-AG та активації 2-AG CB1R. Таким чином, сигналізація про ендоканабіноїди в кишечнику могла бути обрана еволюцією через її властивості пробудження під час голоду, що, в свою чергу, може сприяти переїданню та ожирінню в сучасні часи достатку (13). Таким чином, це дослідження вдосконалює наше розуміння передачі сигналів про ендоканабіноїди кишкового мозку та пропонує нові потенційні фармакологічні шляхи контролю апетиту.
ГРАНТИ
Автори вдячні за підтримку Національного інституту США з питань зловживання наркотиками гранту K99/R00 DA-034009 N. V. DiPatrizio та Національного інституту діабету та розладів травлення та нирок США DK-073955 D. Piomelli.
РОЗКРИТТЯ
Автори повідомляють про такі конфлікти інтересів. Д. Піомеллі є співзасновником Thesan Pharmaceuticals, біофармацевтичної компанії, яка займається розробкою інноваційних методів лікування шкірних захворювань. Д. Піомеллі є власником акцій компанії, і його лабораторія отримала підтримку в дослідженнях, не пов'язану з роботою, представленою тут.
- Настанови щодо посту Різдва Швидкого 2019; Церква Всіх Святих
- Піст протягом 24 годин сонячного світла Рамадан в Полярному колі Mvslim
- Голодування в Рамадан не пов'язане з погіршенням хронічної хвороби нирок
- Піст є одним із п’яти стовпів ісламу
- Пісні подорожі та лімфатичний самомасаж - Земляна академія