Регуляція еритропоезу після нормоксичного повернення від хронічної стійкої та періодичної гіпоксії
Анотація
Гіпоксія посилює еритропоез, опосередкований індукуючими гіпоксією факторами транскрипції (HIF), які регулюють транскрипцію еритропоетину. Неоцитоліз - це фізіологічний механізм, який коригує поліцитемію від хронічної стійкої гіпоксемії шляхом тимчасової переважної деструкції молодих еритроцитів після відновлення нормоксії. Ми показали, що неоцитоліз спричинений надлишком активних форм кисню, одержуваних мітохондріями, у ретикулоцитах, опосередкованих зниженням регуляції HIF регульованої BNIP3L мітофагії та зменшенням рівня антиоксидантної каталази RBC (CAT) в еритроцитах, що продукуються гіпоксією. Зниження CAT є результатом індукованого гіпоксією miR-21, який знижує регуляцію CAT. Це корелює з тимчасовим гострим зниженням HIF-1 при нормоксичній віддачі, що пов'язано з нормалізацією маси червоних клітин.
обструктивне апное сну (ОПА), що характеризується унікальним характером хронічної інтермітуючої гіпоксії (ІГС), пов’язане із серцево-судинними, ендокринними та нейрокогнітивними супутніми захворюваннями та підвищеним ризиком розвитку раку. Роль сонного тіла в модульованій OSA патофізіології добре вивчена; тут ми визначаємо гематологічні відхилення та обговорюємо можливу роль змін крові OSA у здоров’ї. Ми виявили лише це
У 1% пацієнтів з OSA розвинулася поліцитемія, яка не була обумовлена іншими причинами і коригувалась за допомогою постійної терапії позитивним тиском у дихальних шляхах (CPAP). Однак у наших експериментальних дослідженнях OSA ми виявили збільшення активних форм кисню (АФК) та мітохондріальної маси із зниженою каталазою (CAT) та BNIP3L у клітинах крові, разом із підвищеними маркерами запалення. Після корекції OSA із застосуванням CPAP протягом> 3 міс, деякі, але не всі, з цих відхилень були виправлені.
Спостережувані зміни крові в OSA, ймовірно, сприяють погіршенню здоров’я; однак їх патофізіологічну роль потрібно ретельно визначити.
Хронічна стійка гіпоксемія
Миша модель неоцитолізу
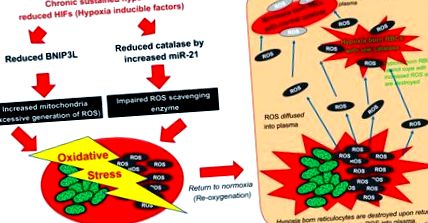
1% еритроцитів, зміни періоду напіввиведення ретикулоцитів не можуть спричинити такого швидкого зниження гематокриту після нормоксичного повернення. Однак введення антиоксидантного агента, N-ацетил-цистеїну, або ін'єкція кон'югованого з поліетиленгліколем CAT послаблює швидкість гемолітики, демонструючи, що генеруються АФК ретикулоцитів дифундують у плазму, контактують з циркулюючими еритроцитами та переважно знищують ті еритроцити, народжені гіпоксією нижча активність CAT (тобто неоцитоліз). Ймовірно, що навіть старі еритроцити також зазнають впливу плазмових АФК, але, ймовірно, в меншій мірі, ніж молодші еритроцити з низьким CAT. Щоб довести, що ці висновки модулює HIF, модель миші з конститутивною регуляцією HIF, що має мутацію VHL з втратою функції, негативний регулятор HIF [так звана чуваська поліцитемія миші (16)] послабив неоцитоліз . Подібним чином посилення активності HIF шляхом ін'єкції диметилоксалоїлгліцину, інгібітора пролілгідроксилази 2 (головного негативного регулятора HIF), послаблює неоцитоліз, вказуючи на те, що швидке зниження рівнів HIF відповідає за неоцитоліз. Механізми неоцитолізу, що складаються з підвищеного продукування АФК та супроводжуючого зниження здатності АФК до знешкодження, зображені на рис. 1 .
Запропонований механізм неоцитолізу. Неоцитоліз спричинений збільшенням активності мітохондріальних активних форм кисню (АФК). АФК генеруються збільшенням мітохондріальної маси зниженим регулятором HIF BNIP3L в ретикулоцитах. АФК дифузується в плазму із зруйнованих ретикулоцитів при поверненні до нормоксії. Зниження каталази внаслідок гіРОКС-індукованого miR-21 збільшує накопичення АФК. Народжені в гіпоксії еритроцити піддаються неоцитолізу через порушення здатності справлятися з підвищеним окислювальним стресом.
Активність ВІЛ при гострій та хронічній гіпоксії
CIH та OSA
На відміну від CSH, CIH складається з повторюваних циклів нормоксії та гіпоксії. OSA є прототипом ІГС, що характеризується періодичною обструкцією дихання внаслідок колапсу верхніх дихальних шляхів, що призводить до циклічних знежирень кисню (30). Однак, хоча пацієнти з OSA мають значні цикли сильної гіпоксії під час сну, більшість із них не є поліцитемічними, як очікувалося (43). Таким чином, ми влаштували експерименти для вирішення цієї очевидної патофізіологічної загадки. Ми виявили лише це
- Як підтримати друга із хронічним захворюванням
- Як галузь харчових добавок тримає під контролем правила • OpenSecrets
- ME CFS, спричинені зараженням паразитом Health Rising; s Синдром хронічної втоми (MECFS) та
- Це хронічна втома чи просто перевтома та збільшення ваги
- Регуляція інсуліну експресії мРНК PDK4 скелетних м’язів порушує екстремальну стійкість до інсуліну