Гіперплазія адипоцитів та RMI1 при лікуванні ожиріння
Drug Discovery Research, Astellas Pharma Inc., Ібаракі, Японія
Drug Discovery Research, Astellas Pharma Inc., Ібаракі, Японія
Drug Discovery Research, Astellas Pharma Inc., Ібаракі, Японія
Drug Discovery Research, Astellas Pharma Inc., Ібаракі, Японія
Drug Discovery Research, Astellas Pharma Inc., Ібаракі, Японія
Drug Discovery Research, Astellas Pharma Inc., Ібаракі, Японія
Анотація
Ескалація поширеності ожиріння є однією з найбільш актуальних проблем охорони здоров'я сучасної епохи, проте існуючі ліки для боротьби з цією глобальною пандемією невтішно обмежені з точки зору безпеки та ефективності. Неадекватність існуючих на даний момент методів лікування ожиріння зробила вирішальним важливим питання щодо розробки нових препаратів. Однак за останні кілька десятиліть було досягнуто значного прогресу в розумінні гіперплазії адипоцитів, пов'язаної з патогенезом ожиріння, і, отже, були визначені нові потенційні цілі для медичного лікування ожиріння. Ми в першу чергу розглядаємо нещодавній прогрес у регуляції гіперплазії адипоцитів як новий нетрадиційний підхід. У цьому міні-огляді ми зосереджуємось на опосередкованій recQ нестабільності геному 1 (RMI1), нещодавно визначеній новій молекулярній мішені для лікування ожиріння. Встановлено, що миші з дефіцитом RMI1 стійкі до ожиріння, пов’язаного з дієтою та генетикою. Експресія цього білка регулюється факторами транскрипції E2F, і нещодавні дослідження показали, що RMI1 відіграє важливу роль у контролі енергетичного гомеостазу під час розвитку ожиріння, спосіб дії заснований на регуляції гіперплазії адипоцитів.
Скорочення
Вступ
Ожиріння є складним розладом та основним фактором ризику метаболічних захворювань, таких як цукровий діабет 2 типу, гіпертонія та серцево-судинні захворювання. Ожиріння розвивається в результаті дисбалансу між споживанням та витратою енергії. Якщо сказати просто, хронічне зменшення енергетичних витрат у порівнянні з прийомом спричиняє збільшення накопичення надлишку енергії у вигляді внутрішньоклітинних крапель триацилгліцерину в жирових клітинах, що призводить до збільшення маси жиру і в кінцевому підсумку до ожиріння.
Вважається, що гіперплазія адипоцитів (збільшення кількості клітин) та гіпертрофія (збільшення розміру клітини) безпосередньо відповідають за спостережуване збільшення маси жирової тканини [[1, 2]]. Зокрема, гіпертрофія адипоцитів вважається основною причиною ожиріння дорослих, а гіперплазія адипоцитів у дорослих з ожирінням іноді виникає вторинно в порівнянні з гіпертрофією адипоцитів, можливо, через збільшення кількості адипоцитів, здатних секретувати паракринні фактори росту, що індукують гіперплазію адипоцитів [[3]].
Тоді як основна кількість адипоцитів встановлюється в дитинстві та підлітковому віці як у людей, так і у гризунів, жирова тканина зберігає здатність генерувати нові адипоцити протягом усього життя. Збільшення кількості адипоцитів під час старіння спричинено зростанням частоти та тяжкості ожиріння серед людей похилого віку [[4]]. Тіазолідиндіони, клас пероральних протидіабетичних засобів, є активованими проліфератором ядерних рецепторів гамма-агоністами пероксисомних рецепторів, які підсилюють генерацію малих адипоцитів, викликаючи адипогенез, що призводить до збільшення маси жирової тканини і, отже, ожиріння [[5]].
Ця зростаюча кількість даних свідчить про те, що гіперплазія адипоцитів може бути ключовою подією у розвитку та подальшому клінічному перебігу деяких типів ожиріння. У цьому міні-огляді ми зосереджуємось на гіперплазії адипоцитів як новій терапевтичній мішені для лікування ожиріння та обговорюємо переваги спрямованості на опосередковану recQ нестабільність геному 1 (RMI1), нещодавно визначену молекулу енергетичного гомеостазу, для лікування ожиріння.
Гіперплазія адипоцитів
Доклінічні дослідження продемонстрували, що гіперплазія адипоцитів відбувається у два етапи: збільшення кількості преадипоцитів з подальшою диференціацією преадипоцитів на зрілі адипоцити. Процес переходу від проліферації до диференціації в адипоциті жорстко регулюється взаємодією між регуляторами клітинного циклу та диференціюючими факторами і створює каскад подій, що призводять до прихильності клітин до фенотипу адипоцитів [[6, 7]]. Цей процес, що описується як `` адипогенез '', вимагає розгортання певної послідовності подій, включаючи зупинку росту проліферуючих преадипоцитів, скоординоване повторне входження в клітинний цикл з обмеженим клональним розширенням та зупинку росту перед кінцевою диференціацією під час накопичення ліпідів що відбувається певна перехресна розмова між клітинним циклом або механізмом проліферації клітин та факторами, що контролюють диференціацію клітин.
Регулювання клітинного циклу
Фактори, що беруть участь у регуляції клітинного циклу, однозначно виконують важливу роль у фазі клітинної проліферації гіперплазії адипоцитів. Прогресія клітинного циклу у ссавців регулюється на кожній фазі клітинного циклу різними комплексами молекул, пов'язаних з циклічним циклом, включаючи цикліни, циклінозалежні кінази, їх інгібітори та білок ретинобластоми (RB), а також E2F.
Члени сім'ї E2F та RB, здається, беруть участь у регуляції подій клітинного циклу, необхідних для адипогенезу. Наприклад, у заарештованих на ріст преадипоцитах E2Fs комплексовані з pRB, що призводить до репресії генів-мішеней [[8]]. Після повторного вступу в клітинний цикл цими заарештованими зростанням преадипоцитами, RB фосфорилюється під дією циклін/циклін-залежних голоферментів кінази, звільняючи комплекс E2F і, таким чином, приводячи до активації цільових генів E2F [[9]]. Фахас та ін. [[10]] продемонстрував, що сімейство білків E2F відіграє центральну роль у проліферації преадипоцитів і що миші з дефіцитом E2F1 стійкі до ожиріння, викликаного дієтою з високим вмістом жиру (через придушення накопичення жирової маси).
Інгібітори циклінозалежної кінази включають два сімейства білків, сімейство Cip (Kip) та сімейство Ink4, і є центральними гравцями виходу клітин із клітинного циклу [[11]]. Втрата p27 Kip1 або p21 Cip1 у мишей призводить до гіперплазії адипоцитів в результаті посиленої проліферації або рекрутингу преадипоцитів [[12]], що свідчить про те, що ці циклінозалежні інгібітори кінази важливі для регуляції числа адипоцитів. Комплекс S-фазової кінази-асоційованого білка (Skp) 1-Куллін-F-box-білка (SCF) убиквітин-лігази (E3) націлений на інгібітори циклінозалежної кінази для деградації до 26S протеасоми і тим самим регулює прогресування клітинного циклу [[13]]. Сакай та ін. [[14]] показали, що дефіцит Skp2, субстрату, що зв’язує субстрат, комплексу SCP Skp2, сприяє деградації p27 Kip1, що призводить до індукованої стійкості до ожиріння внаслідок інгібування проліферації преадипоцитів, не викликаючи гіпертрофії адипоцитів. Такі результати спостерігалися як при дієті з високим вмістом жиру, так і при смертельно жовтий агуті (A р ) генетично обумовлені моделі ожиріння. Подібним чином, було показано, що інші молекули, пов'язані з клітинним циклом, такі як циклінозалежна кіназа [[15, 16]] та RB [[17]], також відіграють важливу роль у проліферації клітин під час адипогенезу.
Вищезазначені результати настійно припускають, що регуляція клітинного циклу, пов'язана з гіперплазією адипоцитів, може представляти новий підхід до лікування ожиріння. Однак будь-яка модуляція клітинного циклу може потенційно впливати не тільки на метаболічну тканину, але і на нормальні тканини. Дійсно, дефіцитні Skp2 миші показали зменшену кількість β-клітин у підшлунковій залозі [[14]]. Крім того, надмірна експресія p27 Kip1 у β-клітинах викликала гіперглікемію у мишей в результаті інгібування проліферації β-клітин [[18]]. Ці потенційно серйозні побічні ефекти, пов'язані з неспецифічним пригніченням проліферації клітин, можуть стати основною перешкодою для клінічного використання цього підходу в терапії ожиріння.
RMI1 та ожиріння
Використовуючи підхід випадкового мутагенезу, заснований на методі змінної генної пастки, нещодавно ми визначили RMI1 як новий регулятор енергетичного гомеостазу [[19]], який, як повідомляється, є важливим компонентом білкових комплексів синдрому Блума [[20]], хоча жодні докази не пов’язували це з енергетичним гомеостазом до наших висновків. Раніше повідомлялося, що RMI1, фермент-зв’язуючий білок, опосередковує рекомбінацію ДНК, організацію хромосом та біогенез, а також регулює механізми контрольних точок клітинного циклу [[21]]. RMI1 також є членом гена синдрому Блума (BLM) - топоізомеразного комплексу; цільові мутації BLM затримуються у розвитку і відмирають до ембріонального дня 13,5 [[22, 23]], а гомозиготні нокаутують ембріони RMI1 гинуть внаслідок невідомої причини [[19]]. Синдром Блума - це рідкісне рецесивне генетичне захворювання, яке характеризується карликовістю, телеангієктатичною еритемою, імунною недостатністю та схильністю до розвитку раку [[24, 25]].
Гетерозиготні нокаутовані миші RMI1 (RMI1 +/−) мають фенотип, майже ідентичний такому у дикого типу, хоча маса тіла та глюкоза в плазмі натще значно менша у мишей дикого типу. Однак миші RMI1 +/− мають низку вражаючих особливостей, що роблять їх стійкими до метаболічних захворювань. Годуючи жирну їжу з високим вмістом жиру, миші-мутанти були не тільки стійкими до ожиріння, вони демонстрували покращену непереносимість глюкози та зменшували жирову тканину живота. Крім того, мутанти також були стійкі до ожиріння, викликаного A р ген. Особливої уваги заслуговує той факт, що дефіцитні миші демонстрували швидкість набору ваги та кількість споживаної їжі, еквівалентну вимірам, проведеним за звичайних дієтичних умов. У сукупності ці результати вказують на те, що миші з дефіцитом RMI1 можуть нормально рости, незважаючи на розвиток базальних аномалій, що свідчить про те, що вплив дефіциту RMI1 чутливий і обмежується розвитком ожиріння [[19]]. Однак ми не можемо виключити ймовірність того, що незначні базальні зміни, такі як зниження маси тіла та ще невстановлені відхилення, можуть частково вплинути на енергетичний баланс. Потрібні подальші дослідження, щоб з'ясувати, чи виявляють дефіцитні RMI1 миші BLM-подібний фенотип.
RMI1 та регулювання клітинного циклу
Режим дії RMI1 в регуляції енергетичного гомеостазу може базуватися на регуляції гіперплазії адипоцитів. Дослідження показали, що нокдаун siRNA RMI1 призвело до придушення проліферації клітин [[24]]. Однак експресія RMI1 регулюється в черевній тканині жирової тканини мишей з ожирінням та діабетом, які демонструють гіперплазію адипоцитів, що припускає, що RMI1 може бути пов'язаний з розвитком накопичення ліпідів у метаболічних тканинах, що призводить до ожиріння [[19]]. Нещодавно ми спостерігали, що лікування глюкозою збільшує експресію RMI1 у клітинних лініях, похідних адипоцитів. Що цікаво, як рівень мРНК E2F5, так і E2F8 збільшувався при лікуванні глюкозою, як це спостерігається при RMI1, і збиття сіРНК цих генів пригнічувало експресію RMI1. Крім того, комп'ютерний аналіз показав докази консенсусних місць елементів відповіді на E2F у промоторі RMI1 (Suwa A, Kurama T, Shimokawa T та Aramori I, неопубліковані спостереження), вказуючи на те, що E2F може трансактивувати промотор. У сукупності ці результати вказують на те, що експресія RMI1 може регулюватися молекулами сімейства E2F в жировій тканині в умовах високого вмісту глюкози, впливаючи на проліферацію преадипоцитів.
RMI1 як нова мета для лікування ожиріння
Останні дослідження в природних умовах і в пробірці продемонстрували, що RMI1 відіграє важливу роль у регуляції енергетичного гомеостазу завдяки взаємодії з шляхами E2F, принаймні частково, припускаючи участь у регуляції гіперплазії адипоцитів. Експресія RMI1 індукується глюкозою в пробірці, і його в природних умовах експресія також зумовлена метаболічними порушеннями, такими як гіперглікемія та ожиріння в метаболічних тканинах, таких як печінка та жирова тканина.
Висновки
Ожиріння розвивається внаслідок порушення гомеостазу між споживанням їжі та витратою енергії, і тому фактори, що впливають на ці процеси, є предметом великих досліджень, спрямованих на розробку ефективних препаратів проти ожиріння. На сьогодні, однак, у цій справі було досягнуто лише обмеженого успіху [[28]], що підкреслює потребу в додаткових терапевтичних варіантах. Нещодавно повідомлялося про цікаві нові підходи та цілі лікування ожиріння, багато з яких цитувалися в інших міні-оглядах цієї серії. Одним з таких підходів є концепція центральної регуляції, орієнтована на шлях малоніл-КоА [[29]], тоді як інший підхід використовує медіатор запалення, що походить від адипоцитів [[30]]. Однак тут ми зосереджуємось на нещодавно визначеному новому підході, що стосується гіперплазії адипоцитів, який чітко відрізняється як від центрального, так і від запального підходу. Враховуючи, що низка молекулярних причин пов’язана з розвитком ожиріння, поєднання цих різних підходів, ймовірно, є найбільш ефективним методом лікування.
Надмірне споживання калорій, пов’язане з гіперфагією та вживанням дієти з високим вмістом жиру у мишей, призводить до накопичення зайвої енергії, спочатку через збільшення розміру адипоцитів. Однак, оскільки адипоцити мають обмежену здатність до збільшення, довготривале надходження надлишкових калорій в кінцевому підсумку призводить до збільшення кількості адипоцитів для зберігання надлишкової енергії. У цьому міні-огляді ми узагальнили докази щодо регуляції числа адипоцитів як нового перспективного підходу до лікування ожиріння, і цей підхід може представляти ціль для нових препаратів проти ожиріння, які запобігають гіперплазії адипоцитів. Однак будь-який терапевтичний потенціал на сьогодні недостатньо добре встановлений, і тому більш детальне розуміння гіперплазії адипоцитів у людини є важливим для розробки ефективних та безпечних методів лікування. Як підкреслювалось тут, RMI1 є однією з найбільш перспективних цілей лікування ожиріння, яка може сильно вплинути на догляд за пацієнтами із ожирінням.
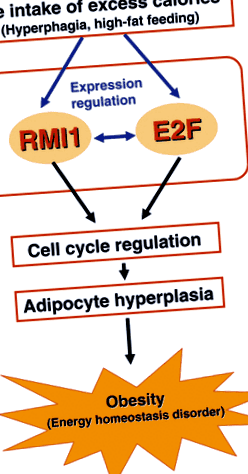
Наша гіпотетична модель регуляції гіперплазії адипоцитів за допомогою RMI1 показана на рис. 1. Надмірне споживання калорій індукує експресію RMI1 та E2Fs в адипоцитах, і ці зміни в експресії, як очікується, збільшать позитивну взаємодію між молекулами. Підвищена експресія RMI1 та E2F таким чином регулює клітинний цикл, що призводить до гіперплазії адипоцитів та розвитку ожиріння. Очевидно, необхідні подальші дослідження для вивчення детального механізму та взаємодії між молекулами RMI1 та E2F, а також для визначення клінічної значимості RMI1.
Гіпотетична модель регуляції гіперплазії адипоцитів за допомогою RMI1. Надмірне споживання калорій через гіперфагію та годування з високим вмістом жиру індукує експресію RMI1 та E2Fs в адипоцитах і викликає позитивну взаємодію між молекулами. Підвищена експресія RMI1 та E2F регулює клітинний цикл, що призводить до гіперплазії адипоцитів та подальшого розвитку ожиріння.
Подяки
Ми вдячні докторам Масао Като, Ічіро Араморі, Хітоші Мацусіме, Масато Коборі, Джиро Хіросумі, Масаясу Йосіно, Шун-Ічіро Мацумото та Масанорі Найтоу з Astellas Pharma Inc. поради та підтримка.
- Статистика раку, 2011 - Зігель - 2011 - CA Журнал раку для клініцистів - Інтернет-бібліотека Wiley
- Застосування алгоритмів лікування ожиріння до канадських дорослих European Journal of Clinical
- Кесарів розтин та індекс маси тіла серед датських чоловіків - Свенссон - 2013 - Ожиріння - Wiley Online
- Асоціація між перекусом та ожирінням у дітей огляд Nuru International Journal Of
- Помилки, пов’язані з ІМТ, у вимірі ожиріння International Journal of Obesity