Генетика господаря та склад дієти взаємодіють для модуляції мікробіоти кишечника та схильності до метаболічного синдрому у щурів, спонтанно схильних до гіпертонічної хвороби
Кафедра виробничого здоров'я тварин, факультет ветеринарної медицини, Університет Калгарі, Калгарі, Альберта, Канада
Кафедра виробничого здоров'я тварин, факультет ветеринарної медицини, Університет Калгарі, Калгарі, Альберта, Канада
Департамент тваринницьких та харчових наук, Університет штату Оклахома, Стілвотер, штат Оклахома, США
Кафедра виробничого здоров'я тварин, факультет ветеринарної медицини, Університет Калгарі, Калгарі, Альберта, Канада
Кафедра виробничого здоров'я тварин, факультет ветеринарної медицини, Університет Калгарі, Калгарі, Альберта, Канада
Дослідницька група шлунково-кишкового тракту, Інститут хронічних захворювань Снайдера, Університет Калгарі, Калгарі, Альберта, Канада
Листування: Кафедра виробничого здоров'я тварин, факультет ветеринарної медицини, Університет Калгарі, HS 1871, 3330 Лікарня Dr. NW, Калгарі, AB T2N 4N1, Канада. Електронна пошта: [email protected]
Кафедра виробничого здоров'я тварин, факультет ветеринарної медицини, Університет Калгарі, Калгарі, Альберта, Канада
Кафедра виробничого здоров'я тварин, факультет ветеринарної медицини, Університет Калгарі, Калгарі, Альберта, Канада
Департамент тваринницьких та харчових наук, Університет штату Оклахома, Стілвотер, штат Оклахома, США
Кафедра виробничого здоров'я тварин, факультет ветеринарної медицини, Університет Калгарі, Калгарі, Альберта, Канада
Кафедра виробничого здоров'я тварин, факультет ветеринарної медицини, Університет Калгарі, Калгарі, Альберта, Канада
Дослідницька група шлунково-кишкового тракту, Інститут хронічних захворювань Снайдера, Університет Калгарі, Калгарі, Альберта, Канада
Листування: Кафедра виробничого здоров'я тварин, факультет ветеринарної медицини, Університет Калгарі, HS 1871, 3330 Лікарня Dr. NW, Калгарі, AB T2N 4N1, Канада. Електронна пошта: [email protected]
АНОТАЦІЯ
СКОРОЧЕННЯ
Ми визначили вплив HFD та нормальної дієти чау на споживання їжі, ЕЕ, склад тіла, артеріальний тиск, гормони та ліпіди плазми, мікробіоти кишечника, тканинні маркери термогенезу та параметри гіпертонії в периферичних тканинах щурів SHRSP та порівняли ці показники з такими у щурів WKY. Щоб визначити, чи HFD десенсибілізує щурів SHRSP та WKY до периферичного гормонального сигналу насичення, ми оцінили зміни у споживанні їжі у відповідь на системні ін’єкції агоніста рецептора GLP ‐ 1 exendin ‐ 4. Щоб з'ясувати, чи опосередковуються зміни ЕЕ через симпатичну сигналізацію, вводили пропранолол (β-1 та β-2 -антагоніст адренергічних рецепторів). Щоб оцінити змінені компоненти ЕЕ, ми визначили ЕЕ в умовах відмови від їжі, а також ЕЕ після їжі. Враховуючи те, що м’язи суттєво вносять в ЕЕ всього тіла (47–49) і що коричнева жирова тканина (НДТ) важлива для адаптивного не тремтливого термогенезу (49, 50) у щурів, ми визначили ключові транскрипти термогенезу в м’язах, НДТ та заочеревинно-жирові тканини.
МАТЕРІАЛИ І МЕТОДИ
Тварини, житло та дієти
Протокол догляду за тваринами був затверджений Комітетом з догляду за тваринами Університету Калгарі (Протокол AC12‐0033). Самці щурів SHRSP (n = 14, штам 324; Charles River Laboratories, Монреаль, QC, Канада) та щури WKY (n = 14, штам 008; Charles River Laboratories, Монреаль, QC, Канада) у віці 5 тижнів розміщувались індивідуально в Комплексній лабораторній системі моніторингу тварин (CLAMS; Columbus Instruments, Columbus, OH, USA) та були акліматизовані протягом 1 тижні на дієті чау (5053 PicoLab Дієта на гризунах 20; LabDiet, Сент-Луїс, Міссурі, США). Оскільки щури SHRSP були отримані від щурів SHR, які, в свою чергу, були отримані від щурів WKY (17–19), для порівняння використовували нормотензивних щурів WKY. Температуру (23–24 ° C) та вологість (21–24%) контролювали в приміщеннях для тварин з 12-годинним циклом світло/темрява (світло вимикається о 10:30). Щоденний догляд та утримання тварин проводився між 8:30 і 10:30 ранку, забезпечувались їжею та водою ad libitum протягом усього дослідження.
Вивчати дизайн
Вимірювання енергетичного балансу
Споживання їжі, виробництво тепла та ЕЕ контролювали протягом 22 годин (з 10:30 до 08:30 наступного дня) за допомогою CLAMS, дотримуючись наших опублікованих процедур (31). Витік їжі реєстрували вручну та використовували для корекції щоденного споживання їжі перед проведенням статистичного аналізу. Обсяг споживаного кисню (Vo2, мл/кг маси тіла/год), виробленого вуглекислого газу (Vo2, мл/кг маси тіла/год) та коефіцієнт дихання (RQ), реєстрували непрямою калориметрією (CLAMS; витрата 2 л/хв та інтервал відбору проб pling48 хв). Загальна ЕЕ була розрахована за попередньою публікацією Singh та ін. (60), використовуючи таке рівняння: Vo2 × [3,815 + (1,232 × RQ)]. Оскільки термонейтральна зона для більшості штамів щурів становить 28–30 ° C (61), наші умови утримання та температура клітини CLAMS (25–26 ° C) можуть бути не ідеальними для тестування термогенезу як такі.
Вимірювання маси тіла та складу тіла
Масу тіла реєстрували щотижня за допомогою звичайної ваги. Склад тіла вимірювали щотижня у анестезованих щурів за допомогою аналізатора ЯМР Minispec LF ‐ 110 (Bruker Optics, Milton, ON, Canada). Ефективність приросту розраховували як відношення сукупного споживання енергії (Ккал) до приросту ваги (кг) після 12 тижнів дієтичного втручання.
Внутрішньочеревинний тест на толерантність до глюкози
Для внутрішньочеревного тесту на толерантність до глюкози (IPGTT), після того, як його не годували протягом ночі (~ 16 год), внутрішньочеревно вводили 50% розчин декстрози в дозі 2 г/кг маси тіла через 3 та 8 тижнів після початку дієтичного лікування (31). Концентрацію глюкози в крові визначали з підшкірної вени за допомогою ручного глюкометра (глюкозометр Accu-Chek; Рош, Базель, Швейцарія) через 0, 30, 60 та 120 хв після ін’єкцій декстрози.
Вимірювання артеріального тиску
Вимірювання артеріального тиску реєстрували на 1,3, 5, 7 та 11 тижнів дослідження, використовуючи сфігмоманометр із зворотним манжетом (Coda System; Kent Scientific, Torrington, CT, USA), як ми вже описали раніше (31). Коротко кажучи, щурів акліматизували в утримуючих клітках Боллмана протягом 2 днів (30 хв/день) до вимірювання артеріального тиску між 9:00 ранку та 12:00 ранку. У день вимірювання щурів утримували і хвости попередньо розігрівали до 34 ° C на 10–15 хв. Було проведено щонайменше 5 вимірювань, а середнє значення 3 найбільш стабільних записів артеріального тиску в кожен момент часу було враховано для статистичного аналізу, як повідомляли ми (31) та інші (62).
Забір крові та тканин після прийому їжі
Після 12 тижнів дієтичного втручання було проведено фізіологічний тест на толерантність до змішаної їжі (63, 64). Коротко кажучи, після того, як їх не годували протягом ночі (~ 16 год), щурам надавали доступ до відповідних дієт протягом 1 год. Щури, які годувались дієтою чау, споживали 17,5 ккал, тоді як щури, що годувались HFD, споживали 20 ккал під час дозволеного доступу до їжі. Зразки крові відбирали з підшкірної вени до і потім через 1 та 2 год після доступу до їжі для аналізів на гормони та метаболіти. Зразки крові відбирали у пробірки, що містять ЕДТА (1,5 мг/мл крові), коктейль інгібітора протеази (10 мкл/мл крові; MilliporeSigma) та внутрішньовенний інгібітор дипептидилпептидази (10 мкл/мл крові; MilliporeSigma), центрифугували для відділення плазми та зберігають при -80 ° C до аналізу. Концентрацію глюкози в крові вимірювали за допомогою глюкометра у вищезазначені часові моменти. Після забору крові тварин евтаназували CO2; печінку, нирки, скелетні м'язи, міжлопаткову BAT та заочеревинну жирову тканину збирали після промивання в стерильному PBS, заморожували в рідкому азоті та згодом зберігали при -80 ° C до подальшого аналізу. Відсоток жиру в печінці вимірювали за допомогою біопсійного зонда ЯМР-аналізатора Minispec LF110.
Кількісне визначення концентрації гормонів у плазмі крові та тригліцеридів
Концентрації інсуліну в плазмі, глюкозозалежний інсулінотропний пептид (GIP), GLP-1, С-пептид, поліпептид підшлункової залози (PP) та лептин визначали за допомогою Luminex Multiplex ELISA (MilliporeSigma) незалежною лабораторією (Eve Technologies, Calgary, AB, Канада). Оскільки лише 4 з 40 зразків мали показники GLP ‐ 1 за результатами аналізу, дані не враховувались для подальшого аналізу. Кількісний індекс перевірки чутливості до інсуліну (Quickl) розраховували з використанням 1/[log (глюкоза в плазмі натще) + log (інсулін у плазмі натще)] (65). Концентрацію тригліцеридів у тканинах плазми та печінки визначали за допомогою комерційного набору для аналізу (STA-396; Cell Biolabs, Сан-Дієго, Каліфорнія, США) відповідно до протоколу виробника.
Напівкількісна ПЛР у режимі реального часу
Виділення ДНК бактеріальної клітини та секвенування 16S рРНК
Аналіз мікробіоти кишечника
Статистичний аналіз
РЕЗУЛЬТАТИ
Годування з високим вмістом жиру різним чином впливає на енергетичний баланс у щурів SHRSP та WKY
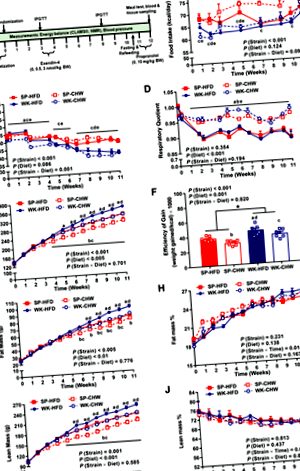
Основний вплив штаму та взаємодії штаму та дієти з часом на споживання їжі та ЕЕ були значними. Середнє щотижневе споживання їжі щурами SHRSP було більшим, ніж у щурів WKY, протягом перших 5 тижнів дослідження, причому щури SHRSP, що годувались чау, споживали більше, ніж ті, що отримували HFD, між 7 та 10 тижнями (рис. 1B). Подібно реакціям на вживання, загалом у щурів SHRSP було значно більше середнього рівня ЕЕ та вироблення тепла, ніж у щурів WKY (рис. 1C. та додатковий рис. S1М). Хоча дієта не впливала на ЕЕ щурів SHRSP, HFD сприяв підвищенню ЕЕ у щурів WKY порівняно з їх аналогами, що годували чау протягом 28 днів (рис. 1C.). Протягом усього дослідження спостерігався значний дієтичний ефект на RQ як у щурів, що годували чау, як у SHRSP, так і у WKY, що збільшували RQ, ніж їх аналоги з високим вмістом жиру (рис. 1).D).
Основний вплив штаму та взаємодії штаму та дієти з часом на масу тіла та склад були значними (P
Гіпофагічні ефекти екзендіну-4 зменшуються у щурів SHRSP та при згодовуванні жиру
Були значні основні ефекти наркотиків, дієти, штаму та часу та їх взаємодії на сукупне споживання енергії (P
Щури SHRSP мають більшу кількість недоїданого та після їжі ЕЕ, ніж щури WKY, але збільшення витрат щурів SHRSP менш реагує на системну симпатичну блокаду
Хоча споживання після годування не відрізнялося між групами (P > 0,05, Рис. 3A), як у щурів SP-CHW, так і у SP-HFD, показник RQ нижчий, ніж у щурів WKY, протягом 12 год після повторного годування (рис. 3B). Більше того, ЕЕ щурів SHRSP було значно більше, ніж щурів WKY, протягом ~ 12 год позбавлення їжі та після повторного годування, особливо в темний період (рис.C.). Однак, на відміну від щурів SHRSP, щури WKY мали більший приріст індукованого HFD незгодованого ЕЕ (рис.3).C, D). Примітно, що симпатична блокада пропранололом виявила основні ефекти штаму, препарату та їх взаємодії на ЕЕ (рис.3).Е, Ж). Порівняно з транспортним засобом, пропранолол суттєво знизив ЕЕ у щурів WK-CHW, WK-HFD та SP-CHW, але не у щурів SP-HFD (рис. 3Е). Сукупний ЕЕ знизився на 19, 23 та 9% після введення пропранололу відповідно щурам WK-CHW, WK-HFD та SP-CHW, але не у щурів SP-HFD (рис.3).F). Таким чином, у щурів SHRSP спостерігається більша кількість неприкормленого та постпрандіального ЕЕ, але вони менш чутливі, ніж щури WKY, на індуковане HFD збільшення необробленого ЕЕ та на антагонізм β ‐ 1/β ‐ 2.
Маркери термогенезу регулюються в периферичних тканинах щурів SHRSP
Годування з високим вмістом жиру не змінює кров’яний тиск, але сприяє непереносимості глюкози, модулює гормони плазми, підвищує тригліцериди та сприяє печінковому ліпідозу у щурів SHRSP
Хоча вплив дієти на артеріальний тиск не був значним (P > 0,05), були значні деформації (P
Годування з високим вмістом жиру протягом 3 тижнів викликало порівнянну непереносимість глюкози як у щурів SHRSP, так і у WKY (P
Генетика дієти та господаря істотно змінює мікробіоти кишечника
Відносна кількість мікробного складу кишечника на рівні типу серед усіх груп представлена в Рис. 6A. Встановлено, що дієта найбільше впливає на склад мікробної спільноти (P 2 = 25%) і штам, що має менший, але все ще значний (P = 0,001, Р. 2 = 12%) ефект (рис. 6B). Був значний дієтичний ефект (P
ОБГОВОРЕННЯ
Попередні дослідження показали, що годування з високим вмістом жиру погіршує пригнічення прийому їжі периферичними гормонами ситості, такими як холецистокінін та GLP ‐ 1, у щурів, схильних до ожиріння (34, 36–38). Відповідно до цих звітів, ми також виявили, що щури SHRSP та WKY, що годуються HFD, були менш чутливими до гальмування прийому їжі агоністом рецептора GLP ‐ 1, екзендіном ‐ 4. Незважаючи на те, що споживання калорій щурами SHRSP, що харчуються чау, може бути незначно завищеним, незважаючи на поправки щодо витоку, проте споживання було порівнянно з нашим попереднім звітом (31). Гіперфагія у SHRSP навряд чи може бути зумовлена порушенням регуляції секреції периферичних гормонів GIP, лептину та PP, оскільки їх концентрація в циркуляції не відрізнялася між щурами SHRSP та WKY ні в період не годування, ні після їжі. Цікаво, що величина придушення споживання калорій екзендіном-4 була меншою у SHRSP, ніж у щурів WKY, що свідчить про те, що рецептор GLP ‐ 1, що опосередковує насичення, дуже ймовірно порушений у SHRSP. Також цілком ймовірно, що орексигенні сигнали, вторинні до збільшення витрат SHRSP, можуть зменшити анорексигенні ефекти екзендіну-4; чи інші механізми нейро-гуморальної сигналізації кишечника також не функціонують у щурів SHRSP, залишається визначити.
Підводячи підсумок, ми демонструємо, що годування з високим вмістом жиру порівняно підвищувало показники ожиріння та гіпертригліцеридемії як у щурів SHRSP, так і у WKY, але щури SHRSP мають унікальні характеристики, включаючи гіперфагію, знижену чутливість до гіпофагічних ефектів сигналів ситості кишечника, обмежену здатність очищати глюкозу після прийом їжі, дисбіотична флора кишечника та стійка гіпертензія. Таким чином, щури SHRSP охоплюють принаймні 3 з 5 основних ознак метаболічного синдрому і мають значний потенціал для розкриття складної взаємодії генетики, дієти та мікробіоти кишечника, що виникає з метаболічним синдромом.
ПОДЯКИ
А.С. був підтриманий Джеральдом Л. (Джері) Вебер Космополітичний міжнародний клуб стипендії Калгарі. Робота була підтримана грантом від Фонду серця та інсульту Канади (G ‐ 18‐0022205), підтримкою інфраструктури від Канадського фонду для інновацій (18617) та Альбертської передової освіти та технологій (URSI ‐ 09‐ 008 ‐ SEG) до ПКК, а також Міжнародним центром мікробіомів при Університеті Калгарі. Високопродуктивні обчислення забезпечив Університет Калгарі Центр геноміки та інформатики здоров’я. Автори не заявляють конфлікту інтересів.
ВНОСИ АВТОРА
А. Сінгх та П. К. Челікані розробляли дослідження; А. Сінгх, Р. С. Запата, А. Пезешки та П. К. Челікані проводили експерименти на тваринах; А. Сінгх провів лабораторні аналізи та склав статтю; M. L. Workentine проводив аналіз мікробіоти кишечника; і А. Сінгх та П. К. Челікані провели статистичний аналіз та написали рукопис, редагуючи інші автори.
- Вплив складу раціону на калорійність, споживання води та масу органів щурів
- Як розпочати детоксикацію; Проект пивної дієти
- Чи є ваша собака жирною Фітнес-трекери допомагають садити домашніх вихованців на дієту Health24
- Як дотримуватися дієти
- Головні болі після голодування - швидка дієта