Генетичні предиктори втрати ваги у осіб із надмірною вагою та ожирінням
Предмети
Анотація
Вступ
Ожиріння - одна з найбільших проблем охорони здоров’я, яка загрожує як розвиненим, так і нерозвиненим країнам. Європейське опитування охорони здоров'я вказує, що в Іспанії 18% дорослих страждають ожирінням, а 37% мають надлишкову вагу, що вище загального поширення ожиріння в Європі, яке, за оцінками, становить 12% 1. Ожиріння передбачає надлишок жиру в організмі та збільшує ризик розвитку численних супутніх захворювань, таких як серцево-судинні захворювання (ССЗ), обструктивне апное сну, діабет 2 типу, різні типи раку та остеоартроз, особливо у осіб із центральним відкладенням жирової тканини 2. Було встановлено, що 4 мільйони смертей у всьому світі можна віднести до надмірної ваги та ожиріння, і більше двох третин цих смертей спричинені ССЗ 2. За оцінками, для кожної одиниці підвищеного індексу маси тіла (ІМТ) ризик ССЗ зростає на 8% 3 .
Терапевтичний підхід при надмірній вазі та ожирінні базується на модифікації способу життя, профілактичних програмах, модифікації поведінки та, в крайньому випадку, на застосуванні ліків або баріатричної хірургії 4. Зміни у способі життя включають поєднання модифікації дієти, як правило, з гіпокалорійною дієтою, та збільшення фізичної активності. Однак існує велика міжособистісна варіабельність реакції на втрату ваги, і не всі суб'єкти реагують однаково на одне і те ж втручання 5,6. Хоча дотримання є головним фактором, що визначає реакцію на втручання у зниженні ваги, нещодавно також було продемонстровано генетичний компонент 7,8. Це цілісно, враховуючи, що розвиток ожиріння має сильний генетичний компонент 9 і що приблизно 50–70% дисперсії ІМТ пов’язано з генетичними відмінностями 10. Визначення генів, які можуть визначити ефективність стратегій схуднення, може призвести до нових підходів до лікування та профілактики наростаючої пандемії ожиріння.
Незважаючи на те, що в останнє десятиліття багато досліджень стосувались генетичної складової ожиріння, гени, пов'язані з диференційованою терапевтичною реакцією на заходи щодо зниження ваги, вивчались набагато рідше. Ми мали на меті дослідити генетичні фактори, які могли б передбачити втрату ваги, вивчаючи велику когорту осіб з ІМТ> 25 кг/м 2, які дотримувались однорідного дієтичного втручання та програми фізичних вправ і яких спостерігали протягом декількох років.
Матеріали і методи
Предмети
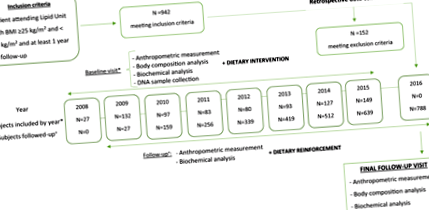
У цьому ретроспективному когортному дослідженні брали участь особи, які відвідували відділ ліпідів у лікарні Університету Мігеля Сервета в Сарагосі (Іспанія).
Усі неспоріднені особи у віці ≥18 років, будь-якої статі, з ІМТ від 25 до 40 кг/м 2, які проходили спостереження ≥1 рік і які відвідували відділення ліпідів у лікарні Мігеля Сервета із Сарагоси з 1 січня, 2008 до 31 грудня 2016 року мали право на включення. Критерії виключення включали особисту історію злоякісних утворень, запальних захворювань кишечника, баріатричну хірургію та прийом препаратів проти ожиріння. Нарешті, було включено 788 суб’єктів із надмірною вагою або ожирінням (рис. 1).
Схематичне зображення ретроспективної блок-схеми відбору сукупності для цього дослідження. ІМТ: Індекс маси тіла.
Для вивчення СНВ, пов’язаних із зайвою вагою та ожирінням, ми випадковим чином відібрали контрольну групу непов’язаних осіб із нормальним ІМТ (18,5–25 кг/м 2), які відвідували Ліпідну клініку протягом періоду спостереження. Нарешті, було включено 168 контрольних суб’єктів.
Усі суб’єкти підписали інформовану згоду на протокол, який раніше затвердив наш місцевий комітет з питань етики (Comité Ético de Investigación Clínica of Aragón, Saragoza). Усі методи були виконані відповідно до відповідних керівних принципів та положень, і вони були попередньо схвалені нашим місцевим комітетом з етики (Comité Ético de Investigación Clínica of Aragón, Saragoza).
Клінічні, антропометричні та біохімічні вимірювання
Базові дані були зібрані під час першого відвідування підрозділу. Вимірювали вагу, зріст, ІМТ та обхват талії. Ми також оцінили склад тіла за біоелектричним імпедансом (Tanita TBF 410 GS, Omron Corporation, Токіо, Японія), як описано раніше 16. Під час клінічного опитування реєстрували особисту та сімейну історію серцево-судинних захворювань та інших супутніх захворювань, таких як гіпертонія та вживання ліків. Зразки етилендіамінтетраоцтової кислоти та сироватки плазми крові збирали у всіх учасників через 6 тижнів без гіполіпідемічних препаратів та принаймні через 10 годин голодування. Загальний рівень холестерину та тригліцеридів визначали стандартними ферментативними методами, а рівні холестерину ліпопротеїнів високої щільності вимірювали методом оксидази (UniCel DxC 800; Beckman Coulter Inc., Brea, Каліфорнія, США), як описано раніше 17. Холестерин ЛПНЩ розраховували за формулою Фрідевальда. Рівень глюкози в сироватці крові оцінювали методом глюкозооксидазного лікування.
Базова оцінка дієти була проведена за допомогою раніше опублікованої перевіреної анкети щодо частоти харчування. Прийом їжі та поживних речовин розраховували як частоту х поживного складу окремих розмірів порцій, у яких частоти поділяли на 9 категорій (ніколи, 1–3 рази на місяць, 1 раз на тиждень, 2–4 рази на тиждень, 5–6 разів на тиждень, 1 раз на день, 2–3 рази на день, 4–6 разів на день і> 6 разів на день) для кожного продукту харчування. Загальне споживання енергії та поживних речовин було розраховано на основі раніше затвердженого іспанського складу харчових продуктів Таблиці 18 .
Дієтичне втручання
Усі випробовувані отримували загальне дієтичне консультування на основі дієтичних рекомендацій щодо надмірної ваги та ожиріння 19 та управління ліпідним профілем відповідно до міжнародних рекомендацій 20. Дієтичні поради були зосереджені на збільшенні споживання фруктів, овочів, цільних зерен, горіхів, поліненасичених жирних кислот, нежирних молочних продуктів, нежирного м'яса та риби та зменшенні споживання насичених жирних кислот, червоного та обробленого м'яса, безалкогольних напоїв, алкоголю та інші підсолоджені продукти. Учасникам спонукали підвищити рівень фізичної активності з урахуванням їх фізичного стану. Всі рекомендації були надані двома спеціалістами-дієтологами на початковому рівні, і вони були посилені під час кожного наступного візиту. Рецепт калорій кожного учасника був представлений дефіцитом у 300 ккал/добу, який був розрахований за оцінками споживання енергії. Споживання енергії оцінювали множенням коефіцієнта активності (витрати енергії на різні види діяльності, встановлені ВООЗ) на витрати енергії в спокої, розраховані за рівнянням Гарріса-Бенедикта.
Слідувати
Усі випробовувані відвідували 3 подальші візити протягом першого року та один наступний раз на рік після цього. Ці наступні візити включали клінічні, антропометричні та вимірювання ліпідного профілю та посилення рекомендацій щодо способу життя. Нові діагнози злоякісних утворень, запальних захворювань кишечника або баріатричної хірургії також були критеріями виключення для подальших візитів. Зміна ваги була розрахована за наступною формулою: різниця між базовою вагою та кінцевою вагою, поділена на базову вагу. Зміни глюкози розраховували за тією ж формулою: різницю між вихідною глюкозою та кінцевою глюкозою, поділеною на вихідну глюкозу. Ми класифікували випробовуваних на 3 категорії відповідно до втрати ваги: випробовувані, які втратили більше 2% ваги тіла, випробовувані, які набрали більше 2% ваги, та випробовувані, які залишалися в межах 2% ваги. Ми вибрали ці граничні точки для створення груп з відносно однорідним розміром вибірки. Крім того, ми провели субаналіз, використовуючи 5% замість 2% як граничну величину, і ця класифікація була використана в кінці першого року та в кінці періоду подальшого спостереження.
Генетичний аналіз
Геномну ДНК цільної крові виділяли стандартними методами. Вибір СНВ базувався на попередніх асоціаціях із ожирінням принаймні у двох незалежних ГВС 21,22,23,24,25,26,27,28,29,30,31,32,33 та частоті понад 5% алель ризику в загальній популяції. Сюди входило наступне локуси: BDNF, CADM2, FANCL, FLJ35779, FTO, GNPDA2, HOXC13, KCTD15, LRP1B, LRRN6C, LY86, КАРТА2K5, NFE2L3, NRXN3, PRKD1, RBJ, RPL27A, RSPO3, SEC. 16В, SH2B1, TFAP2B, TMEM18, ТННІ3К, VEGFA і ZNRF3-KREMEN1. SNV генотипували у всіх суб’єктів одночасно за допомогою зондів TaqMan (Thermo Fisher) із застосуванням стандартних методів. АПОЕ Генотип визначали шляхом секвенування ДНК екзону 4, як описано раніше 34. Ми визначили алель ризику як алель, який асоціюється із ожирінням, згідно з GWAS, які використовувались для відбору SNV.
Статистичний аналіз
Аналізи проводили за допомогою SPSS версії 24.0 (Чикаго, Іллінойс, США). Рівень значущості був встановлений на рівні P 2, а втрату маси тіла аналізували згідно з квартилями за допомогою зваженого генетичного балу (див. Нижче) за допомогою тесту ANOVA.
Зв'язок зміни глюкози з SNVs аналізували за допомогою лінійної регресійної моделі, використовуючи зміну глюкози протягом періоду спостереження як залежну змінну та коригуючи модель для зміни ваги протягом періоду спостереження, років спостереження, віку, статі і всі SNV. Цей аналіз був проведений після виключення пацієнтів з діабетом 2 типу.
Генетична оцінка
Генетичний бал розраховували для кожного суб'єкта з використанням суми присутності (для домінантної або рецесивної моделі, відповідно) генотипів ризику в 25 досліджених СНВ.
Результати
Це дослідження було проведено з когортою, яка включала 788 пацієнтів із надмірною вагою з ІМТ> 25 кг/м 2, які пройшли щонайменше один рік спостереження та 168 контрольних з ІМТ 2. Пацієнти із зайвою вагою були старшими, включали більший відсоток чоловіків і мали нижчий рівень холестерину ЛПВЩ та більшу поширеність діабету та гіпертонії, ніж у контрольних груп. Відсутність різниці в загальному рівні холестерину, тригліцеридів, холестерину ЛПНЩ або АПОЕ генотип виявлено між групами (табл. 1).
Частоту алелю ризику ожиріння для кожного з 25 СНВ порівнювали між пацієнтами із зайвою вагою та контролем. Частота алелів ризику одного SNV в CADM2 було значно вищим у пацієнтів із надмірною вагою, ніж у контрольних (стор = 0,007), і два алелі ризику СНВ в KCTD15 і LY86 гени були значно нижчими у пацієнтів із надмірною вагою, ніж у контрольних (стор = 0,022 і стор = 0,047 відповідно). Частота алелів ризику одного SNV у GNPDA2 гена був значно вищим у пацієнтів із надмірною вагою, ніж у базі даних проекту 1000 Genomes RBJ ген був значно нижчим у пацієнтів із надмірною вагою, ніж у базі даних проекту 1000 геномів (p = 0,014 та p Рисунок 2
Зміни ІМТ протягом періоду спостереження. ІМТ: Індекс маси тіла. стор значення обчислювали парним t-тестом.
Зв'язок між зміною ваги та кожним SNV аналізували за допомогою лінійного регресійного аналізу. Ми класифікували кожен SNV на рецесивні та домінантні моделі для алеля ризику. П’ять SNV (rs7359397, rs2112347, rs29941, rs10150332, rs4929949) були суттєво пов’язані зі зміною ваги. Перший (rs7359397) був сумісний з домінуючою моделлю, а решта - з рецесивними моделями на основі їх ефектів. SNV rs2112347 та rs10150332 були суттєво пов'язані зі зміною ваги протягом першого року, а інші 3 SNV були суттєво пов'язані зі зміною ваги в кінці подальшого спостереження.
Щоб проаналізувати зміну надлишкової ваги тіла незалежно від SNV, ми вивчали втрату маси тіла відповідно до генетичних бальних квартилів. Не було суттєвої різниці між базовою надлишковою масою тіла на основі генетичного балу квартиля (р = 0,262). Однак існували суттєві відмінності у втраті надмірної маси тіла, у яких особи у нижньому квартилі мали значно більшу втрату надмірної ваги (p Таблиця 6 Базова вихідна вага тіла та втрата надмірної маси тіла відповідно до генетичного балу.
Враховуючи тісний взаємозв’язок між вагою та глюкозою, ми вивчали вплив досліджуваних SNV на зміни глюкози в кінці спостереження. Ми розрахували зміну глюкози, пов'язану з кожним SNV, за допомогою однофакторних моделей лінійної регресії з урахуванням віку, зміни ваги, тривалості спостереження та статі. Два SNV, rs9491696 у рецесивній моделі та rs7359397 у домінантній моделі для своїх алелів ризику, показали статистично значущу асоціацію зі зміною глюкози (стор = 0,042 і стор = 0,040). Зміна ваги під час спостереження, а також тривалість спостереження, стать, вік та ці SNP пояснювали до 2,9% дисперсії зміни глюкози натще. Обидва SNV пояснювали 0,8% дисперсії зміни глюкози натще (Додаткова таблиця 6).
Обговорення
Ожиріння - це багатофакторний розлад, який має генетичний компонент, але на нього також впливає багато факторів навколишнього середовища. Перші генетичні дослідження ожиріння включали моногенні та екстремальні синдроми ожиріння, і дослідники зосередили свою увагу на дисфункції лептин-гіпоталамусового шляху 35. Зовсім недавно GWAS дозволили ідентифікувати багатьох локуси беруть участь у варіаціях ваги між індивідами, які пов’язані з найпоширенішими виразами ожиріння 15. Ці дослідження асоціацій сприяли виявленню нових генів, які механічно задіяні в патофізіології ожиріння 36. У цьому дослідженні ми виявили зв'язок між коротко- та довгостроковою втратою ваги та генетичною схильністю в іспанській когорті. Наші висновки показали, що суб’єкти з вищими генетичними балами, розрахованими за вибраними SNV, мали більший приріст ваги, як у короткостроковій, так і довгостроковій перспективі, ніж суб’єкти з нижчими генетичними балами.
Серед 25 проаналізованих нами SNV, які раніше були пов'язані з ожирінням, частота алелів трьох з них, rs13078807 у CADM2 ген, rs29941 у KCTD15 ген і rs1294421 у LY86 гена, суттєво відрізнялися на вихідному рівні між пацієнтами із зайвою вагою та контролем. Однак лише rs13078807 у CADM2 ген показав значно вищу поширеність алелю ризику у пацієнтів із надмірною вагою, ніж у контрольних груп. CADM2 є геном, який кодує медіатор синаптичної сигналізації, що збагачується в мозку, і CADM2 схоже, це пов'язано з ІМТ у GWAS 37,38. Попереднє дослідження показало, що варіант алелю ризику rs13078960 асоціюється із збільшенням CADM2 експресія в людському гіпоталамусі. Видалення Cadm2 у мишей із ожирінням зменшує жировість тканин, рівень глюкози натще і покращує чутливість до інсуліну. Тому, CADM2 відіграє роль потужного регулятора системного енергетичного гомеостазу 39 .
Генетичний бал, який ми розрахували із суми 25 SNV, які раніше були пов'язані з ожирінням, був значно вищим у пацієнтів із більшим збільшенням ваги, хоча варіація ваги, що пояснюється оцінкою, була невеликою (2,4%). Цей відсоток схожий на показники, отримані в балах, розроблених в інших дослідженнях, в яких автори вказували, що всі поєднані варіанти ІМТ пояснювали 2,7% варіацій ІМТ 38. Однак наш генетичний показник базується на 25 SNV; на відміну від генетичної оцінки, розробленої Локком та ін. базувався на 97 SNV 38. Тим не менше, цей відсоток далекий від 70% між-індивідуальних відмінностей у масі тіла, що пояснюються генетичними відмінностями між особами 42. Невідомі гени, що беруть участь у ожирінні, генетичних сімейних впливах та/або взаємодії генетичних факторів та факторів навколишнього середовища, є, мабуть, важливими факторами для пояснення цієї невідповідності.
Нарешті, ми знайшли два SNV, rs9491696 у RSPO3 ген і rs7359397 в SH2B1 гена, які були пов'язані зі змінами глюкози натще протягом періоду спостереження. Обидва SNV пояснювали 2% зміни глюкози при оцінці разом зі зміною ваги протягом періоду спостереження. Вираз SH2B1 зустрічається здебільшого в підшлунковій залозі, а також у печінці, скелетних м’язах та жировій тканині. Крім того, SH2B1 відіграє важливу роль у передачі сигналів інсуліну, як і можна було очікувати, враховуючи, що сигнальний шлях JAK-STAT також є внутрішньоклітинним сигнальним шляхом, що використовується рецептором інсуліну 27. Однак, RSPO3 раніше лише був пов’язаний з ІМТ, і його молекулярний шлях залишається невідомим 43 .
Наше дослідження має деякі обмеження: дієтичне втручання, включаючи загальне консультування, було не дуже інтенсивним, і період спостереження включав лише одне відвідування на рік. Однак метою нашого дослідження було не досягнення значного зниження маси тіла, а вивчення генетичного впливу на осіб із надмірною вагою або ожирінням, які дотримувались тих самих дієтичних рекомендацій. Учасники із зайвою вагою та ожирінням були набрані з ліпідної клініки, що могло бути упередженим в оцінці епідеміологічних чи генетичних впливів у нашому дослідженні 44. Однак спосіб життя особливо важливий для цих пацієнтів, і нові дослідження на цю тему серед загальної популяції будуть необхідні для екстраполяції наших результатів на здорове населення. Ми генотипували 25 SNV, і існує принаймні 940 відомих SNV, які пов’язані з ІМТ. Однак ми спостерігаємо, що дисперсія, яка пояснюється нашими оцінками, подібна до тієї, яку пояснює Локк та ін. з їх оцінкою на основі усіх 97 SNV.
На закінчення, генотипування 25 СНВ, які раніше були пов'язані з ожирінням у великої когорти суб'єктів із надмірною вагою та ожирінням, дозволило розробити генетичний показник, який пояснював 2,4% зміни ваги протягом періоду спостереження. Крім того, суб’єкти з нижчими генетичними показниками демонстрували підвищену втрату ваги протягом періоду спостереження. Однак ці відсотки повинні зростати, щоб використовувати цей генетичний показник як прогностичний маркер втрати ваги. Потрібні подальші дослідження для повного розуміння ролі генетики та епігенетики в ожирінні, що може призвести до кращого управління та профілактики цієї пандемії.
Список літератури
Співробітники GBD 2015 з ожиріння. та ін. Вплив зайвої ваги та ожиріння на здоров’я в 195 країнах протягом 25 років. Н. Енгл. J. Med. 377, 13–27 (2017).
Гонсалес-Муньєса, П. та ін. Ожиріння. Нат. Преподобний Діс. Буквар 3, 17034 (2017).
- Вплив споживання фруктів на індекс маси тіла та втрату ваги у вибірці із надмірною вагою та ожирінням
- Добавка до рибного желатину та добавка омега-3 у пацієнтів із ожирінням та надмірною вагою, які отримують інсулін
- Кастинг надмірна вага жінок для ток-шоу про схуднення
- Вплив дієти на рибі та втрати ваги на концентрацію лептину в сироватці крові при надмірній вазі,
- Вживання молочних продуктів у зв'язку зі зміною ваги та ризиком надмірної ваги або ожиріння