Енергетика та метаболізм МЗС
* Цей МЗС був деприоритизований до тих пір, поки не з’являться необхідні переконливі людські дані, описані тут.
РЕЗЮМЕ
У дослідженнях HD було кілька давніх гіпотез, які пропонують причинно-наслідковий зв'язок між нерегульованою енергетикою та метаболізмом у патогенезі HD. На сьогодні докази були суперечливими та неповними. Першочерговим завданням CHDI у МЗС з питань енергетики та метаболізму є проведення досліджень, щоб визначити, чи порушені ці процеси в HDGEC та, якщо так, чи пов’язане це порушення з прогресуванням захворювання. Якщо цього основного причинно-наслідкового зв’язку неможливо експериментально показати, CHDI знецінить діяльність та зведе до мінімуму ресурси для цієї галузі досліджень. Ми проводимо невелику кількість цілеспрямованих досліджень, спрямованих на виявлення змін в енергетиці та метаболізмі в HDGEC та відповідних моделях HD тварин. Якщо буде виявлено підпис HD для енергетичної дисфункції, ми проведемо подальші дослідження, що вивчають терапевтичні шляхи в цій галузі.
ДОСЛІДЖЕННЕ БАЧЕННЯ
Велика кількість літератури припускає, що енергетика та мітохондріальний метаболізм порушуються при HD. Різке зниження ваги, яке неможливо пояснити хореїчними рухами або недостатнім харчуванням, вже давно було визнано у деяких симптоматичних хворих на ГД, що передбачає роз'єднання мітохондрій або іншу енергетичну проблему. Ядерно-магнітно-резонансна спектроскопія протонів виявила підвищений рівень лактату в мозку пацієнтів із симптоматикою ВГ, що свідчить про дефіцит окисного фосфорилювання. Також повідомляється про повторне зниження вмісту фосфокреатину/креатину, АТФ/фосфокреатину та АТФ/АДФ у периферичних тканинах. Крім того, докази помітного збільшення окисного стресу та пошкоджених продуктів були описані у явних пацієнтів із ЗН та моделей тварин.
Однак велика частина роботи була непослідовною, важко відтворюваною або проводилась на HD-моделях тварин з невідомою прогнозною цінністю. Дані про людину в основному збирали з використанням периферичних тканин або тканин після смертних випадків, при цьому мало даних із мозку живої людини. Крім того, два найбільших інтервенційних клінічних випробування при HD - які оцінювали терапевтичну користь двох харчових добавок, коензиму Q10 і креатину, з передбачуваними механізмами дії, пов'язаних з енергетикою, - не відповідали своїм кінцевим показникам ефективності та не давали додаткових уявлень про валідність енергетичної механістичної гіпотези.
Класичні мітохондріопатії, такі як синдром Лі або MELAS, зазвичай включають різке або повне порушення одного або декількох важливих енергетичних компонентів, а отже, мають дуже виражені та ранні фенотипи. Хоча HD поділяє деякі особливості з цими розладами, такі як диференційна вразливість базальних гангліїв, ефекти, що спостерігаються у HDGEC, є набагато більш тонкими і виникають протягом набагато більш тривалого періоду часу. Неясно, як мутантний мисливський вплив чинить на ці системи безпосередньо (наприклад, через взаємодію з мітохондріальними компонентами) або опосередковано (наприклад, посилюючи потребу у підвищеному рівні виробництва енергії). Тому головним пріоритетом ІХСН буде виявлення та характеристика точних молекулярних механізмів, відповідальних за будь-яку енергетичну дисфункцію в HD.
В якості основи для нашої стратегії CHDI запропонував три перевіряються постулати про роль енергетики в HD. По-перше, наявність білка mHTT у клітинах призводить до підвищеної енергетичної потреби через поки що невідомий механізм. По-друге, клітини на ранніх стадіях перебігу захворювання здатні впоратися з цим підвищеним попитом, збільшуючи випуск мітохондрій, але з часом цей стійкий рівень енергетичного стресу призводить до хронічного впливу активних форм кисню (АФК). По-третє, поєднання АФК та підвищений енергетичний попит врешті-решт компрометує мітохондріальну фізіологію, окисно-відновлювальні системи захисту та призводить до недостатнього рівня енергетичного виходу. Якщо правильно, ця траєкторія може пояснити, чому деякі основні клінічні ознаки HD часто з’являються пізніше в житті. І оскільки нейрони мають вищі енергетичні потреби, ніж інші типи клітин, наслідки такої дисрегуляції будуть особливо очевидними у нейронів.
CHDI співпрацює з колегами з ключових досліджень, щоб перевірити ці постулати, досліджуючи три біологічні механізми, які могли б зіграти певну роль у всіх з них - токсичність, опосередкована підвищеним рівнем АФК, енергетичний гомеостаз всередині клітини та фізіологія мітохондрій. Ми намагатимемось застосовувати методи та технології, які дозволять уникнути експериментальних плутанин, які занадто часто заважають цій галузі, та оптимізувати чутливість добре перевірених аналізів для виявлення іноді граничних сигналів. Ми будемо продовжувати використовувати генетичні, фармакологічні та клінічні інструменти, щоб краще зрозуміти точну природу передбачуваної енергетичної дисфункції при HD.
Незважаючи на те, що багато аспектів енергетики добре зберігаються у різних видів, залишається незрозумілим, наскільки корисними будуть нинішні доклінічні генетичні моделі HD для з'ясування природи передбачуваної енергетичної дисфункції, керованої мисливським спорудою, або прогнозування ефективності втручань. Тому, коли це можливо, ми зосередимо наші експериментальні дослідження на людях.
Ми маємо намір успішно завершити нашу експериментальну схему та сформувати достатньо переконливий корпус доказів, щоб розширити наш підхід до більш масштабного, раціонального та заснованого на механізмах МЗС в галузі ІХС. Це вимагатиме чіткого, специфічного центрального сигналу на початку захворювання, що вказує на те, що енергетична дисфункція відіграє фундаментальну роль у патофізіології високої чіткості.
Наша мета полягає у створенні детальних доказів, які визначають раціональні терапевтичні підходи до ЛГ в області енергетичної дисфункції. Потім ми змоделюємо дисфункцію гризунів високої чіткості, втрутимося генетично чи фармакологічно, щоб виправити аберрантні фенотипи, а потім приступимо до клінічного розвитку. Врешті-решт, однак, ми все ще не знатимемо, чи є енергетичний дефіцит причиною високої чіткості, поки у нас не буде терапевтичного препарату, який працює так, як це призначено для людей, і ми не побачимо, як перебіг їхньої хвороби був успішно змінений.
ДЕТАЛІ ПРОГРАМИ ДОСЛІДЖЕННЯ
Енергетичний гомеостаз
Найбільш помітними метаболічними змінами в досимптомних та симптоматичних HDGEC є втрата ваги, специфічні для регіону зміни вживання глюкози в крові та рівня лактату, а також аномальна активність мітохондріальних ферментів, що беруть участь в метаболізмі глюкози. Доклінічні дослідження на моделях HD-мишей також вказують на порушену метаболічну регуляцію. Однак менш зрозумілим є саме те, як таке порушення може вплинути на нейрони у осіб з HD.
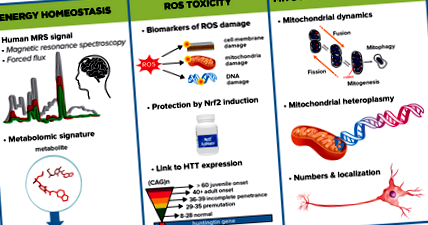
Графічний конспект, що зображує деякі ключові підрайони, які МЗС з питань енергетики та метаболізму досліджуватиме для визначення енергетичних порушень у HD та підходи до вивчення відповідальних механізмів.
Незважаючи на те, що довгий час вважалося, що мітохондрії не відіграють ролі в нейрональній передачі сигналів, тепер відомо, що центральною функцією окислення мітохондрій у нейронах є постачання енергії для передачі нейронів. Отже, порушення енергетичного обміну мітохондрій може безпосередньо впливати на передачу нейронів.
Нещодавня робота, підтримана CHDI, використовувала MRS для вимірювання швидкості метаболізму in vivo у нейронах та глії на двох моделях мишей HD. Ця техніка включає маркування глюкози вуглецем-13 і наступне мічення через цикл трикарбонової кислоти для відстеження енергетичного обміну мітохондрій у вибраному вокселі сканування мозку. 13 C MRS є особливо привабливим, оскільки він повністю перекладається між мишами та людьми.
У дослідженнях на мишах MRS як моделі R6/2, так і Q175 HD продемонстрували значне зниження енергетичного обміну нейронів у смугастому тілі, а також в корі та таламусі до появи поведінкових фенотипів; ці зменшення стали вираженими у міру прогресування фенотипу захворювання. Такого зниження метаболізму гліальних клітин не спостерігалося. Ці результати дозволяють припустити, що енергетична дисфункція мозку дуже чутлива до присутності мутантного мисливського споруди ще до того, як з’являються явні фенотипи, і, оскільки ця дисфункція не спостерігається в глії, це пов’язано з втратою функції нейронів.
Примусовий потік MRS - це пов’язана техніка, яка проводиться після першого збільшення енергетичних потреб у мозку, щоб визначити, чи підсилюється метаболічна активність мітохондрій належним чином під цим стресом. CHDI планує використовувати примусовий потік MRS у мозку живого людського HD для вимірювання різноманітних енергетичних метаболітів. Ми оцінимо кореляцію між спостережуваними відмінностями від стадії захворювання, тяжкості захворювання, тривалості повторення CAG та регіональної (наприклад, стриатум проти кори) або специфіки клітинного типу (наприклад, MSN проти глії) у мозку.
Це дослідження дозволить нам визначити, чи важлива мітохондріальна енергетика в HD, і зрозуміти, які конкретні елементи механізму порушені, такі як гліколіз, електронотранспортні комплекси, порушений цикл глутамат/глутамін та ін. Міцні зміни, що спостерігаються в рамках цієї парадигми, дали б основу в біології людини для моделювання цього аспекту захворювання. Найголовніше, якщо буде виявлено дефіцит, ми вивчимо терапевтичні можливості та виявимо потенційні біомаркери хвороби. Наприклад, подальші дослідження дозволять дослідити, чи нормалізують стратегії зниження HTT енергетичну дисфункцію. З іншого боку, неможливість виявити мітохондріальні енергетичні відмінності в мозку HD із використанням цієї техніки означало б марність і, як наслідок, усунення цього МФА з портфеля CHDI.
Однак, ймовірно, результати цього людського експерименту буде не так легко інтерпретувати; розглядаючи, наскільки поширеними є енергетичні аномалії при нейродегенеративних захворюваннях, ми, швидше за все, виявимо деякі відмінності в енергетиці високої чіткості, незалежно від того, чи є вони причинними, компенсаторними чи просто епіфеноменами. Можливо, більш реалістичним прагненням до цього дослідження є виявлення HD-сигнатури метаболітів, які збільшуються або зменшуються.
Токсичність АФК
Окислювальний стрес - дисбаланс між виробництвом АФК та антиоксидантною захисною системою - був пов’язаний із патогенезом HD як у людей, так і на моделях тварин. Незалежно від цього, дві групи повідомили про збільшення маркерів продуктів пошкодження окислювального стресу в плазмі та крові пацієнтів з явно вираженим ГР. Відповідно, було виявлено зменшення антиоксидантних систем, і ці зміни корелювали із прогресуванням захворювання. Однак доказів того, що зменшення АФК може сповільнити прогресування захворювання, все ще бракує, і головним чином виключається відсутністю чутливих та конкретних кількісних методів для відстеження різних типів пошкодження АФК. Крім того, ряд вимірюючих факторів, таких як куріння, вік, стать, дієта та процедури збору проб, суттєво впливають на вимірювання АФК.
CHDI розробляє та підтверджує чутливі методи на основі мас-спектрометрії для вимірювання молекулярних продуктів шкідливих ефектів, спричинених АФК, на білки, ліпіди та ДНК. Використовуючи ці аналізи побічних продуктів АФК, CHDI та його колеги досліджуватимуть збільшення пошкодження АФК у HDGEC та на моделях HD на тваринах. Потім ця кількісна панель маркерів окисного стресу in vivo може корелюватися з нейродегенерацією та прогресуванням фенотипу як на моделях тварин, так і на HDGEC. Після встановлення та підтвердження ці аналізи побічних продуктів АФК будуть широко доступні для співтовариства з питань HD для оцінки окисного стресу.
На сьогоднішній день антиоксидантна терапія, випробувана в клінічних випробуваннях, не показала терапевтичної переваги при будь-якому захворюванні, і навряд чи якогось одного антиоксиданту буде достатньо, щоб послабити вплив АФК при HD. Якщо ці запропоновані маркерологічні дослідження АФК виявлять збільшення продуктів пошкодження АФК у осіб із ГД, найбільш перспективним терапевтичним шляхом, швидше за все, буде скоординоване підвищення ендогенного антиоксидантного захисту. CHDI планує дослідити дві можливі терапевтичні мішені за цим напрямком: NRF2, ген, який індукує вроджену антиоксидантну реакцію на окислювальний стрес, і ATM-кіназу, яка бере участь у реакції на пошкодження ДНК і демонструє підвищену активність при HD.
Ми розробляємо активатори NRF2, що проникають у мозок, та інгібітори ATM та оцінюватимемо їх вплив на маркерну панель окисного стресу, примусовий MRS, поведінку та інші результати. Ще одним напрямком дослідження є те, чи можуть інші фармакологічні втручання, такі як ті, що знижують мутантний або загальний рівень HTT, зменшити пошкодження АФК, виміряні маркером окисного стресу.
Ми також працюємо з співавторами над розробкою фармакодинамічних маркерів для активації NRF2, використовуючи мишей-репортерів як необхідну умову для оцінки терапевтичного потенціалу. Використовуючи як трансгенні миші NRF2, так і вірусну доставку NRF2, ці співавтори вирішують, чи може надмірна експресія NRF2 у нейронах або гліях покращити фенотип.
Мітохондріальна фізіологія
Динаміка мітохондрій - такі процеси, як злиття та розподіл мітохондрій, торгівля людьми, біогенез та мітофагія - мають вирішальне значення для функції органели та гомеостазу. Повідомлялося про фрагментацію мітохондрій та посилення апоптозу у присутності мутантного мисливського сполуки в нейронах як на клітинних, так і на тваринних моделях HD, що забезпечує докази патологічного зв'язку між мутантним мисливським сполуками та аномальною динамікою мітохондрій. Кумулятивні мутації мітохондріальної ДНК також можуть брати участь у патології захворювання.
CHDI співпрацює з колегами з метою подальшої характеристики мітохондріальної динаміки та метаболічних ознак у тканині мозку HD та різних периферійних тканинах HDGEC в рамках проекту EHDN Multi-Tissue Monitoring (MTM). Ми також працюємо з іншими співробітниками, щоб вивчити роль злиття і поділу мітохондрій у HD. У клітинних моделях зменшення ділення мітохондрій покращує життєздатність клітин, припускаючи, що молекули, що сприяють цьому процесу, можуть мати терапевтичний потенціал. Ми тестуємо цю ідею in vivo за допомогою моделі миші, в якій Mff, рецептор білка, центрального для ділення мітохондрій, був інактивований. Ці миші мають велику кардіоміопатію та дисфункцію мітохондрій, які можна врятувати одночасним видаленням білка, який відіграє центральну роль у злитті мітохондрій. Ці висновки вказують на те, що баланс між двома процесами є важливим як для фізіології мітохондрій, так і для підтримки функції тканин і органів. Наступним кроком проекту є дослідження ролі Mff у моделі миші HD.
Інший проект досліджує, чи можуть і як мутації та варіація числа копій у ДНК мітохондрій бути залученими до віку початку HD, прогресування захворювання, тяжкості або інших патологічних особливостей шляхом секвенування мітохондріальної ДНК з HDGEC та порівняння їх із показниками учасників 1000 Геномів Проект. Ранні результати свідчать про те, що клітинні лінії, отримані з HDGEC, мають значне збільшення гетероплазмій - комбінацій мутованих і немутованих мітохондріальних ДНК в межах однієї клітини.
- Чи справді Fruta Planta посилює метаболізм та допомагає стримати апетит
- Чи сповільнює нездорова їжа ваш метаболізм
- Куріння марихуани збільшує ваш метаболізм!
- Краудфандінг на Fresh Prime Keto Відгуки АФЕРА ТА ЛЕГІТ Підвищують рівень вашого метаболізму! КУПІТЬ ЗАРАЗ на
- Метаболізм сиру, як вживання сиру може допомогти вам схуднути - Food24