Артеріальний ендотелій створює дозвільну нішу для розширення гемопоетичних стовбурових і клітин-попередників пуповинної крові
Анотація
Передумови
Незважаючи на те, що пуповинна кров (CB) пропонує обіцянку для лікування пацієнтів із гемологічними злоякісними новоутвореннями та імунними розладами високого ризику, обмежена кількість гемопоетичних стовбурових клітин (HSC)/клітин-попередників в одиниці CB та важкі обставини при розширенні ex vivo роблять це досить складним завданням розробити успішну клітинну терапію.
Методи
У цьому дослідженні було розроблено нову стратегію підтримки ex vivo розширення гемопоетичних стовбурових і клітин-попередників (HSPC) шляхом кокультури з інженерними ендотеліальними клітинами артерії пуповини людини (HuAECs-E4orf1-GFP), що виражає E4ORF1 стабільно за допомогою ретровірусної системи.
Результати
Кокультура клітин CD34 + hCB з HuAECs-E4orf1-GFP призвела до генерування значно більшої кількості загальних ядерних клітин CD34 + CD38 - та CD34 + CD38 - CD90 + HSPC порівняно з цитокінами окремо або в культурі з пуповинною веною людини ендотеліальні клітини (HuVEC) після 14-денної ампліфікації. Потенціал багатолінійної диференціації in vitro та здатність до повторного заселення in vivo розширених гемопоетичних клітин, культивованих HuAECs-E4orf1-GFP, також були помітно посилені порівняно з іншими двома контрольними групами. DLL4, головний детермінант ідентичності артеріальних ендотеліальних клітин (ЕК), асоціювався з клітинами CD34 + hCB, ампліфікованими на HuAECs-E4orf1-GFP.
Висновки
У сукупності ми продемонстрували, що HuAEC діяли як дозвільна ніша у сприянні розширенню HSPC. Наше дослідження також показало, що вирішальні фактори та пов'язані шляхи, представлені в HuAEC, можуть дати підказку щодо збереження самовідновлення добросовісних HSC.
Вступ
Гемопоетичні стовбурові клітини (HSC), що перебувають на вершині складної клітинної ієрархії крові, можуть поповнюватися шляхом самообновлення та давати початок усім іншим клітинам крові [1]. В даний час генерування HSC з плюрипотентних стовбурових клітин (PSC), включаючи індуковані плюрипотентні стовбурові клітини (iPSC) та ембріональні стовбурові клітини (ESC), ймовірно, недосяжне [2,3,4]. А кістковий мозок (КМ), пуповинна кров (МКБ) або мобілізована периферична кров (МПБ) є єдиним джерелом ГСК, доступних на даний момент [5,6,7]. Отже, встановлення системи ex vivo розширення HSC відкрило б унікальну можливість для вивчення самовідновлення HSC людини та забезпечило нове джерело терапевтичних клітин для розладів крові. Досягнення цієї мети вимагає детального розуміння найважливіших елементів, що сприяють посиленню та підтримці функцій HSC в гемопоетичній ніші in vivo.
Первинні АЕС мають обмежену здатність до розширення та зазнають дедиференціації в культурі [17, 18], що робить фізіологічне застосування складним для ніші гемопоезу. З цього приводу тут ми розробили стабільні лінії HuAEC, що володіють загальноприйнятими характеристиками АЕС шляхом трансдукції E4ORF1 та зелений флуоресцентний білок (GFP) з використанням ретровірусних векторів (HuAECs-E4orf1-GFP). Вони засновані на теорії E4orf1 як сигналу «за життя», що сприяє виживанню первинних ендотеліальних клітин (ПЕК) [19, 20]. Потім ми виявили, що HuAECs-E4orf1-GFP мають потенціал для створення дозвільної ніші для експансії клітин hCB CD34 +, як визначено загальновизначеним набором маркерів для гемопоетичних стовбурових та попередніх клітин людини (HSPC), аналізів колоній та in vivo потужність повторного заселення у мишей NOD.Cg-Prkdc scid Il2rg tm1Wjl/SzJ (NSG). Крім того, ми виявили, що сигнальні молекули Notch сприяють підтримуючому ефекту HuAECs-E4orf1-GFP. Наші дані вперше показують функціональний зв’язок між HuAEC та ампліфікацією HSC та вказують на потенційну роль артеріальної судинної ніші для декодування інформації in vivo для самовідновлення та розширення людських HSC.
Матеріали і методи
Виділення та посів артеріальних/венозних клітин пуповини
Підготовка та трансфекція вірусів
HuAECs-E4orf1-GFP та сконструйовані ендотеліальні клітини пуповинної вени людини [20] (HuVECs-E4orf1-GFP) були створені шляхом введення ретровірусного вектора у первинні HuAECs та HuVECs. Ретровірус генерувався шляхом трансфекції MSCV-N E4ORF1 (Адджен, Шанхай, Китай; види, аденовірус людини 5; розмір, 384 п.н. плюс 8162 п.н.; тип вектора, експресія ссавців, ретровірус; селективні маркери, пуроміцин) та pMX-GFP (надано доктором Хіроюкі Хіраї, США) у клітинах Plat A з використанням ліпофектаміну 2000 (Invitrogen, Карлсбад, Каліфорнія, США). Ретровірусні конструкції збирали через 44 та 68 год після трансфекції. E4ORF1-трансфіковані ЕК відбирали з 0,5 мкг/мл пуроміцину (InvivoGen, Шанхай, Китай). DLL4 shRNA та контрольна shRNA (обидві несуть мітку GFP) були розроблені Genechem (Шанхай, Китай) та трансфіковані індивідуально у первинні HuAEC. Трансфіковані клітини GFP + збагачували за допомогою флуоресцентно-активованого сортування клітин (FACS) потокового цитометра Verse (BD Biosciences, Franklin, NJ, USA). Експерименти з трансфекцією вірусу проводили на ДВК від трьох різних донорів.
Проточна цитометрія (FCM)
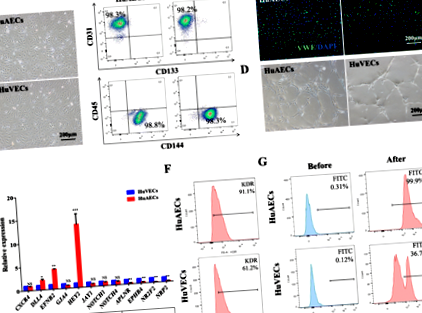
Проточний цитометричний аналіз проводили з використанням таких антитіл: CD144-PE, CD45-APC, CD133-PE, CD31-APC та CD309-PE для первинних HuAEC та HuVEC; FVS510, CD34-PE, CD38-APC та CD90-PE-cy7 для культивованих аналізів ex vivo; та CD45-APC проти людини, CD19-APC, CD11b-PerCP-CY5.5 та CD45.1-FITC проти миші для експериментів з трансплантації in vivo. Клітини фарбували при 4 ° С протягом 40 хв, захищаючи від світла. Відфільтровані (70 мкм) зразки аналізували на проточному цитометрі FACSVerse. Всі антитіла походять від BD Biosciences (Франклін, Нью-Джерсі, США) або eBioscience (Сан-Дієго, Каліфорнія, США).
Імунофлюоресценція
Первинні HuAEC та HuVECs фарбували для підтвердження ідентичності клітин. Культури фіксували у 4% параформальдегіді (Sigma-Aldrich, Шанхай, Китай), просочували та блокували, а потім інкубували протягом ночі в блокуючому розчині, що містить первинне антитіло проти фактора фон Віллебранда (vWF; 1: 500; Sino Biological, Пекін, Китай) . Кон'югований FITC козячий IgG (1: 200; Beijing Zhongshan Jinqiao Biological Technology, Пекін, Китай) використовувався як вторинне антитіло, а DAPI (1 мг/мл; Рош, Базель, Швейцарія) як протиядерний засіб. Візуалізацію проводили з використанням конфокальної мікроскопії (PerkinElmer, Waltham, MA, USA) та Volocity Software (PerkinElmer, Waltham, MA, USA).
Аналіз формування труб
Виходячи з раніше описаних [23], первинні HuAECs та HuVECs, суспендовані в середовищі EGM-2 з добавкою VEGF (100 нг/мл; R&D Systems, Aimolivel, Каліфорнія, Каліфорнія, США), були засіяні в 6-лункові пластини, покриті Matrigel ( BD Biosciences, Franklin, NJ, USA) при щільності 10000 клітин/см 2. Через 24 години інкубації клітини фотографували за допомогою конфокальної мікроскопії та програмного забезпечення Volocity.
Кількісний аналіз ланцюгової реакції полімерази в реальному часі (qRT-PCR)
Загальну РНК екстрагували з клітин за допомогою RNeasy Micro Kit (QIAGEN, Нью-Йорк, Нью-Йорк, США) та зворотну транскрипцію, використовуючи ReverTra Ace qPCR RT Master Mix (TOYOBO, Шанхай, Китай) відповідно до технічних вимог виробника. Продукти ПЛР були виявлені за допомогою суміші THUNDERBIRD SYBR qPCR (TOYOBO, Шанхай, Китай). Послідовності праймерів, що використовуються в аналізах qRT-PCR, наведені в таблиці 1.
Аналіз виробництва оксиду азоту
Виходячи з попереднього опису [24], первинні HuAEC та HuVEC були засіяні в 24-лункові планшети, покриті втротроктином (100 000 клітин/лунка). Через 2 дні культивоване середовище замінили на свіжий EGM-2, що містить DAF-FM (1 мкМ; Life Technologies, Карлсбад, Каліфорнія, США). Клітини культивували протягом 30 хв при 37 ° С, а потім збирали для проточного цитометричного аналізу.
Кокультура ex vivo
Зразок ЦБ людини був зібраний Пекінською лікарнею з інтегративної реабілітації в Китаї та Західній медицині (ZXYEC-KT-2017-04-P01). Після центрифугування з градієнтом щільності та імуномагнітного відбору (Miltenyi Biotec, Вестфалія, Гладбах, Німеччина) загалом 50 000 клітин CD34 + культивували в StemSpan (STEMCELL Technologies, Шанхай, Китай), що містять 50 нг/мл rhSCF, rhTPO та rhFlt- 3 л (PeproTech, Роккі Хілл, Нью-Джерсі, США), з HuAEC-E4orf1-GFP та HuVECs-E4orf1-GFP або без живильних клітин (лише цитокіни). Крім того, ми також провели експеримент блокування сигналізації Notch у клітинах hCB, сокультурованих HuAECs-E4orf1-GFP, додавши сполуку E (200 нМ; CpE; MERCK, Дармштадт, Німеччина), яка є інгібітором сигналу Notch. CpE додавали через день і в якості контролю додавали еквівалентну дозу ДМСО. Для того, щоб дослідити ефект DLL4 у системі кокультури клітини CD34 + hCB були культивовані HuAECs-E4orf1-shDLL4 та його контрольною групою (HuAECs-E4orf1 несуть невпізнану послідовність та GFP). Через 14 днів розширені клітини hCB збирали для аналізів.
Аналіз колонієутворюючої одиниці (КУО)
Для колонієутворюючих аналізів 250 ампліфікованих клітин hCB висівали в 24-лункові планшети, що містять MethoCult H4434 (STEMCELL Technologies, Шанхай, Китай). Кожна група виконувалась у трьох примірниках. Колонії, включаючи КУО-еритроцити (КОЕ-Е), лопатоутворюючі одиниці-еритроїди (БФУ-Е), КУО-гранулоцити (КОЕ-G), КУО-гранулоцити, макрофаги (КОЕ-ГМ) та КУО-мегакаріоцити (КОЕ -M) з'явилися з 7-го дня і були зараховані 12-го дня.
Фарбування по Гемза
Клітини, що утворюють колонії (ХФУ), оцінювали за допомогою набору для фарбування Giemsa (Басо, Чжухай, Китай), згідно з протоколами виробника. Еквіволюметричні клітини збирали та розподіляли на предметні стекла. Потім додавали розчин А і давали діяти протягом 1 хв при кімнатній температурі. Після цього додавали розчин В та інкубували протягом 10 хв. Промиті та висушені на повітрі зразки перед записом.
Трансплантація in vivo
Усі експерименти на мишах були схвалені Інституційним комітетом з догляду та використання тварин (IACUC) при Інституті охорони здоров'я та трансфузійної медицини (довідковий номер: IACUC AMMS-13-2016-016). Коротко кажучи, 6-тижневих мишей NSG опромінювали сублітально всього тіла (2,5 Гр) і вводили 1 000 000 розширених клітин hCB з кожної групи через хвостову вену внутрішньовенно. Через 16 тижнів збирали клітини/стегнові кістки/гомілки/селезінки периферичної крові (PB) та оцінювали відсоток клітин CD45 + людини.
Статистичний аналіз
Результати виражаються як середнє значення ± стандартне відхилення. P значення менше 0,05 (двосторонній Student т тест) вважався статистично значущим. "N" означає біологічні повторення, і всі ці повтори були незалежними.
Результати
Молекулярно-функціональна характеристика HuAEC
Створення та ідентифікація годівниць HuAEC-E4orf1-GFP
Кокультура HuAEC-E4orf1-GFP посилила розширення екс-vivo CB HSPC, одночасно підвищивши потенціал багаторядкової диференціації HSPC in vitro
Щоб перевірити вплив HuAECs-E4orf1-GFP на ex vivo розширення HSPC, клітини CD34 + hCB кумулятивно розширювались HuAECs-E4orf1-GFP, HuVECs-E4orf1-GFP або без живильників в умовах без сироватки та мінімальних цитокінів які включали rhSCF, rhTPO та rhFlt3 як фактори росту. Усі живильні клітини, що використовувались для кокультурної системи, знаходились у межах 6–10 проходів. Як результат, клітини CD34 + hCB, культивовані з HuAECs-E4orf1-GFP, призвели до значного збільшення загальної кількості ядерних клітин (TNC) та CD34 + клітин, ніж культура цитокінів або культивація HuVECs-E4orf1-GFP (рис. 3a – c). Більше того, кількість CD34 + CD38 - клітин та більш примітивних CD34 + CD38 - CD90 + клітин у розширених клітинах, культивуваних HuAECs-E4orf1-GFP, зросла за 2 тижні до 527,2 ± 96,3 та 2603,4 ± 283,2-кратного, що становило 6,6 ± 2,5 У 3,3 ± 0,8 рази лише групи цитокінів, в 1,9 ± 0,5 та 1,8 ± 0,3 рази у групи HuVECs-E4orf1-GFP (рис. 3d, е). Для оцінки можливості in vitro багатолінійної диференціації в розширених клітинах CD34 + hCB проводили аналіз CFU. Порівняно з іншими двома групами, кокультура HuAECs-E4orf1-GFP значно збільшила кількість КУО, демонструючи, що колонієутворюючий потенціал HSPC був підвищений in vitro в цьому стані (рис. 3f, g).
Розширені клітини підтримували активність повторного заселення у мишей NSG in vivo
Роль сигнального шляху Notch у розширенні HSPC
Обговорення
Незважаючи на десятиліття зусиль щодо вивчення стратегії розширення HSC ex vivo, визначення набору цитокінів, які можуть розширити довгострокові прищеплювані HSC людини, виявилося складним на даний момент [33]. Суть цієї проблеми може полягати в нашому остаточному нерозумінні маніпуляцій HSC за допомогою ніші in vivo. Тут ми припустили, що HuAEC можуть діяти як судинна ніша для розширення HSPC ex vivo, забезпечуючи прогемопоетичні сигнали. Для перевірки цієї гіпотези ми встановили артеріальні ендотеліальні живильники для пуповини людини, ввівши аденовірусний E4ORF1 і GFP ген з використанням ретровірусного вектора. Ми взяли на себе ініціативу, припустивши, що HuAECs-E4orf1-GFP забезпечує відповідне клітинне середовище для ефективного розширення CD34 + hCB клітин з мультипотентністю in vitro та здатністю до приживлення in vivo.
У цьому дослідженні ізольовані HuAEC, витримані в наших культурах, виявляли профіль експресії поверхні AEC. Незважаючи на загальновідому роль Росії E4ORF1 на підтримку довготривалого виживання первинних ендотеліальних клітин за відсутності сироваткових та ангіогенних факторів [34], це перший звіт, що E4ORF1 бере безпосередню участь у підтримці артеріальної ідентичності in vitro. Ці дослідження обгрунтовують збереження артеріальних генів та передачу сигналів, залучаючи ліганди DLL4 [35], рецептори NOTCH1/4 [36] та фактори транскрипції (TF) HEY1/2 [25, 37] як основну детермінанту ідентичності AEC.
Вимога до складних сигнальних мереж ex vivo розширення HSC стимулювала розвиток стільникових платформ. Згідно з нашими сучасними знаннями, мезенхімальні стромальні клітини (МСК) [38], остеобласти [39] та інші стромальні клітини, включаючи синусоїдні клітини та ендотеліальні клітини [40, 41], відповідають за підтримку кровотворення та контроль кількості HSC. Отже, мезенхімальні клітини-попередники [42, 43] та ендотеліальні клітини [44, 45] широко використовуються як сурогати для мезенхімальної ніші та ендотеліальної ніші до розширення HSPC. Раніше ми всебічно охарактеризували синусоїдальні ендотеліальні клітини печінки з печінки плода людини (hFLSEC) і виявили, що вони забезпечують ефективне розширення клітин CD34 + hCB з мультипотентністю in vitro та здатністю до приживлення у мишей NSG [46]. Як ми всі знаємо, фетальна печінка служить переважним місцем для розширення функціональних HSC під час ембріогенезу [47], що набагато більше розуміє важливу роль hFLSEC у розширенні клітин CD34 + hCB. У цьому дослідженні ми порівняли здатність hFLSEC та HuAEC для сприяння розширенню клітин CD34 + hCB. Обнадійливо, HuAECs має переваги перед hFLSEC у активізації зростання та здатності до утворення КУО (Додаткова Рис. 2).
Кокультура HSC з стромальними клітинами та факторами росту була використана для спроби ex vivo рекапітулювати взаємодії в мікросередовищі кровотворення для розширення HSPC. Наприклад, опосередковане розширення мезенхімальних стромальних клітин (MSC) є одним із сучасних підходів до маніпуляцій ex vivo із стовбуровими клітинами CB у клінічних випробуваннях. Тут ми розробили нову платформу розширення CB для людини, і наше дослідження ще більше підтвердило потенційну роль методологій розширення HSPC на основі клітин. У нашому звіті первинні HuAEC та HuVEC від одного і того ж донора були поєднані для незалежних експериментів, тоді як зразки пуповини, які використовувались для ізоляції PEC, були від кількох донорів. Різні джерела, що містяться в цьому документі, вказують на те, що ця кокультурна система має універсальне застосування. У майбутньому вливання готових до розширення HPSC, отриманих від CB, опосередкованих HuAEC, ex vivo, може бути розроблено нову стратегію боротьби з нестачею HSPC. З іншого боку, ця платформа може також дозволяти ідентифікувати нові фактори росту або цілеспрямовані молекули, сприяючи визначенню набору цитокінів для застосування при розширенні HSC.
Висновок
Підводячи підсумок, ми виявили, що HuAEC виступали як потенційна стільникова платформа для ефективної підтримки розширення прищеплюваних HSC HSC. Незважаючи на добре відому роль ендотелію в початковому генеруванні HSC [55], збільшення HSC [56] та специфічну диференціацію гемопоетичної лінії [52], це перший випадок, коли артеріальні ендотеліальні клітини беруть безпосередню участь у ex vivo розширення людських HSC. Зрештою, краще розуміння клітинних та сигнальних компонентів у цій області сприятиме розширенню HSC для терапевтичних цілей.
- Процедура очищення крові, яка витягує хворобу з організму за допомогою магнітів, готових до випробувань на людях
- Кров; прибирання; лікування, яке витягує хворобу з тіла за допомогою магнітів, готових до випробувань на людях
- Манжети для артеріального тиску проти артеріальних ліній для пацієнтів з гіпотонією - PulmCCM
- Гранатовий сік, багатий антиоксидантами, може допомогти контролювати рівень цукру в крові для діабетиків Дані про людей
- Мозкові мозкові оболонки Факти, кров; Постачання нервів, крововиливи