Екстракт етанолу Syzygium aromaticum зменшує ожиріння, спричинене дієтами, у мишей за рахунок зниження регуляції експресії адипогенного та ліпогенного генів
CHANG HWA JUNG
1 Відділ досліджень метаболізму та функціональності, Корейський інститут досліджень продуктів харчування, Соннам 463-746;
ДЖІЮН АНН
1 Відділ досліджень метаболізму та функціональності, Корейський інститут досліджень продуктів харчування, Соннам 463-746;
TAE-IL JEON
1 Відділ досліджень метаболізму та функціональності, Корейський інститут досліджень продуктів харчування, Соннам 463-746;
ТАЕ ВАН КІМ
2 Департамент харчової науки та біотехнологій, Національний університет Андонг, Кьонгбук 760-749, Республіка Корея
TAE YOUL HA
1 Відділ досліджень метаболізму та функціональних можливостей, Корейський інститут харчових досліджень, Соннам 463-746;
Анотація
Вступ
Надмірна вага та ожиріння стали серйозними глобальними проблемами в останні роки, і недавній звіт підрахував, що 1,5 мільярда дорослих людей у всьому світі страждають від надмірної ваги, серед яких понад 200 мільйонів чоловіків та майже 300 мільйонів жінок страждають ожирінням (1). Колись надмірна вага та ожиріння вважалися проблемами, пов’язаними з країнами з високим рівнем доходу, але нині їх захворюваність зростає в країнах з низьким та середнім рівнем доходу, що є тенденцією, яка пов’язана з хронічним алкоголізмом, надмірним споживанням їжі та малорухливим способом життя. Люди з надмірною вагою та ожирінням стикаються з ризиком розвитку численних хронічних захворювань, включаючи хвороби серця, цукровий діабет та деякі типи раку, а також психологічні та соціальні проблеми.
Надмірна вага та ожиріння, а також неінфекційні хвороби, пов'язані з їх розвитком, в основному можна запобігти. Для запобігання та лікування надмірної ваги та ожиріння можна зробити декілька кроків не лише на індивідуальному та суспільному рівнях, а й на молекулярному. На індивідуальному рівні люди можуть обмежити споживання жиру та цукру, збільшити споживання фруктів та овочів та регулярно займатися фізичними навантаженнями. На соціальному рівні уряди та харчова промисловість можуть сприяти здоровому харчуванню. На молекулярному рівні дослідники ідентифікують та/або розробляють засоби, що попереджають або лікують ожиріння. Нещодавно в центрі досліджень була розробка засобів проти ожиріння, отриманих з натуральних продуктів, процес, який має низку безпечних та економічних переваг перед розробкою фармацевтичних препаратів завдяки багаторічному інвестуванню у розробку ліків. Такі дослідження були підкріплені нещодавніми повідомленнями про те, що традиційні рослинні екстракти були визнані ефективними для зменшення маси тіла in vivo (2,3).
Серед цих екстрактів висушені ароматичні квіткові бруньки Syzygium aromaticum (L.) Merr. & Perry (сімейство Myrtaceae), широко відомі як гвоздика, повідомляють, що вони корисні для лікування зубного болю, головного болю та розладів дихання в азіатських країнах (4). Фітохімічні дослідження показують, що евгенол, який входить до класу фенілпропаноїдів хімічних сполук, та його похідні відповідають за унікальний аромат S. aromaticum, і було встановлено, що він має антимікробну, інсектицидну, антиоксидантну, протипухлинну, протизапальну та анестезуючу властивості (5–10). Незважаючи на ці висновки та повідомлення про його корисність у кількох лікарських програмах, S. aromaticum не досліджували щодо його потенціалу як агента проти ожиріння або харчової добавки. Отже, у цьому дослідженні досліджено вплив етанолового екстракту S. aromaticum (SAE) на модель миші, у якої ожиріння було викликане введенням дієти з високим вмістом жиру (HFD).
Матеріали і методи
Матеріали
Анти-PPARγ (sc-7273), SREBP-1 (sc-366) та CD36 (sc-13572) були придбані у компанії Santa Cruz Biotechnology (Санта-Крус, Каліфорнія, США). Антитіла проти FAS (# 3180) та β-актину (# 4967) були придбані у Cell Signaling (Danvers, MA, USA). Інсулін (I5500), ізобутилметилксантин (I7018), дексаметазон (D4902) та Oil Red O (O0625) були придбані у Sigma-Aldrich (Сент-Луїс, Міссурі, США). Набори тригліцеридів сироватки та тканин (TG), загального холестерину (TC) та ліпопротеїдів-холестерину високої щільності (HDL-C) були придбані у компанії Wako Chemicals (Осака, Японія). Набір інсулінових ІФА був отриманий від компанії Shibayagi Co. (Gunma, Токіо, Японія). Комплект лептину ELISA був придбаний у R&D Systems (Міннеаполіс, Міннесота, США).
Приготування екстракту
Сушені квіткові бруньки Syzygium aromaticum були придбані у компанії Omni Herb Company (Сеул, Південна Корея) і екстраговані тричі 70% етанолом при кімнатній температурі протягом ночі. Екстракти об'єднували і концентрували за допомогою роторного випарника, сушили ліофілом у вакуумі і розчиняли в диметилсульфоксиді (ДМСО).
Культура клітин та їх диференціація
Клітини 3T3-L1 культивували в модифікованому Дульбекко середовищі Eagle's (DMEM; Invitrogen, Карлсбад, Каліфорнія, США) з 1% пеніциліну-стрептоміцином та 10% бичачої сироватки теляти при 37 ° C у 5% CO2. Клітини висівали при щільності 4 × 10 5 клітин/лунку в 6-лункову платівку. Через 2 дні після злиття (0-й день) клітини піддавали дії розчину MDI, що містив 0,5 мМ 3-IBMX, 1 мкМ дексаметазону та 1 мкг/мл інсуліну протягом 2 днів у DMEM з 10% фетальної бичачої сироватки ( FBS). Після індукції клітини переходили на розчин, що містить середовище DMEM, доповнене 1% пеніциліном-стрептоміцином, 10% FBS та 167 нм інсуліном протягом 2 днів. Клітини витримували в середовищі після диференціації (DMEM, що містить 1% пеніцилін-стрептоміцину та 10% FBS) і змінювали кожні 2 дні. Для вивчення впливу SAE на диференціацію преадипоцитів в адипоцити клітини обробляли різними концентраціями SAE через 2 дні після злиття (день 0).
Масляно-червоне фарбування O
Для кількісного визначення клітини фіксували 10% нейтральним формаліном протягом 1 години при кімнатній температурі, промивали забуференним фосфатом фізіологічним розчином (PBS) і потім фарбували протягом 1 години 0,5% олійного червоного O у 60% ізопропанолу. Після промивання дистильованою водою фарбовані клітини спостерігали під мікроскопом. Потім забарвлені краплі ліпідів екстрагували ізопропанолом для кількісного визначення шляхом вимірювання його поглинання при 490 нм.
Тваринні моделі
Самці мишей C57BL/6J у віці 4 тижнів були отримані від Orient Bio Inc. (Сеул, Південна Корея) та акліматизовані до лабораторних умов, що складалися з 12: 12-годинного циклу світло-темрява, 24 ° C та 55% вологості протягом 1 тижня. Потім у віці 5 тижнів мишей випадковим чином розподіляли на три групи; група, яка харчувалася дієтою AIN-76A Американського інституту харчування (нормальна група), група, яка годувалась HFD (група HFD), і група, яка годувала HFD з додаванням 0,5% (мас./мас.) SAE (група HFD + SAE) протягом 9 тижнів. Експериментальні дієти готували, доповнюючи основну дієту AIN-76 20% жиру та 0,5% холестерину (мас./Мас.). Вага тіла та середньодобове споживання їжі вимірювали щотижня. Догляд за тваринами та їх використання відповідали нашим інституційним та національним правилам, і всі експериментальні процедури були затверджені Корейським комітетом з досліджень та догляду за тваринами (KFRI-IACUC, № 2010-0011).
Підготовка зразка та процедури
Через дев'ять тижнів після споживання експериментальних дієт мишей піддавали голодуванню протягом 12 годин, а потім жертвували. Зразки крові відбирали з черевної аорти, центрифугували при 1000 × g протягом 15 хв і зберігали при -80 ° C. Вимірювання рівня TG, TC та HDL-C у сироватці проводили за допомогою відповідного набору. Вимірювання концентрацій інсуліну та лептину в сироватці крові проводили відповідно до інструкцій виробника щодо наборів ELISA для інсуліну та лептину для мишей. Епідидимальні, периренальні та печінкові тканини висікали, зважували та зберігали при -80 ° C до використання. Жирові прокладки печінки та епідидиму або фіксували у 4% розчині формаліну та обробляли для гістологічного дослідження, або заморожували у рідкому азоті та зберігали при -80 ° C до екстракції білка та РНК.
Для визначення загального рівня ліпідів, TG і TC у печінці печінку кожної групи гомогенізували у 5 мл NaCl. Після того, як до кожного гомогенату потім додавали 20 мл розчину Фольха (хлороформ: метанол = 2: 1), отриманий розчин інкубували при 4 ° С протягом 12 годин. Зразки центрифугували протягом 10 хв при 1000 × g, перш ніж органічний шар був видалений і висушений за допомогою Speed Vac. Отриману гранулу розчиняли в етиловому спирті, що містить 25% Triton X-100, а потім аналізували на рівні TG, TC та HDL-C за допомогою зазначених комерційних наборів.
Гістологічний аналіз
Печінка та жирові прокладки епідидиму фіксували у 4% формаліні з нейтральним буфером, вкладали у парафін, нарізали товщиною 5 мкм та фарбували плямою гематоксиліну та еозину (H&E). Патологічні зміни оцінювали та фотографували під мікроскопом Olympus BX-51 (Olympus, Токіо, Японія).
Вестерн-блот
Ізольовані екстракти печінки, жирової тканини та клітин готували у розчині для екстракції білка PRO-PREP (Intron Biotechnology, Gyeonggi, Південна Корея) із використанням системи MP 40 (MD Biosciences, St. Paul, MN, USA). Екстракти центрифугували при 15000 об/хв протягом 20 хв при 4 ° С. Супернатанти кип'ятять із завантажувальним буфером додецилсульфату натрію (SDS), завантажують на гелі трис-гліцину, переносять у мембрани полівініліденфториду (PVDF) і візуалізують за допомогою хемілюмінесцентного реагенту (Amersham Bioscience, Piscataway, NJ, США).
Вилучення РНК та ПЛР у режимі реального часу
Загальну РНК виділяли з печінки за допомогою реагенту TRIzol (Invitrogen, Карлсбад, Каліфорнія, США) відповідно до інструкцій виробника. Після отримання кДНК із ізольованої РНК із застосуванням преміксу Maxime RT (праймер оліго dT) отриману кДНК використовували як шаблон для ПЛР у реальному часі із системою Light Cycler 480 (Рош, Базель, Швейцарія). Конкретні праймери були такими: Fas sense AGAGATCCCGAGACGCTTCT, антисмисловий GCCTGGTAGGCATTCTGTAGT; Srebp sense GCAGCC ACCATCTAGCCTG, антисмисловий CAGCAGTGAGTCTGCCTT GAT; Pparg sense TCGCTGATGCACTGCCTATG, антисмисловий GAGAGGTCCACAGAGCTGATT; Ppara sense AACATC GAGTGTCGAATATGTGG, антисмисловий AGCCGAATAGTT CGCCGAAAG; і β-актиновий сенс AATACCCCAGCCATG TGTGT, антисмисловий ATGGGCACTGTGTGTGACC. Рівень мРНК виражали як відношення інтенсивності сигналу для кожного гена щодо β-актину.
Статистичний аналіз
Результати виражаються як середнє значення ± SE, а різниці між трьома групами обчислювались за допомогою аналізу кількох діапазонів та однобічного тесту на дисперсію за допомогою програмного забезпечення GraphPad Prism4 (Сан-Дієго, Каліфорнія, США).
Результати
SAE пригнічує диференціювання клітин преадипоцитів 3T3-L1
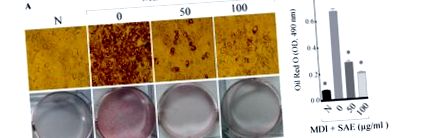
Вплив лікування SAE на метаболізм ліпідів in vitro досліджували, досліджуючи його вплив на диференціацію адипоцитів на клітинах 3T3-L1, добре встановлену клітинну лінію преадипоцитів, що використовується для вивчення перетворення преадипоцитів в адипоцити. Після диференціації з SAE або без нього отриману масу накопиченого внутрішньоклітинного ліпіду фарбували барвником Oil Red O та кількісно визначали. Як показано на рис. 1, у клітинах, оброблених SAE, спостерігали дозозалежне зменшення накопичення ліпідів, що свідчить про те, що SAE інгібує фактори транскрипції адипоцитів під час диференціації адипоцитів.
Значення представлені як середнє значення ± SD (n = 8).
SAE знижує рівень TG і TC у сироватці крові у мишей, що харчуються HFD
Після 9 тижнів лікування рівні TG та TC у групі HFD + SAE виявились значно нижчими, на 33,4 та 8,8% нижче, ніж у групи HFD (рис. 3А), що припускає, що SAE проявляє гіполіпідемію ефект у HFD-мишей.
SAE покращує вміст тригліцеридів у сироватці крові, загального холестерину, холестерину ліпопротеїдів високої щільності, рівня глюкози, інсуліну та лептину у мишей, що харчуються дієтою. Усі рівні аналізували за допомогою наборів ІФА. Дані виражаються як середнє значення ± SD. a, b Істотні відмінності (P Рис. 3B) та група HFD + SAE, що свідчить про те, що підвищений рівень внаслідок годування HFD значно зменшився внаслідок добавок SAE. Ці висновки вказують на те, що нижчий рівень глюкози та інсуліну в сироватці крові може бути зумовлений нижчою інсулінорезистентністю.
SAE пригнічує адипогенез у мишей, що харчуються HFD
Встановлено, що добавки SAE зменшили розмір жирової прокладки епідидиму у мишей, що годували HFD (рис. 4А). Дослідження способу, яким доповнення SAE зменшує вагу жирової прокладки епідидиму, показало, що воно пригнічує експресію кількох білків, пов’язаних з генами адипогенезу, включаючи SREBP-1, PPARγ та FAS (рис. 4B), вказуючи на те, що воно справляє ожиріння ефект шляхом пригнічення адипогенезу.
SAE зменшує розмір епідидимальних жирових прокладок у мишей, що харчуються дієтою. (А) Епідидимальні жирові прокладки фіксували, розрізали та фарбували гематоксиліном та еозином. (B) Рівні білка адипогенних генів у жирових прокладках епідидиму вимірювали за допомогою вестерн-блот-аналізу. N, AIN-76A дієта; HFD, дієта з високим вмістом жиру; HFD + SAE, дієта з високим вмістом жиру + добавки SAE; SAE, екстракт етанолу S. aromaticum.
SAE послаблює жирову печінку у мишей, що харчуються HFD
Порівняння впливу добавок SAE на ступінь накопичення ліпідів у печінці груп HFD + SAE та HFD через фарбування H&E показало зменшення білого забарвлення та меншу кількість крапель ліпідів та нефарбованих кіл у печінці групи HFD + SAE порівняно з Група HFD (рис. 5А). Встановлено, що загальний рівень ліпідів, ТК та ТГ у групі HFD + SAE знизився відповідно на 45,2, 37,5 та 39,5% (рис. 5В). Ці результати дозволяють припустити, що добавки SAE послабили збільшення рівня печінкового ТГ і ТК через годування HFD.
SAE регулює рівень білка та мРНК ліпогенних генів у печінці у мишей, що харчуються дієтою. (А) Печінку фіксували, розрізали та фарбували гематоксиліном та еозином. (B) Рівень загального ліпіду, тригліцеридів та загального холестерину в печінці аналізували за допомогою наборів ELISA. (В) Рівні білка ліпогенних генів у печінці вимірювали за допомогою вестерн-блот-аналізу. (D) Експресія факторів транскрипції в печінці, виміряна за допомогою RT-PCR. Дані виражаються як середнє значення ± SD. a – c Істотні відмінності (P Рис. 5C). Порівняння цих факторів у групах HFD та HFD + SAE показало, що добавки SAE знизили їх рівень у групі HFD + SAE, надаючи додаткові докази антиліпогенних ефектів SAE. Відповідно до інгібування PPARγ добавками SAE, добавки, здається, також регулювали рівень мРНК Pparg (рис. 5D), а також мали значну активацію Ppara, регулятора β-окислення жирних кислот. У сукупності ці висновки вказують на те, що добавки SAE пригнічують розвиток HFD-індукованої жирової печінки шляхом регуляції ліпогенних генів.
Обговорення
Встановлено, що численні трави та спеції знижують рівень глюкози в крові та масу тіла. Серед цих трав S. aromaticum (сімейство Myrtaceae) використовується не тільки як кулінарний додаток у декількох світових кухнях, але і як традиційний лікарський засіб для лікування зубного болю, головного болю та розладів дихання в ряді країн Азії. Кілька досліджень повідомляють, що S. aromaticum чинить різноманітні фармакологічні дії, включаючи антиоксидантну, гіпоглікемічну та протизапальну активність (7,10,11). Однак, наскільки нам відомо, жодне дослідження не вивчало його дії щодо запобігання ожирінню. Таким чином, це дослідження та його основний висновок про те, що додавання SAE до раціону знижує масу тіла у мишей, що харчуються HFD, тим самим вказуючи на його потенціал як природного доповнення до ожиріння, є значним внеском у дослідження та літературу в цій галузі.
Встановлено, що дидиференціація адипоцитів преадипоцитів 3T3-L1 залежить від генів, що беруть участь у адипогенному шляху під час процесу диференціації (12). В культивованих моделях адипоцитів виявлено, що SAE інгібує диференціювання адипоцитів у клітинах 3T3-L1 дозозалежним чином. Хоча аналіз результатів аналізу in vitro, проведеного в цьому дослідженні, не вказував на те, що добавки SAE впливали на експресію генів, пов'язаних з адипогенезом, аналіз результатів вестерн-блот-аналізу in vivo показав, що він сильно пригнічує збільшення Маса WAT у мишей, що харчуються HFD, за рахунок зменшення експресії PPARγ та SREBP-1. Аналіз цих результатів вказує на те, що добавки SAE зменшують масу WAT за рахунок зменшення адипогенезу, що призводить до втрати ліпідів, і, отже, настійно припускає, що добавки SAE запобігають індукованому HFD накопичення ліпідів в жировій тканині епідидимуму шляхом регулювання адипогенезу.
Харчування HFD підвищує рівень лептину та інсуліну в сироватці крові, що пов’язано з витратами енергії, метаболізмом глюкози та окисленням жирних кислот (13). Встановлено, що добавки SAE значно знизили рівень лептину та інсуліну в сироватці крові у мишей, що харчуються HFD, що вказує на те, що SAE покращує ці метаболічні порушення, спричинені HFD. Також було встановлено, що добавки SAE зменшили збільшення маси печінки та ліпідів у печінці, спричинене HFD, а також рівні TC і TG, що підтверджується результатами фарбування H&E, що вказувало на те, що добавки SAE зменшували накопичення ліпідів у печінці. Дослідження печінкової експресії генів, що регулюють ліпідний обмін, показало, що добавки SAE значно запобігали зниженню Ppara і пригнічували експресію як ліпогенного фактора транскрипції Pparg, так і ліпогенних регуляторних білків, включаючи CD36, SREBP-1 та PPARγ, регулюючи тим самим експресія генів, що сприяють окисленню жирних кислот. Ці дані свідчать про те, що добавки SAE покращують метаболічні параметри печінки завдяки регуляції генів, пов’язаних з ліпогенезом, у печінці.
Хоча ці результати дають докази того, що добавки SAE суттєво пригнічують ожиріння у мишей, що харчуються HFD, необхідне подальше дослідження активних сполук, відповідальних за ефекти проти ожиріння. Курода та співавт. Нещодавно повідомили, що похідні евгенолу, включаючи дегідродієгенол та дегідродієгенол В, мають сильні гіпоглікемічні ефекти завдяки активації PPARγ на діабетичних моделях (11). На відміну від результатів аналізу in vitro у цьому дослідженні, Курода та співавт. Виявили, що ці компоненти стимулюють диференціацію преадипоцитів 3T3-L1 через активацію PPARγ, вказуючи на те, що невідомі сполуки в SAE, крім дегідродієгенолу та дегідродієгенолу В, можуть інгібувати активацію PPARγ та проявляти ожиріння. ефекти за допомогою регуляції генів, пов’язаних з адипогенною хворобою.
У сукупності результати цього дослідження дають вагомі докази того, що добавки SAE здійснюють ефект ожиріння на індукованих HFD мишей із ожирінням шляхом регулювання генів, пов'язаних з метаболізмом ліпідів у печінці та WAT, таким чином, що призводить до зменшення накопичення ліпідів. Ці результати сильно підтверджують потенціал SAE як доповнення до ожиріння в регулюванні маси тіла.
Подяка
Це дослідження було підтримане Національним технологічним проектом платформи Міністерства економіки знань в Кореї та Корейським інститутом досліджень продуктів харчування.
- Збільшення ваги у відповідь на годування з високим вмістом жиру у мишей-самців CD-1 - W L Breslin, K Strohacker, K C
- Втрата ваги у відповідь на позбавлення їжі передбачає ступінь ожиріння, спричиненого дієтою, у C57BL6J
- Веганська дієта натще зменшує патологію запальних захворювань кишечника у мишей EurekAlert! Наука
- Вплив добавок екстракту зеленої кави на ожиріння Систематичний огляд та відповідь на дозу
- Домашній пил пов’язаний із ожирінням - але лише у мишей