Ефективний синтез аміаку над каталізатором Ru/La0,5Ce0,5O1,75, попередньо відновленим при високій температурі †
Юта Огура
кафедра інтегрованої науки і техніки факультету науки і техніки Університету Оїти, 700 Даннохару, Оїта 870-1192, Японія. Електронна адреса: pj.ca.u-atio@akoagan
Кацутосі Сато
кафедра інтегрованої науки і техніки факультету науки і техніки Університету Оїти, 700 Даннохару, Оїта 870-1192, Японія. Електронна адреса: pj.ca.u-atio@akoagan
b Ініціатива стратегії елементів для каталізаторів та акумуляторів, Кіотський університет, 1-30 Горьо-Охара, Нісікьо-ку, Кіото 615-8245, Японія
Шін-Ічіро Міяхара
кафедра інтегрованої науки і техніки факультету науки і техніки Університету Оїти, 700 Даннохару, Оїта 870-1192, Японія. Електронна адреса: pj.ca.u-atio@akoagan
Юкіко Кавано
кафедра інтегрованої науки і техніки факультету науки і техніки Університету Оїти, 700 Даннохару, Оїта 870-1192, Японія. Електронна адреса: pj.ca.u-atio@akoagan
Такаакі Торіяма
c Дослідницький центр ультрамікроскопії, Університет Кюсю, Motooka 744, Nishi-ku, Fukuoka 819-0395, Японія
Томокадзу Ямамото
d Кафедра прикладної квантової фізики та ядерної інженерії, Університет Кюсю, Motooka 744, Nishi-ku, Fukuoka 819-0395, Японія
Сьо Мацумура
c Дослідницький центр ультрамікроскопії, Університет Кюсю, Motooka 744, Nishi-ku, Fukuoka 819-0395, Японія
d Кафедра прикладної квантової фізики та ядерної інженерії, Університет Кюсю, Motooka 744, Nishi-ku, Fukuoka 819-0395, Японія
Сабуро Хосокава
b Ініціатива стратегії елементів для каталізаторів та акумуляторів, Кіотський університет, 1-30 Горьо-Охара, Нісікьо-ку, Кіото 615-8245, Японія
Кацутосі Нагаока
кафедра інтегрованої науки і техніки факультету науки і техніки Університету Оїти, 700 Даннохару, Оїта 870-1192, Японія. Електронна адреса: pj.ca.u-atio@akoagan
Пов’язані дані
Анотація
Аміак зазвичай синтезується енергоємним процесом Габера – Боша, який виконується при дуже високих температурах (> 450 ° С) і високих тисках (> 20 МПа) і на який припадає 1–2% світового споживання енергії. Приблизно 60% енергії, спожитої процесом, відновлюється і зберігається у вигляді ентальпії в молекулі аміаку; але енергія, що залишилася, втрачається, здебільшого, під час виробництва водню з природного газу, синтезу аміаку та сепарації газу. Розробка методів зменшення енергії, використовуваної цим процесом, була метою значного обсягу досліджень.8 Одним із способів досягнення цього було б замінити каталізатори на основі заліза, що використовуються в процесі Габера-Боша, каталізатором, який дозволить використовувати більш м’які умови (нижчі температури та тиск) .9–12
У 1990-х Aika та співавт. виявили, що рідкісноземельні оксиди, такі як CeO2 та La2O3, є ефективною опорою для каталізаторів Ru.26 Крім того, нещодавно ми повідомляли, що каталізатор Ru, який підтримується на рідкоземельному оксиді Pr2O3, проявляє високу активність синтезу аміаку.27 Aika et al. повідомляли, що швидкість синтезу аміаку над Ru/CeO2 висока, коли каталізатор попередньо відновлений при 500 ° C. 26 Під час попереднього відновлення частина Ce 4+ відновлюється до Ce 3+, і, таким чином, електрон переноситься в Ru, а потім в адсорбовані молекули N2. Однак швидкість синтезу аміаку є повільнішою в порівнянні з каталізатором, попередньо відновленим при температурі вище 500 ° C, внаслідок структурних змін, пов'язаних із спіканням основи. Для збільшення питомої поверхні каталізаторів, а також скорочуваності Ce 4+ різні дослідники використовували композитно-оксидні носії, такі як CeO2 – La2O3,28 MgO – CeO2,29,30 BaO – CeO2,31 CeO2 –ZrO2,32 та Sm2O3 – CeO2,33 для каталізаторів Ru. Однак швидкості синтезу аміаку, досягнуті цими каталізаторами, залишаються недостатніми для практичного використання. Як пропонують Aika et al., Температура попереднього відновлення для цих каталізаторів підтримується нижче 500 ° C для мінімізації агрегації частинок Ru.26
Тут ми повідомляємо про активність синтезу аміаку Ru/La0.5Ce0.5O1.75, каталізатора, що складається з Ru, нанесеного на твердий розчин La0.5Ce0.5O1.75, який є композитним оксидом CeO2 та La2O3. Після попереднього відновлення при незвично високій температурі 650 ° C каталізатор виявляв високу активність синтезу аміаку при температурах реакції від 300 до 400 ° C; активність була найвищою серед каталізаторів Ru, що підтримуються оксидом, і порівнянна з активністю найбільш активних каталізаторів Ru, про які повідомлялося на сьогодні. Термостабільний оксидний носій, який мав середній склад La0,5Ce0,5O1,64 після попереднього відновлення при 650 ° C, складався з дрібних частинок Ru, міцно прикріплених до відновленого носія, і мав численні активні сайти Ru. Залежність структури та стану каталізатора від температури відновлення з'ясовували за допомогою різних методів характеристики, включаючи спектроскопію втрат електронів (EELS) та скануючу електронну мікроскопію (STEM). Цей каталізатор має переваги у тому, що він легко готується і стабільний в атмосфері, що полегшує завантаження в реактор.
Результати і обговорення
Аміако-синтетична активність Ru/La0,5Ce0,5O1,75
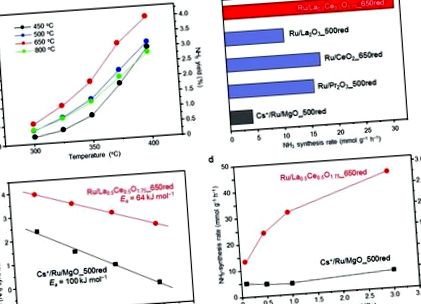
Залежність температури реакції швидкості синтезу аміаку від Ru/La0,5Ce0,5O1,75 від температури вимірювали при 1,0 МПа після попереднього відновлення каталізатора при 450, 500, 650 або 800 ° C. В умовах реакції рівноважна швидкість синтезу аміаку та вихід аміаку при 400 ° С становлять 127 ммоль г –1 год –1 та 7,91% відповідно. При всіх температурах реакції швидкість синтезу аміаку була помітно вищою для каталізатора, попередньо відновленого при 650 ° C, ніж для каталізаторів, попередньо відновленого при 450 ° C (температура, яка використовувалась у попередньому дослідженні28) або 500 ° C (Рис. 1а). Однак підвищення температури попереднього відновлення до 800 ° C різко знизило швидкість. Тобто оптимальна температура попереднього відновлення становила 650 ° C, що значно вище, ніж реакційні температури, які зазвичай використовуються для синтезу аміаку, каталізованого Ru (≤400 ° C).
Ми підготували ділянки Арреніуса для реакцій синтезу аміаку, каталізованих Ru/La0.5Ce0.5O1.75_650red та Cs +/Ru/MgO_500red, використовуючи норми при 300, 325, 350 та 375 ° C (рис. 1c). Щоб уникнути внеску зворотної реакції у швидкість синтезу аміаку, на ділянках не застосовували швидкість при 400 ° C. Явна енергія активації (Ea), розрахована для Ru/La0,5Ce0,5O1,75_650red (64 кДж моль –1), була набагато нижчою, ніж для Cs +/Ru/MgO_500red (100 кДж моль –1), і була порівнянна з такою повідомлено для 10 мас.% Ru/Ca (NH2) 2 (59 кДж моль –1) .24 Ці результати демонструють, що низька видима енергія активації реакції над Ru/La0.5Ce0.5O1.75_650red відповідає за високий вміст аміаку швидкість синтезу.
Ми також досліджували вплив реакційного тиску на швидкість синтезу аміаку при 350 ° C (рис. 1г). Як повідомляється, підвищення реакційного тиску з 0,1 до 1,0 МПа не впливає на швидкість синтезу аміаку над Cs + /Ru/MgO_500red.9,24. Цей результат означає, що атоми водню, сильно адсорбовані на Ru, перешкоджають активації молекул N2 ( явище, що називається отруєнням воднем), що є типовим недоліком звичайних каталізаторів Ru.35,36 Навпаки, ми спостерігали, що при 0,1 МПа швидкість синтезу аміаку над Ru/La0,5Ce0,5O1,75_650red становила 13,4 ммоль г –1 год –1, що є найвищим показником на сьогодні для каталізаторів Ru; і швидкість зросла до 31,3 та 44,4 ммоль г –1 год –1 при підвищенні тиску до 1,0 та 3,0 МПа відповідно. Отже, ми припустили, що отруєння воднем не відбулося над Ru/La0.5Ce0.5O1.75_650 червоним при досліджуваній температурі. Для підтвердження цього припущення ми провели кінетичний аналіз при 350 ° C та 0,1 МПа. З цією метою визначали порядок реакцій для N2, H2 та NH3 з припущенням виразу швидкості (1) (умови реакції та отримані результати наведені в таблиці S1 †). 37,38
Як показано на рис. S1, † порядки реакцій H2 для Cs +/Ru/MgO_500red та Ru/La0.5Ce0.5O1.75_650red оцінювались у –0,76 та 0,15, відповідно. Ці результати вказують на те, що поверхня Cs +/Ru/MgO_500red сильно отруєна воднем. На відміну від них, Ru/La0.5Ce0.5O1.75_650red не отруєний воднем. Ці результати добре узгоджуються із спостереженнями, показаними на рис. 1г. Крім того, порядок реакції N2 для Cs +/Ru/MgO_500red становив 1,07, що відповідає попереднім роботам.9,37,39 На противагу цьому для Ru/La0,5Ce0,5O1,75_650red він становив 0,76, що вказує на зв'язок NN розщеплення, яке є етапом, що визначає швидкість синтезу аміаку, відносно підвищується порівняно з Ru/La0.5Ce0.5O1.75_650red. Крім того, досліджували стабільність Ru/La0,5Ce0,5O1,75_650 червоного кольору при 350 ° C при 3,0 МПа. Коли для очищення суміші H2/N2 був встановлений вбудований газоочищувач (рис. S2 †), швидкість синтезу аміаку була стабільною протягом 50 годин, що вказує на те, що Ru/La0,5Ce0,5O1,75 демонструє довготривалу стабільність.
Безпосереднє спостереження Ru/La0.5Ce0.5O1.75_650 червоного кольору без впливу повітря
Структуру червоного каталізатора Ru/La0.5Ce0.5O1.75_650 досліджували за допомогою корекційної аберації електронно-просвітницької електронної мікроскопії (ТЕМ), а елементарні розподіли та валентні стани іонів Ce оцінювали за допомогою візуалізації спектру STEM одночасно енергетично-дисперсійне рентгенівське (EDX) картографування та EELS. Оскільки елементарні стани та структура каталізатора можуть змінюватися під впливом повітря, ми проводили ці аналізи за відсутності повітря за допомогою спеціального тримача з газовим елементом для перенесення зразка з середовища інертного газу всередину Стовпець TEM. Порівняння висококутових кільцевих зображень STEM темного поля (HAADF) (рис. 2а і b) та карт EDX (рис. 2в) каталізатора показало, що Ce і La однорідно дисперговані в оксидному носії і що частинки Ru були завантажений на опору.
На рис. 2г та д показані спектри ЕЕЛ, отримані з даних спектрального зображення для центральної області (рис. 2б, зелений квадрат) густої частинки каталізатора (інформація як про поверхню, так і про основну частинку частинки), край (синій квадрат) ) однієї і тієї ж частинки каталізатора (інформація в основному про поверхню частинки) та центр (червоний квадрат) тонкої частинки каталізатора (інформація про поверхню частинки). У всіх спектрах EEL спостерігалися два піки La M4,5, які можна віднести до La 3+, один при 836,1, а другий при 852,4 еВ. 40 Крім того, усі спектри EEL показали піки Ce M4,5, приписані Ce 3 + та Ce 4+ приблизно при 883,4 (як піки розбиття, коли інтенсивність була сильною) та 901,8 еВ та при 885,6 та 903,5 еВ відповідно. 40-42 Ce 4+ переважали у центральній області (зелений квадрат) густої частинки каталізатора тоді як Ce 3+ переважав на краю (синій квадрат) товстої частинки каталізатора, а частка Ce 3+ була найвищою в центрі (червоний квадрат) тонкої частинки каталізатора. Карти EELS Ce у товстих і тонких частинках чітко продемонстрували однакову тенденцію; тобто Ce 3+ збагачувався біля поверхні частинок каталізатора (рис. 2f). Ці результати вказують на те, що значна частка атомів Ce 4+, розташованих поблизу поверхні частинок каталізатора, була відновлена до Ce 3+ при 650 ° C.
Пояснення високої здатності аміаку до синтезу Ru/La0.5Ce0.5O1.75_650red
Таблиця 1
| Температура зниження (° C) | Питома площа поверхні (м 2 г –1) | H/Ru a (-) | Ступінь відновлення Ce 4+ b (%) | Середній розмір частинок Ru c (нм) | TOF d (s –1) | Швидкість синтезу NH3 при 350 ° C та 1,0 МПа (ммоль г –1 год –1) |
| 500 | 47 | 0,46 | 23 | 1.8 | 0,027 | 22.1 |
| 650 | 42 | 0,35 | 43 | 1.7 | 0,051 | 31.3 |
| 800 | 21 | 0,11 | 63 | 2.7 | 0,108 | 20.6 |
a Оцінено за здатністю хемосорбції H2.
b Розраховано за здатністю поглинання O2, показаною на рис. S7 для відновлених каталізаторів.
c Оцінено за зображеннями STEM на рис. S8.
d TOF, частота обороту. Розраховано на основі значення H/Ru та швидкості синтезу аміаку.
Отримані нами результати вказують на те, що зв'язок N N N2 ослаблений вкладом SMSI навіть після зниження при 500 ° C, а коли температура відновлення була збільшена до 650 ° C, внесок SMSI був більшим. Тобто частково відновлений носій, який збагачується електронами завдяки відновленню Ce 4+ до Ce 3+ та утворенню вакансій кисню, частково покривав частинки Ru. В результаті перенос електрона від зменшеної опори до металу Ru значно посилився, і електрони перенесли на антизв’язувальні π-орбіталі N2; таким чином, N N-зв'язки N2, адсорбовані на атомах Ru, які безпосередньо взаємодіяли зі зменшеною опорою, були ще більш послаблені. Відношення площі піку піку вищої хвилі до піку нижньої хвилі зменшилося, коли температура попереднього зниження була підвищена з 500 до 650 ° C, що узгоджується зі збільшенням внеску SMSI.
Ці результати демонструють, що попереднє відновлення при високій температурі індукувало SMSI та підвищувало частоту обороту (TOF), але зменшувало кількість активних центрів Ru, оскільки частинки Ru частково покривали частково зменшеною підтримкою. Той факт, що активних майданчиків Ru (TOF = 0,051 с –1) було багато (H/Ru = 0,35) після попереднього відновлення при 650 ° C, пояснює високу швидкість синтезу аміаку (31,3 ммоль г –1 год –1) над Ru /La0.5Ce0.5O1.75_650червоний. На відміну від цього, після попереднього відновлення при 800 ° C, сайти Ru були дуже активними (TOF = 0,108 с –1), але кількість активних сайтів Ru було невеликим (H/Ru = 0,11); таким чином швидкість синтезу аміаку над Ru/La0,5Ce0,5O1.75_800red (20,6 ммоль г –1 год –1) була нижчою, ніж для Ru/La0,5Ce0,5O1.75_650red. Зауважимо, що питома поверхня поверхні Ru/CeO2_650red становила лише 20 м 2 г –1, середній діаметр частинок Ru становив 3,1 нм, а H/Ru 0,17, що вказує на те, що спікання частинок Ru і La0,5Ce0. 5O1.75 було уповільнено у випадку Ru/La0.5Ce0.5O1.75_650red, і, таким чином, співвідношення H/Ru для цього каталізатора залишалося високим.
Висновки
Конфлікт інтересів
Немає конфліктів для декларування.
Додатковий матеріал
Подяка
Це дослідження було підтримано грантом програми CREST, JST (№ JPMJCR1341). Спостереження STEM були проведені в рамках програми, проведеної Японською платформою розширених характеристик нанотехнологій, що фінансується Міністерством освіти, культури, спорту, науки та технологій (MEXT), Японія. К. Сато та С. Хосокава дякують Програмі для стратегічної ініціативи щодо елементів для каталізаторів та акумуляторів (ESICB) на замовлення MEXT. Автори дякують пану Ю. Ваді (Університет Оїти) за допомогу в прийомах характеристик.
- Перша передача власних режимів за допомогою високоефективної оцінки CSI для багатокористувацького масивного використання MIMO
- Китай Найдешевший костюм для схуднення на тілі - салонне обладнання, високотемпературний стерилізатор-M-U01;
- Чи впливає температура душу на швидкість мозку кількісно?
- 90-денна програма вправ високої інтенсивності HASfit Hero - вдосконалений план тренувань
- Член хору вражає високу ноту після хірургічного втручання для зниження ваги Лемон, штат Іллінойс