Ефект проти ожиріння оцту Гінкго, ферментованого продукту оболонки насіння Гінкго, на мишей, що отримують дієту з високим вмістом жиру та клітини преадипоцитів 3T3-L1
Шуго Хосода
1 відділ естетичної стоматології та клінічної каріології, кафедра консервативної стоматології, стоматологічна школа університету Шова, Ота-ку, Токіо 145-0062, Японія; pj.ca.u-awohs.tned@adosoh (S.H.); moc.ssiteneger@abihs (Т.С.); pj.ca.u-awohs.tned@ebanama (A.M.)
Юмі Кавазое
2 RegeneTiss Inc., Окая, Нагано 394-0046, Японія; moc.ssiteneger@eozawak
3 Відділ токсикології, Кафедра фармакології, токсикології та терапії, Школа фармацевтики Університету Шова, Шінагава-ку, Токіо 142-8555, Японія
Тосіказу Шиба
1 відділ естетичної стоматології та клінічної каріології, кафедра консервативної стоматології, стоматологічна школа університету Шова, Охта-ку, Токіо 145-0062, Японія; pj.ca.u-awohs.tned@adosoh (S.H.); moc.ssiteneger@abihs (Т.С.); pj.ca.u-awohs.tned@ebanama (A.M.)
2 RegeneTiss Inc., Окая, Нагано 394-0046, Японія; moc.ssiteneger@eozawak
Сатоші Нумадзава
3 Відділ токсикології, Кафедра фармакології, токсикології та терапії, Школа фармацевтики Університету Шова, Шінагава-ку, Токіо 142-8555, Японія
4 Центр фармакологічних досліджень, Університет Шова, Шінагава-ку, Токіо 142-8555, Японія
Ацуфумі Манабе
1 відділ естетичної стоматології та клінічної каріології, кафедра консервативної стоматології, стоматологічна школа університету Шова, Ота-ку, Токіо 145-0062, Японія; pj.ca.u-awohs.tned@adosoh (S.H.); moc.ssiteneger@abihs (Т.С.); pj.ca.u-awohs.tned@ebanama (A.M.)
Пов’язані дані
Анотація
Шкірка насіння гінкго використовується рідко і, як правило, від неї викидається через її образливий запах та токсичність. Оцет з гінкго є ферментованим продуктом оболонки насіння гінкго, і бродіння усуває неприємний запах та більшу частину токсичності. Таким чином, оцет гінкго містить дуже низькі концентрації токсичних компонентів. У цьому дослідженні вивчався ефект ожиріння оцту гінкго на мишах, які харчувались жирною дієтою, та його пригнічення адипогенезу в клітинах 3T3-L1. Оцет гінкго пригнічував збільшення маси тіла, спричинене дієтами, і зменшував розмір жирових клітин у мишей. Оцет гінкго пригнічував експресію C/EBPδ та PPARγ, ключових білків в адипогенезі, та інгібував накопичення ліпідів у клітинах 3T3-L1, які були викликані перетворенням на адипоцити. Ці результати припустили, що оцет гінкго пригнічує диференціацію адипоцитів. З іншого боку, відповідна концентрація оцтової кислоти мала значно менший вплив на накопичення ліпідів і практично не впливала на експресію адипогенних генів. Ці результати припустили, що, подібно до екстракту гінкго білоба, оцет гінкго може запобігти та покращити ожиріння. Тому оболонка насіння гінкго може бути корисним матеріалом для лікарських інгредієнтів.
1. Вступ
Гінкго білоба часто садять на міських вулицях у всьому світі, оскільки він дуже стійкий до забруднення повітря, такого як вихлопні гази автомобілів, і має відмінні вогнестійкі характеристики. Однак постійно надходять скарги на поганий запах оболонок насіння гінкго, які потрапляють на вулицю та спричиняють забруднення запахом. Крім того, зовнішня оболонка насіння гінкго білоба містить гінкголову кислоту та споріднені речовини, які є високоалергенними [1], а надмірне надходження насіння гінкго призводить до отруєння гінкготоксинами, що спричинює тонічні клонічні спазми, блювоту та втрату свідомості [2, 3]. Отже, незважаючи на той факт, що оболонка насіння гінкго багата поживною речовиною, м’якоть, на яку припадає приблизно від 75% до 80% оболонки насіння гінкго, відкидається разом з насінням [4]. Оскільки гінкго білоба було визначено як зникаючий вид [5], кращою альтернативою було б ефективно використовувати образливу насіннєву оболонку, а не садити лише чоловічі дерева, щоб уникнути смороду.
2. Матеріали та методи
2.1. Матеріали
Оцет з гінкго був наданий Науково-дослідним інститутом оцту Гінкго, Inc (Кошигая, Японія). Гінкголід B і білобалід придбані у Nagara Science Inc. (Гіфу, Японія). Концентрація оцтової кислоти в оцті гінкго була розрахована на 5,0%, визначена за допомогою іонної хроматографії (Dionex ICS-5000 з аніонообмінною колонкою AS20).
2.2. Тварини
Усі експерименти на тваринах проводились відповідно до рекомендацій NIH щодо догляду та використання лабораторних тварин, і вони були затверджені Комітетом з догляду та використання тварин Університету Шова (номер дозволу 26045). Самці мишей C57BL/6 (6 тижнів) були придбані у Japan SLC Co., Ltd. (Хамамацу, Японія). Вони були пристосовані до навколишнього середовища протягом 1 тижня зі стандартною дієтою чау (F2, Sankyo Labo Service Corp, Токіо, Японія). Потім мишей випадковим чином розподіляли на п’ять груп. Чотири групи мишей отримували HFD, де жир становив 60% калорійності (Нью-Брансвік, Нью-Джерсі, США), а одну групу годували стандартною дієтою чау (n = 5 на групу). Миші отримували вільний доступ до їжі та води, які містили 0%, 2,5%, 5,0% або 7,5% оцту гінкго протягом 10 тижнів. Мишей зважували двічі на тиждень.
2.3. Гістохімічний аналіз
Жирову тканину придатків розтинали і фіксували в 10% розчині формалізованого нейтрального буфера. Жирові тканини вкладали в парафін і розрізали на зрізи. Зрізи піддавали фарбуванню гематоксиліном/еозином (ВІН) відповідно до стандартного протоколу. Гістологічні зображення жирової тканини отримували за допомогою мікроскопа (Keyence BZ-8100, Кіото, Японія). Середня площа, покрита 50-60 адипоцитами, була розрахована за допомогою програмного забезпечення Image J.
2.4. Культура клітин
Клітини 3T3-L1 були отримані з JCRB Cell Bank (Осака, Японія) і вирощені в модифікованому Дульбекко середовищі Eagle (DMEM), доповненому 10% плодовою бичачою сироваткою (FBS) та антибіотиками. Клітини (1,0 × 10 4 клітин/лунка) вирощували в 24-лунковому планшеті протягом 2 днів до злиття (день 0). Потім середовище обмінювали індукційним середовищем (MDI; DMEM з 10% FBS, 0,5 мМ 3-ізобутил-1-метилксантину, 1 мкМ дексаметазону та 10 мкг/мл інсуліну). Після 2-денної інкубації середовище обмінювались середовищем, що підтримує (DMEM з 10% FBS і 10 мкг/мл інсуліну), і клітини інкубували протягом 6 днів.
2.5. Оцінка цитотоксичності та диференціації
Клітини 3T3-L1 (4,0 × 10 4 клітини/лунка) висівали на 96-лункові мікропланшети, давали їм можливість прикріпитися протягом 24 годин і обробляли оцтом гінкго ще 24 години. Цитотоксичність оцінювали за допомогою аналізу Cell Counting Kit-8 (Dojindo, Kumamoto, Japan). Для оцінки адипогенної диференціації клітини фіксували 10% формаліном протягом 10 хв і двічі промивали дистильованою водою. Потім клітини промивали 60% ізопропанолом протягом 1 хв і фарбували 3 мг/мл олійного червоного O, розчиненого в ізопропанолі, протягом 20 хв. Пофарбовані клітини промивали один раз 60% ізопропанолом і двічі PBS. Масляне червоне O екстрагували з пофарбованих клітин, додаючи 1 мл 100% ізопропанолу і обережно гойдаючи клітини протягом 5 хв. Екстракти ізопропанолу переносили на 96-лунковий планшет і вимірювали абсорбцію при 492 нм за допомогою мікропланшета.
2.6. Вестерн-блотинг
Клітини 3T3-L1 культивували в 24-лунковому планшеті, промивали PBS і збирали 200 мкл буфера зразків (2% SDS, 5% 2-меркаптоетанол, 10% гліцерин, 0,0005% бромофеноловий синій, 62,5 мМ трис, рН 6.8). Зразки електрофорезували на 10% SDS-поліакриламідному гелі, і білки переносили на PVDF-мембрану. Мембрану блокували на 1 год блокуванням 0,2% I (Thermo Fisher Scientific Inc, Waltham, MA, USA). Мембрану зондували первинним антитілом: анти-PPARγ (1: 10000; E-8, Santa Cruz Biotechnology, Inc., Санта-Крус, Каліфорнія, США) або анти-C/EBPδ (1: 10000; C-6, Santa Cruz Biotechnology, Inc. Санта-Крус, Каліфорнія, США) протягом ночі при 4 ° C. Мембрану промивали 20 мМ Трис, рН 7,4, 137 мМ NaCl, 3 мМ KCl і 0,1% Твін 20 (TTBS) протягом 10 хв, 5 разів, потім інкубували з відповідним вторинним антитілом протягом 1 години при кімнатній температурі. Після промивання TTBS протягом 10 хв протягом 5 разів білкові смуги виявляли за допомогою звичайної системи хемілюмінесценції (Amersham Biosciences, Piscataway, NJ, США). Рівні експресії білка аналізували за допомогою ImageQuant LAS 4000 mini (GE, Healthcare, Chicago, IL, USA).
2.7. ПЛР у режимі реального часу
Загальну РНК екстрагували з клітин 3T3-L1 за допомогою міні-набору RNeasy (Qiagen, Hilden, Німеччина). Зворотну транскрипцію проводили із загальною РНК (100–200 нг) та набором зворотної транскрипції кДНК високої ємності (Applied Biosystems, Фостер-Сіті, Каліфорнія, США). Кількісну ПЛР проводили на швидкому термоциклері ABI 7500 (Applied Biosystems) із системою аналізу експресії гена TaqMan (C/EBPδ, Mm00786711_s1; PPARγ, Mm00440940_m1).
2.8. Статистичний аналіз
Статистичний аналіз проводили з одностороннім ANOVA, після чого проводився тест множинних порівнянь Тукі, якщо не вказано інше.
3. Результати
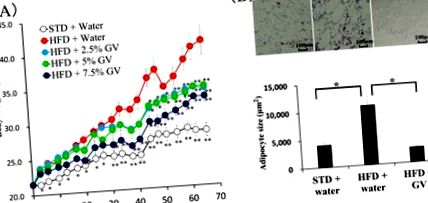
3.1. Супресивний вплив оцту гінкго на збільшення ваги у мишей
Щоб перевірити, чи не бажають миші пити оцет з гінкго, ми виміряли споживання питної води, що містить різну концентрацію оцту з гінкго. Ми спостерігали, що споживання води зменшувалось із збільшенням концентрації оцту гінкго вище 10%. З іншого боку, при вмісті оцту гінкго 7,5% або менше миші демонстрували постійне споживання, еквівалентне споживанню простої води (рис. Вживання питної води з оцтом гінкго суттєво не змінювалося принаймні тиждень. Тому ми використовували 2,5%, 5,0% та 7,5% оцту гінкго у питній воді в наступних експериментах in vivo. Ці концентрації оцту гінкго були розраховані на 0,12 мл, 0,25 мл та 0,37 мл як добове споживання відповідно.
Раніше повідомлялося, що GbE ослаблює ожиріння, спричинене ВЧР, неалкогольну жирову хворобу печінки, атеросклероз та цукровий діабет у тварин [16,17,18]. Щоб дослідити, чи мав оцет гінкго вплив, подібний до ефекту GbE, на збільшення ваги, мишей годували HFD та питною водою 2,5%, 5,0% або 7,5% оцту гінкго. Значне збільшення маси тіла протягом усього періоду експерименту спостерігалось у групах із СНВ порівняно з групою нормального харчування. Збільшення ваги, спричинене HFD, було суттєво придушене 7,5% оцту гінкго через 31 день та 2,5% та 5,0% оцту гінкго через 45 днів, порівняно з тваринами, які пили воду без оцту гінкго. Більше того, оцет гінкго пригнічував збільшення ваги у мишей, що годувались HFD, залежно від концентрації (Рисунок 1 А).
3.2. Вплив оцту Гінкго на диференціацію адипоцитів in vitro
Щоб дослідити, чи виявляють оцт гінкго та оцтова кислота інгібуючу дію на диференціацію адипоцитів, клітини 3T3-L1 обробляли 0,4% оцту гінкго та 0,02% оцтової кислоти під час диференціації адипоцитів, індукованої середовищем MDI. Як оцет гінкго, так і оцтова кислота зменшують олійно-червоне O-фарбування диференційованих адипоцитів (рис. 2 А). Однак оцет гінкго гальмував диференціювання адипоцитів глибше, ніж відповідна концентрація оцтової кислоти (рис. 2 Б).
- Ефект проти ожиріння нового розчинного мікробного пластиру з високим вмістом жиру, що містить кофеїн
- Експерименти з перевагою насіння птахів та схуднення впливають на заражений грибковим ендофітом високий
- 4 Переваги органічної олії з насіння гарбуза для шкіри; САРА ЛОНДОН
- Чи справді твердження щодо здоров’я щодо яблучного оцту - BBC News
- Білковий тонік для волосся з ефектом ламінування - купити на Ярмарке Мастеров - IOGVBCOM