Довготривале введення дієти з високим вмістом жиру виправляє аномальне ремоделювання кісток у гомілках мишей з дефіцитом інтерлейкіну-6
Анотація
Вступ
Ожиріння та остеопороз - зазвичай пов’язані із малорухливим способом життя та недоїданням - все більше привертають увагу сучасного суспільства, оскільки обидва умови можуть спричинити серйозні наслідки для здоров’я. Хоча, як правило, розглядаються окремо, ці два розлади, схоже, тісно пов'язані між собою (Goulding et al. 2005). Однак єдиної думки щодо зв’язку між ожирінням та остеопорозом немає, незважаючи на багато пов’язаної літератури (Reid et al. 1994; Ionova-Martin et al. 2010). Ожиріння традиційно вважається сприятливим для формування кісток і, отже, захистом від остеопорозу. Механічне навантаження, обумовлене підвищеною масою тіла, стимулює формування кісток шляхом збільшення проліферації та диференціації місцевих остеобластів та остеоцитів, а також зменшення апоптозу клітин остеобластичного походження через сигнальний шлях Wnt/β-катеніну (Patsch et al. 2011). Клінічні дослідження показали, що маса тіла або індекс маси тіла (ІМТ) позитивно корелює з мінеральною щільністю або кістковою масою кістки, тоді як низька маса тіла або низький ІМТ є фактором ризику низької кісткової маси та втрати кісткової маси у людей (Felson et al. . 1993; Ravn et al. 1999; Reid 2002).
Останні звіти продемонстрували, що ожиріння, спричинене дієтами з високим вмістом жиру, є причиною втрати кісткової маси і може розглядатися як фактор ризику розвитку остеопорозу (Jelcic 2010; Russell et al. 2010). Поперечне дослідження на 200 молодих людей у віці від 3 до 19 років показало, що збільшення ожиріння може бути пов’язане з підвищеним ризиком переломів кісток (Goulding et al. 2001). Ще одне велике поперечне дослідження на 13 000 дорослих чоловіків та жінок також показало позитивну зв'язок між відсотком жиру в організмі та остеопенією (Pollock et al. 2007). У дослідженнях на тваринах ожиріні миші з ожирінням з високим вмістом жиру продемонстрували порушення мікроархітектури та механічних властивостей кісток, а також посилену резорбцію кісток та формування остеокластів (Halade et al. 2010; Halade et al. 2011; Patsch et al. 2011). Хоча було запропоновано кілька потенційних механізмів, пов’язаних із стимуляцією остеокластогенезу, пов’язаною з ожирінням, включаючи накопичене, пов’язане з адипоцитами, запалення низького ступеня (Halade et al. 2011) та зміни гормонів, отриманих з жирової тканини (Ducy et al. 2000; Wang et 2014), точні механізми, що лежать в основі асоціації ожиріння та кісток, досі недостатньо добре з’ясовані.
Враховуючи залученість ожиріння, спричиненого дієтою, до метаболізму кісткової тканини, ми постулювали, що дієта з високим вмістом жиру може певною мірою змінити відхилення, пов’язані з індукованим дефіцитом IL-6 фенотипом кісток. Щоб підтвердити цю спекуляцію, ми провели гістологічне дослідження на гомілках мишей-нокаутів IL-6, які харчувались дієтою з високим вмістом жиру або звичайною дієтою.
Матеріали та методи
Тварини та дієти
Фарбування H&E та гістоморфометрія кісток
Фарбування H&E проводили для дослідження морфології метафізів у мишей серед чотирьох груп. Спостерігали забруднені зрізи та робили цифрові зображення за допомогою світлового мікроскопа (Olympus BX-53; Токіо, Японія). Для вимірювання гістоморфометричних параметрів кісток використовували програмне забезпечення Image-Pro Plus (версія 6.2; Media Cybernetics, Rockville, MD), включаючи об'єм трабекулярної кістки (BV/TV, об'єм кістки/об'єм тканини × 100%), трабекулярний номер (Tb.N), трабекулярна товщина (Tb.Th) і трабекулярна сепарація (Tb.Sp). Вісім зрізів для кожної проби використовували для кількісного гістоморфометричного аналізу для отримання середнього значення.
Видимі адипоцити (діаметром> 30 мкм) також підраховували в межах трабекулярної області (тобто від пластини зростання до 2 мм дистально) за допомогою світлового мікроскопа (Olympus BX-53).
Імуногістохімія для лужної фосфатази, остеокальцину, катепсину К та тартрат-стійкої кислотної фосфатази
Аналіз апоптозу клітин
Апоптоз клітин визначали за допомогою методу термінального дезоксинуклеотидилтрансферази, опосередкованого дезоксиуридин трифосфатним міткою (TUNEL), використовуючи TACS 2TdT-Blue Label In Situ Apoptosis Detection Kit (Trevigen Inc .; Gaithersburg, MD). Зневірені зрізи інкубували з 1% протеїназою К (Trevigen Inc.), розведеною 1: 200 при 37 ° С протягом 15 хв, з подальшим інгібуванням ендогенних пероксидаз при кімнатній температурі протягом 5 хв. Після обробки ферментом TdT у розведенні 1:50 при 37 ° C протягом 1 години зрізи інкубували з кон'югованим HRP стрептавідином при кімнатній температурі протягом 15 хв. Реакцію робили видимою за допомогою розчину синьої етикетки, наданого в наборі. Апоптотичні остеокласти були визначені як позитивні як TUNEL, так і TRAP в одному і тому ж полі зору на серійних зрізах.
Статистичний аналіз
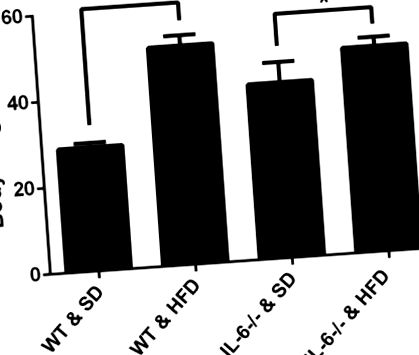
Параметри структури кісток та інтегровану оптичну щільність ALP, OCN та CK, а також кількість остеокластів/поля оцінювали за допомогою програмного забезпечення Image-Pro Plus. Всі значення представлені як середнє значення ± стандартне відхилення. Односторонній ANOVA використовували для порівняння кількох груп, а середнє значення кожної групи порівнювали за допомогою тесту Стьюдента-Ньюмена-Кілса (SNK). p -/- миші, що харчуються SD та HFD, p рис. 1). Для підтвердження впливу HFD на адипогенез в мікросередовищі кісткового мозку оцінювали ожиріння кісткового мозку за допомогою фарбування H&E. На SD миші не продемонстрували суттєвих відмінностей у кількості або розмірі адипоцитів між мишами IL-6 -/- та WT (рис. 2А, 2С 2С та та 2Е). 2E). На HFD кількість і розмір адипоцитів були значно збільшені порівняно з відповідними контрольними мишами, які годували SD (рис. 2B, 2D 2D та and2E). 2E). Це вказує на те, що HFD посилює адипогенез в мікросередовищі кісткового мозку.
TUNEL-аналіз остеокластів на зрізах великогомілкової кістки та статистичний аналіз. (A, C, E, G) Розподіл TRAP-позитивних багатоядерних клітин, розташованих на межі трабекулярної кістки у мишей (A) WT & SD, (C) WT & HFD, (E) IL-6 -/- & Групи SD, (G) IL-6 -/- & HFD. (B, D, F, H) Аналіз TUNEL, що вказує на апоптотичні тіла (синій) в тих самих зонах для (B) WT & SD, (D) WT & HFD, (F) IL-6 -/- & SD, (H ) IL-6 -/- & HFD групи. Стрілки вказують апоптотичні остеокласти, виявлені при порівнянні серійних зрізів. (I) Статистичний аналіз кількості остеокластів (апоптотичних) як функції загальної кількості остеокластів. Дані є середнім значенням ± SD; ** p -/- миші демонстрували аномальну мікроструктуру кісток у гомілках, включаючи уповільнений розвиток великогомілкового метафізу та наявність більш рясної, товщі, але незрілої трабекулярної кістки, що, можливо, було спричинено зниженою регуляцією активності остеокластів та збільшення рівня апоптозу (Liu et al. 2014). У цьому дослідженні ожиріння, спричинене HFD, було встановлено у мишей IL-6 -/- для вивчення впливу тривалого споживання HFD на аномальну мікроструктуру кістки, спричинену дефіцитом IL-6. На додаток до помітно збільшеного приросту маси тіла, годування HFD нормалізувало кістковий фенотип мишей IL-6 -/- до рівня контролю WT, що характеризується потовщеною корковою кісткою та косо розташованою пластинчастою трабекулярною кісткою. Зокрема, значно ослаблена активність резорбції кісток та здатність виживання остеокластів у мишей IL-6 -/- були відновлені шляхом годування HFD, що може пояснювати більшу ступінь відновлення аномальної мікроструктури кістки.
У нашому попередньому дослідженні миші з дефіцитом IL-6 мали значно посилений остеобластогенез та формування кісток, оскільки IL-6 пригнічує диференціювання остеобластів (Franchimont et al., 2005) і було показано, що він зменшує експресію маркерів диференціації в остеобластах (Yang et al. . 2007). У цьому дослідженні імуногістохімічне фарбування маркерів остеогенезу показало, що експресія двох критичних маркерів диференціації остеобластів, ALP та OCN, ослаблена після годування HFD порівняно з однолітками, які годували SD. Це особливо стосувалося груп IL-6 -/-, в яких інтенсивність фарбування для обох остеогенних маркерів була знижена до інтенсивності групи WT & SD, що вказує на пригнічення утворення кісток при ожирінні, спричиненому HFD. Добре відомо, що адипоцити та остеобласти походять від загальної мультипотентної мезенхімальної стовбурової клітини, і що ожиріння може посилити адипогенез, одночасно зменшуючи остеобластогенез (Rosen and Bouxsein 2006). Однак наші результати продемонстрували, що кісткова маса була збільшена у мишей із ВТ, які отримували HFD, і цей результат не відображав порушень остеогенної здатності, спричинених перебільшеним адипогенезом. Цю невідповідність можна пояснити тим фактом, що підвищена маса тіла, пов’язана з ожирінням, може протидіяти згубному впливу ожиріння на метаболізм кісток, оскільки, як повідомляється, маса тіла або індекс маси тіла (ІМТ) позитивно корелюють з кістковою масою (Felson et al. 1993; Reid 2002) та низька маса тіла або ІМТ можуть бути фактором ризику низької кісткової маси у людей (Ravn et al. 1999).
Що стосується остеокластогенезу, то фарбування TRAP не показало значної зміни кількості остеокластів у групах ЗТ, що відрізняється від результатів кількох інших досліджень, що відкладення жиру в мікросередовищі кісткового мозку стимулює формування остеокластів та резорбцію кісток (Cao et al. 2010; Халаде та ін., 2011). Ця невідповідність може бути спричинена різницею у досліджуваних тварин щодо віку, рівня жиру в раціоні та часу або тривалості годування HFD. Цікаво, що підвищений остеокластогенез для мишей у групі IL-6 -/- & SD (про що свідчить збільшена кількість TRAP-позитивних остеокластів) був значно знижений після HFD. Це явище може бути пов'язане з пригніченим остеобластогенезом мишей IL-6 -/- HFD, який послаблює остеокластогенез шляхом шляху RANKL/RANK/OPG (Lacey et al. 1998; Yasuda et al. 1998).
На закінчення, наші результати показують, що індуковані дефіцитом IL-6 аномалії мікроструктури кісток частково змінюються шляхом тривалого споживання HFD. Ця реабілітація кісткового метаболізму може бути досягнута шляхом індукованого HFD придушення остеобластогенезу, підвищення регуляції остеокластичної активності, а також пригнічення апоптозу остеокластів (рис. 8). Потрібні подальші дослідження, щоб зосередити увагу на механізмі синаптичного ефекту дефіциту IL-6 у поєднанні з HFD на змінений метаболізм кісток.
Схематична модель, що показує роль ожиріння, спричиненого HFD, та нокауту IL-6 у реконструкції кісток миші. Дефіцит IL-6 посилює формування кісток, сприяючи остеобластогенезу та пригнічуючи резорбцію кісток шляхом пригнічення остеокластичної здатності та життєздатності. У цьому процесі збільшення остеокластогенезу, пов’язане з посиленим остеобластогенезом через шлях RANKL/OPG, не може компенсувати знижену резорбцію кісток, що є наслідком зниження активності остеокластів; це разом призводить до аномалій кісткової тканини, що спостерігаються у мишей IL-6 -/-. Індуковане HFD ожиріння відновлює зміни, що виникають у відповідь на дефіцит IL-6, шляхом пригнічення остеобластогенезу та збільшення дії остеокластів, таких як остеокластична резорбтивна здатність та покращена життєздатність клітин. Ці зміни протидіють ефектам дефіциту IL-6 і тим самим призводять до появи відносно нормального фенотипу в мікроструктурі великогомілкової кістки у мишей IL-6 -/-.
Виноски
Заява про внесок автора: WF та BL для збору даних та складання статті; YM та KO для тварин та підтримка антитіл; TH для обробки зразків; JC та DL для перегляду статті; WW та XH для статистичного аналізу; НС для зачаття; ML для дизайну та огляду рукопису.
Конкуруючі інтереси: Автори не заявили про потенційні конкуруючі інтереси щодо досліджень, авторства та/або публікації цієї статті.
Фінансування: Автори розкрили отримання наступної фінансової підтримки для дослідження, авторства та/або публікації цієї статті: Це дослідження було частково підтримано Національним фондом природознавства Китаю (грант № 81271965; 81470719; 81311140173) та Спеціалізованим фондом досліджень для докторської програми вищої освіти (грант № 20120131110073) для Li M.
- Запалення необхідне для довготривалої, але не короткочасної індукованої інсулінорезистентності з високим вмістом жиру
- Тривале споживання дієти з високим вмістом жиру погіршує рухову координацію, не впливаючи на загальне
- Поліпшіть свій раціон для кращого здоров’я кісток і суглобів - Bon Secours InMotion
- Інтерлейкін-4 покращує метаболічні відхилення у дієтичних мишей з дефіцитом лептину та високим вмістом жиру
- Довгострокові наслідки дієти з дуже низьким вмістом вуглеводів та дієти з низьким вмістом жиру на настрій та когнітивні функції