Дослідження ферментів, асоційованих з ЛПВЩ, при експериментальній гіперхолестеринемії: можлива модуляція добавок селену
Харман Д Каур
1 Кафедра біофізики Університету Панджаба, Чандігарх 160014, Індія
Мохінджер П Бансал
1 Кафедра біофізики Університету Панджаба, Чандігарх 160014, Індія
Анотація
Передумови
Атеросклероз - це хронічний розлад артеріальної стінки, який починається з утворення жирових прожилок і поступово переростає в атеросклеротичні бляшки. Рівень ліпопротеїдів високої щільності (ЛПВЩ) у зворотному кореляції з атеросклерозом. Цей сприятливий ефект ЛПВП частково пояснюється його антиоксидантними властивостями, опосередкованими параоксоназою1 (PON1) або фактором активації тромбоцитів ацетилгідролазою (PAF-AH). Це дослідження було спрямоване на вивчення асоційованих з ЛПВЩ ферментів, тобто PON1 та PAF-AH в умовах експериментальної гіперхолестеринемії та їх можливу модуляцію на добавки селену (Se; антиоксидант). Самців щурів Sprague Dawley розділили на три групи і годували контрольною дієтою, дієтою з високим вмістом жиру (HFD) та HFD + Se відповідно протягом 4 місяців.
Результати
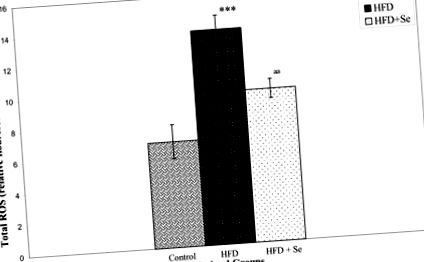
Рівень холестерину, тригліцеридів, ЛПВЩ та ЛПНЩ значно підвищувався під час годування HFD. Добавки селену знижували рівень тригліцеридів, тоді як інші показники ліпідів залишались незмінними. Рівень селену в сироватці крові знизився на 31%, а рівень АФК у печінці в 2 рази збільшився за рахунок HFD. Проте добавки Se зменшили рівень АФК, спричинений HFD, на 29%. Крім того, Se також покращив опосередковане HFD зниження активності ферменту PON1 у сироватці крові на 34% та рівня білка PON1 на 21%. Однак не було виявлено суттєвого впливу Se на знижений рівень білків PAF-AH у щурів, яких годували HFD. Експресія мРНК PON1 та PAF-AH у печінці не впливала на групи, які отримували Se.
Висновок
Se добавки, як видається, є захисними при гіперхолестеринемії шляхом відновлення антиоксидантних властивостей ферменту, пов'язаного з ЛПВЩ, тобто PON1, тоді як біологічна система спрямована на підтримання однакових рівнів PAF-AH навіть при добавці селену, що вказує на його ймовірну роль як в анти-та атерогенній діяльності. Отже, добавки Se можуть бути цінним підходом для обмеження несприятливих наслідків гіперхолестеринемії і можуть потребувати подальших досліджень.
Передумови
Гіперхолестеринемія є одним із важливих та визнаних факторів ризику розвитку атеросклерозу [1]. Існують переконливі докази, що вказують на важливість типу жирів, ніж загальна кількість жирів, щодо ризику серцево-судинних захворювань [2]. Холестерин транспортується всередині ліпопротеїдів у крові. Рівні холестерину ліпопротеїнів високої щільності (ЛПВЩ) зворотно пов'язані з ризиком розвитку атеросклеротичних явищ [3] і виявлено, що вони мають антиатерогенну активність [4]. Серед факторів ризику співвідношення загального холестерину/холестерину ЛПВЩ вважається найбільш прогнозуючим для атеросклерозу [5]. Захисна дія ЛПВЩ частково пов'язана з ферментами, пов'язаними з ЛПВЩ [6-8], і завдяки його участі в зворотному транспорті холестерину [9].
Параоксоназа1 (PON1) - один із ферментів, асоційованих з ЛПВЩ [10]. Показано, що PON1 захищає від окисного стресу [11,12], явища, яке можна пояснити його здатністю модулювати окислені ліпіди в ЛПНЩ та ЛПВЩ [13,14], в макрофагах [15,16], а також в атеросклеротичних бляшках [ 17]. PON здатний гідролізувати пероксиди ліпідів у ЛПНЩ [18]. PONL, асоційований з ЛПВЩ, зменшує окислювальний стрес у ліпопротеїнах, у макрофагах та при атеросклеротичному ураженні, тоді як PON2 діє як антиоксидант на клітинному, а не гуморальному рівні. Послаблення атеросклерозу пов'язане з індукованим харчовими антиоксидантами підвищенням активності HDL-PON [19].
PAF-AH є основним ферментом, відповідальним за катаболізм PAF і PAF, як ліпіди, які також є потужними медіаторами запалення [20,21]. Генетичний дефіцит PAF-AH у визначених популяціях людей збільшує тяжкість атеросклерозу та інших синдромів [22]. PAF-AH відмітив перевагу до фосфоліпідів з коротколанцюговими фрагментами в положенні syn-2, і, за винятком PAF, він може однаково гідролізувати окислені фосфоліпіди, що містять у положенні syn-2 поліненасичені жирні залишки ацилу [23]. Однак під час гідролізу окислені фосфоліпіди PAF-AH вивільняють біоактивні окислені вільні жирні кислоти [24] та генерує лізофопсфатидилхолін, обидва з яких беруть участь у біологічній дії ox-LDL [25]. Таким чином, PAF-AH може грати як проатерогенну, так і антиатерогенну роль.
Селен, важливий мікроелемент, з роками пов’язаний із серцево-судинними захворюваннями. Дефіцит селену пов’язаний із підвищенням рівня холестерину в плазмі крові [26,27], серцевою міопатією [28], іншими серцево-судинними захворюваннями та ішемічними захворюваннями серця [29,30]. Добавки селену призводять до зниження загального рівня холестерину та тригліцеридів [31,32].
З огляду на це, у цьому дослідженні досліджено вплив селену на ферменти, пов’язані з ЛПВЩ, PON1 та PAF-AH.
Результати
Рівні селену
A - експресія мРНК PON1 та PAF-AH методом RT-PCR. B - Денситометричний аналіз експресії мРНК PON1 та PAF-AH. Дані представлені як Середнє ± S.D. з чотирьох незалежних спостережень. Дані статистично аналізуються за допомогою t-критерію студента.
Експресія білка PON1 та PAF-AH методом ІФА
Таблиця 2
Рівні PON1 та PAF-AH методом ІФА після 4 місяців контролю, HFD та HFD + Se
| PON1 | 1,55 ± 0,13 | 1,06 ± 0,01 ** | 1,28 ± 0,12 а |
| PAF-AH | 0,26 ± 0,01 | 0,25 ± 0,01 * | 0,26 ± 0,01 |
Таблиця 3
Склад контрольної дієти та дієти з високим вмістом жиру (HFD):
| Кукурудзяний крохмаль | 71,0 | 61,5 |
| Казеїн | 16,0 | 16,0 |
| Арахісова олія | 8,0 | 0,0 |
| Кокосове масло | 0,0 | 15,0 |
| Холестерин | 0,0 | 2.0 |
| Холат натрію | 0,0 | 0,5 |
| Соляна суміш | 4.0 | 4.0 |
| Вітамінна суміш | 1.0 | 1.0 |
| Перхлорат калію | 0,0 | 25 мг/100 г Б.В./рат/24 год |
Тваринам III групи, тобто групі HFD + Se, давали 1 ppm селену у вигляді селеніту натрію і вводили разом з дієтою з високим вмістом жиру. Селен був обраний таким чином, що його рівень перевищує адекватні рівні селену (0,2 ppm), але значно нижче границь субтоксичності (2,0 ppm).
Рівні селену
Рівні селену оцінювали у сироватці крові флуориметричним методом [60]. Аналіз заснований на принципі, згідно з яким вміст Se у зразках при перетравленні кислоти перетворюється на селенову кислоту. Реакція між селеновою кислотою та ароматичними-о-діамінами, такими як 2,3-діамінонапатален, призводить до утворення 4,5-бензопіазселенолу, який проявляє блискучу вапняно-зелену флуоресценцію при збудженні при 366 нм у циклогексані. Випромінювання флуоресценції в екстракті циклогексану зчитували на флуоресцентному спектрофотометрі з використанням 366 нм як збудження та 520 нм як довжини хвилі випромінювання.
Ліпідний профіль
Аналіз ліпідного профілю проводили у сироватці крові за допомогою колориметричних наборів для оцінки загального рівня холестерину, тригліцеридів, ЛПВЩ, ЛПНЩ. Загальний рівень холестерину оцінювали за допомогою набору на основі CHOP-PAP (Human Diagnostic Germany). Рівні тригліцеридів оцінювали за допомогою набору на основі GPO (Accurex Biomedical India). Рівні холестерину ЛПВЩ та ЛПНЩ оцінювали за допомогою ферментативного набору (Fortress direct kit).
Рівні активних форм кисню (АФК)
Визначення АФК базувалося на модифікованому методі Driver et al [61]. Гомогенати печінки готували в крижаному буфері Локка (154 мМ NaCl, 5,6 мМ KCl, 3,6 мМ NaHCO3, 2 мМ CaCl2, 10 мМ г-глюкози та 5 мМ HEPES pH 7,4). Гомогенатам давали нагрітися при 21 ° С протягом 5 хв. Реакційну суміш, що містить 10 мкМ DCFH-DA та 5 мг тканини/мл, інкубували протягом 15 хв при кімнатній температурі (21 ° C). Після ще 30 хв інкубації вимірювали перетворення DCFH у флуоресцентний продукт 2, 7 дихлорфлоурецеїну (DCF) за допомогою флуоресцентного спектрофотометра з збудженням при 485 нм та випромінюванням при 530 нм. Фонову флуоресценцію (перетворення DCFH-DH у DCF у відсутності гомогенату) коригували включенням паралельних заготовок. Відносну інтенсивність флуоресценції приймали за міру кількості АФК у різних групах.
Вимірювання активності PON1
Активність PON1 оцінювали в сироватці крові шляхом вимірювання початкової швидкості гідролізу параоксону з отриманням п-нітрофенолу при 412 нм при 25 ° C. Базальна аналітична суміш включала 2 мМ параоксону, 2 мМ CaCl2 та 0,5 мл сироватки у 100 мМ трис/Cl буфері. Коефіцієнт екстинкції для реакції становить 18290 М -1 см -1. Активність виражається у мкМ параоксону, гідролізованого/мг білка/хв [62].
Виділення РНК та експресія мРНК PON1 та PAF-AH за допомогою RT-PCR
Загальну РНК виділяли зі свіжої печінки за допомогою триреагенту (Молекулярний дослідницький центр, штат Огайо, США), а якість виділеної РНК перевіряли на 1,2% агарозному гелевому електрофорезі. Для ланцюгової реакції зворотної транскриптази (RT-PCR) за допомогою програмного забезпечення були розроблені праймери для PON1, PAF-AH, а β-актиновий праймер взято з літератури. Послідовність праймерів для PON1 була Fav- 5'-TGGCATTGGCATTTCCCTTG-3 ', Rev- 5'-CAGTAGCTTTCACTCCGGTAA-3', а для PAF-AH Fav-5'-CTGATGACAAGACCCTCCGTG-3 ', Rev-5'-CCGTG-CCGTG для β-актину Fav- 5'-AGAGCTATGAGCTGCCTGAC-3 ', Rev-3'-CTGCATCCTGTCAGCCTACG-5'. Після експериментальних експериментів було встановлено, що продукти ПЛР для PON1, PAF-AH поступово ампліфікувались до 35 циклів, а отже було проведено 35 циклів ампліфікації. У реакції RT-PCR (набір Qiagen) використовували матричну кДНК з подальшою ампліфікацією ПЛР за допомогою ДНК-полімерази Accu Taq у тій самій пробірці. Продукти ПЛР аналізували за допомогою 1,5% електрофорезу в агарозному гелі. Денситометричний аналіз за шістьма незалежними спостереженнями був зроблений за допомогою програмного забезпечення Image-J.
Експресія білка PON1 та PAF-AH методом ІФА
Колодязі покривали 5 мкг зразка для PON1 і PAF-AH в 100 мкл 0,05 М карбонатного буфера (рН 9,6) і витримували протягом ночі при 4 ° С у вологій камері. Планшети натискали, щоб видалити незв'язаний розчин антигену, і лунки блокували 1% BSA в 0,1 М сольовому розчині фосфатного буфера (pH 7,2) протягом 1 години при 37 ° C. Планшети збивали і лунки промивали 200 мкл PBS, що містить 0,05% (об/об) Твін-20. Потім лунки інкубували з анти-PON1 та анти-PAF-AH відповідно, розбавляли у PBS (що містить 0,05% Твін та 1% BSA) та витримували протягом 2 годин при 37 ° C. Пластини знову промивали і інкубували з вторинним антитілом проти козла (міченою пероксидазою) для PON1 (1: 1000) і PAF-AH (1: 1000) протягом 2 годин при 37 ° C. Лунки промивали ще тричі тричі, як описано вище, і забарвлення розробляли додаванням реагенту 2, 2'-азіно-ді (3-етил) -бензотіозолінсульфонової кислоти та поглинання при 405 нм вимірювали за допомогою ІФА.
Статистичний аналіз
Дані представлені як середнє значення ± S.D. Статистичний аналіз даних проводили за допомогою Т-критерію студента.
Скорочення
A260: поглинання при 260 нм; A412: поглинання при 412 нм; B.W: вага тіла; LCAT: лецитин холестерин ацилтрансфераза; ЛПНЩ: ліпопротеїди низької щільності; OD: оптична щільність; oxLDL: окислений ліпопротеїн низької щільності; PAF: фактор активації тромбоцитів; PAF-AH: фактор-ацетилгідролаза, що активує тромбоцити; PON1: Параоксоназа1; Se: селен; SRB1: рецептор поглинача В (клас) 1 (тип); ЛПОНЩ: ліпопротеїни дуже низької щільності.
Конкуруючі інтереси
Автори заявляють, що у них немає конкуруючих інтересів.
Внески авторів
MPB розробляв дослідження та брав участь у складанні рукописів та аналізі результатів. HDK проводив усі експериментальні роботи, брав участь у статистичному аналізі та складанні рукописів під керівництвом MPB. Усі автори прочитали та схвалили остаточний рукопис.
Подяки
Автори визнають підтримку, яку надав директор: професор Тапас Мухопадхяй (кафедра геноміки людини, Університет Панджаб, Чандігарх, 160014, Індія) щодо використання різного обладнання.
- Підвищення рівня лейцину в плазмі, пов'язане з ожирінням, пов'язане зі змінами ферментів, що беруть участь у
- Фактори ризику, пов'язані з надмірною вагою собак та ожирінням, в опитуванні, проведеному власником bioRxiv
- Пропуск сніданку, пов’язаний із загартовуванням артерій - Американський коледж кардіологів
- Ожиріння та наслідки асоційованої хірургії перианального свища Крона
- Білок тирозин фосфатази 1В є новою мішенню для лікування ожиріння та пов'язаних з цим