Доля стійкого до метициліну Золотистий стафілокок (MRSA) в модельованих кислих умовах шлунку людини
Департамент науки про сільське господарство, продовольство та навколишнє середовище (SAFE), Університет Фоджа, Фоджа, Італія
Науково-дослідний інститут харчових наук, CIAL (CSIC ‐ UAM), Мадрид, Іспанія
Експериментальний зоопрофілактичний інститут Апулії та Базилікати, Матера, Італія
Експериментальний зоопрофілактичний інститут Апулії та Базилікати, Путіньяно, Італія
Експериментальний зоопрофілактичний інститут Апулії та Базилікати, Путіньяно, Італія
Експериментальний зоопрофілактичний інститут Апулії та Базилікати, Матера, Італія
Департамент науки про сільське господарство, продовольство та навколишнє середовище (SAFE), Університет Фоджія, Фоджа, Італія
Листування
Джованні Норманно, Департамент науки про сільське господарство, продовольство та навколишнє середовище (SAFE), Via Napoli 25, Університет Фоджі, 71121, Фоджа, Італія.
Департамент науки про сільське господарство, продовольство та навколишнє середовище (SAFE), Університет Фоджія, Фоджа, Італія
Науково-дослідний інститут харчових наук, CIAL (CSIC ‐ UAM), Мадрид, Іспанія
Експериментальний зоопрофілактичний інститут Апулії та Базилікати, Матера, Італія
Експериментальний зоопрофілактичний інститут Апулії та Базилікати, Путіньяно, Італія
Експериментальний зоопрофілактичний інститут Апулії та Базилікати, Путіньяно, Італія
Експериментальний зоопрофілактичний інститут Апулії та Базилікати, Матера, Італія
Департамент науки про сільське господарство, продовольство та навколишнє середовище (SAFE), Університет Фоджія, Фоджа, Італія
Листування
Джованні Норманно, Департамент науки про сільське господарство, продовольство та навколишнє середовище (SAFE), Via Napoli 25, Університет Фоджі, 71121, Фоджа, Італія.
Анотація
Відома кількість (10 7 кОЕ/мл) тваринного походження, стійкого до метициліну Золотистий стафілокок (MRSA) ST398/t011/V та людського походження MRSA ST1/t127/IVa штами були окремо посіяні в рикотта зразки сиру та гамбургера. РН кожної харчової матриці поступово знижувався з 6,0 до 2,0 протягом приблизно 2 годин в умовах, що імітують механічне перетравлення шлунка людини. Потім штами MRSA відновлювали за допомогою специфічного для MRSA середовища для покриття. Хоча обидва штами демонстрували певну кислотну стійкість, вони демонстрували різну реакцію при низьких значеннях рН під час експерименту: ST398 вижив неушкодженим під час експериментів до останньої стадії при рН 2, де кількість гамбургера становить 6,4 КОЕ/г, і 7,5 log КОЕ/г для рикотта були отримані аналізи на сир. На відміну від цього, популяція ST1 вже не була виявлена при pH 3 у гамбургері та при pH 2 у рикотта сирні проби. Наскільки нам відомо, це перше дослідження, яке досліджує здатність MRSA долати кислі умови шлунку людини, і додає нові докази, які можуть сприяти розширенню наукових знань про значення MRSA у дебатах про безпеку харчових продуктів.
Основні моменти
- Дослідження вперше описує долю людини та тварин MRSA, інокульованих у різні харчові матриці, в змодельованих кислих умовах шлунку людини.
- Дослідження містить інформацію про виживання MRSA в кислих умовах шлунку людини, що може бути корисним для цілей безпеки харчових продуктів.
- Два штами MRSA, використані в цьому дослідженні, демонструють різну поведінку в експериментальних умовах.
1. ВСТУП
Широко визнано, що нормальна кислотність шлунка може забезпечити важливий захист господаря від проковтнутих патогенних мікроорганізмів, вбиваючи ці мікроорганізми, як це було раніше продемонстровано для кількох грамнегативних бацил та вегетативних клітин Clostridium difficile, Mycobacterium avium, а також для внутрішньолікарняних збудників, таких як Candida albicans, Метицилін стійкий Золотистий стафілокок (MRSA), стійкий до ванкоміцину Ентерокок spp. (VRE) та продукує розширений спектр β-лактамази Enterobacteriaceae (Bodmer, Miltner, & Bermudez, 2000; Donskey, 2004; Rao, Jump, Pultz, Pultz, & Donskey, 2006).
Ряд досліджень вивчав адаптаційні реакції S. aureus піддаються кислотному стресу у ферментованих продуктах харчування (Bore, Langsrud, Langsrud, Rode, & Holck, 2007; Rode et al., 2010). Однак мало відомостей про здатність кислих станів шлунку людини знищувати поглинаний MRSA. Метою цього дослідження було оцінити виживання двох штамів MRSA, що входять до складу двох харчових продуктів тваринного походження, що піддаються впливу середовища шлунку людини, шляхом моделювання стану шлункової кислоти та її механічного перетравлення.
2 МАТЕРІАЛ І МЕТОДИ
2.1 Приготування стійкого до метициліну S. aureus (MRSA) посівний матеріал
Штам MRSA ST398/t011/V, попередньо виділений із сирого коров’ячого молока, та штам MRSA ST1/t127/IVa, раніше виділений із мазків з носа людини (Parisi et al., 2016), індивідуально суспендували в 5 мл відвару BHI (попередній посівний матеріал) та інкубували при 37 ° C протягом 24 годин. Культуру MRSA для кожного штаму готували шляхом ресуспендування для кожного 20 мкл попереднього посіву в 5 мл свіжого відвару BHI, інкубували при 37 ° C протягом 24 годин. Концентрація MRSA кожного посівного матеріалу, який використовувався в модельованому експерименті з кислотністю шлунка, становила 5 мл × 10 7 кОЕ/мл відповідно до стандарту Макфарленда.
2.2 Приготування харчових матриць
Живильне середовище готували, як описано раніше Баррозу, Куевою, Пелаесом, Мартінес-Куестою та Рекеною (2015). Середовище містило арабіногалактан (1 г/л), пектин з яблука (2 г/л), ксилан (1 г/л), картопляний крохмаль (3 г/л), глюкозу (0,4 г/л), дріжджовий екстракт (3 г/л), пептон (1 г/л), муцин (4 г/л) та L-цистеїн (0,5 г/л). Після розчинення порошків суміш потім автоклавували, і рН регулювали до досягнення значення 6,5.
Дві їжі тваринного походження, рикотта сир та гамбургер, були використані в експериментах. Щоб виключити упередженість результатів, кожна харчова матриця була перевірена перед експериментом на наявність S. aureus та MRSA з використанням протоколу, описаного Parisi et al. (2016).
Для приготування експериментальної суспензії (ES), використаної в цьому дослідженні, п'ятдесят грамів кожної харчової матриці окремо додавали до 50 мл живильного середовища при температурі 37 ° C і гомогенізували протягом 10 хв при 230 об/хв, використовуючи шматочок при кімнатній температурі. Нарешті, 5 мл кожного посіву MRSA додавали (5% від обсягу) до кожного з двох підготовлених ES.
2.3 Експеримент з кислотністю шлунка
Модельований шлунково-кислий експеримент проводили, як описано Haffner, van de Wiele та Pasc (2017) з невеликими змінами. Коротко кажучи, рН зразків поступово знижувався протягом приблизно 2 годин і періодично гомогенізувався за допомогою штампу, що імітував механічне перетравлення шлунка (Haffner et al., 2017; Maisanaba et al., 2018). Докладніше, після інокуляції MRSA в кожну підготовлену ES та її першої гомогенізації (230 об/хв протягом 10 хв) у мішок Stomacher, рН рикотта сиру та гамбургера (стабілізованого при рН 6,0, починаючи з рН 6,5 та рН 5,8 відповідно) зменшували з кроком від 6,0 (Т0) до 2,0 (Т4), додаючи певну кількість 1 М HCl (від 0,5 до 19 мл). Кожну пробу струшували протягом 2 хв при кімнатній температурі та інкубували при 37 ° С протягом 15 хв у кожній точці експерименту (T1-T3), за винятком останньої (T4), коли їх інкубували протягом 30 хв при 37 ° C, як пропонують Haffner et al. (2017). Для кожного харчового експерименту в якості контролю використовували 50 мл живильного середовища, інокульованого кожним штамом MRSA. Кожен контроль мав такий самий початковий рН, як його еквівалент харчової матриці, і їх обох обробляли у вищезазначених умовах. Кожен експеримент проводився двічі.
2.4 Кількість MRSA
Відповідні серійні розведення в пептоновій воді кожного зразка під час кожного відбору проб, від Т0 (час посіву) до Т4 (рН 2), висівали на планшети MRSA-SELECT ® (BioRad) та інкубували при 37 ° С протягом 24 годин. Для оцінки варіації кислотної стійкості кожного штаму MRSA протягом експерименту, на кожному етапі зниження значень рН (від T0 до T4) як у матрицях, так і в контролі, коефіцієнт варіації (CV%) було використано.
2.5 Загальна кількість бактерій (TBC)
Для оцінки ефективності процедури оцінювали вплив підкислення на загальну кількість бактерій обох харчових матриць, що використовувались у дослідженні. Детально, загальну кількість бактеріальних колоній (ТБК) проводили на обох неінокульованих рикотта сир та гамбургер у трьох різних точках під час експерименту: при Т0 (рН 6), при Т2 (рН 4), при Т4 (рН 2) з використанням пластинчатого агару (мікробіол) згідно протоколу, зазначеного в ISO 4833– 1: 2013 .
3 РЕЗУЛЬТАТИ
3.1 Підрахунок MRSA
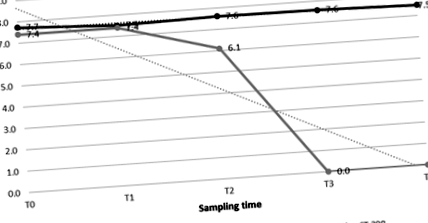
Підрахунок MRSA обох штамів продемонстрував зменшення протягом експериментів, як повідомляється в таблиці 1 та на малюнках 1, 2 та 3. Два штами MRSA показали різні варіації кислотної стійкості при заданому значенні pH. Докладніше, в контролях та в обох матрицях зміна кислотної стійкості ST398 відповідала коефіцієнту варіації під коефіцієнтом 10, тоді як для ST1 вона перевищувала коефіцієнт 10 2 .
| Т0 | 6 | 7.7 | 0,1 | 7.4 | 0,4 | 7.9 | 0,4 | 7.9 | 0,3 | 7.5 | 0,4 | 7.5 | 0,3 |
| Т1 | 5 | 7.5 | 0,8 | 7.4 | 0,1 | 7.7 | 0,5 | 7.5 | 0,3 | 7.2 | 0,9 | 6.3 | 0,3 |
| Т2 | 4 | 7.6 | 0,2 | 6.1 | 0,3 | 7.8 | 0,3 | 7.4 | 0,2 | 7.2 | 0,4 | 6.7 | 0,4 |
| Т3 | 3 | 7.6 | 0,1 | 0,0 | 0,0 | 7.8 | 0,2 | 7.6 | 0,1 | 6.9 | 0,2 | 0,0 | 0,0 |
| Т4 | 2 | 7.5 | 0,3 | 0,0 | 0,0 | 7.6 | 0,2 | 0,0 | 0,0 | 6.5 | 0,0 | 0,0 | 0,0 |
- R = діапазон (варіація) між двома повтореннями кожного аналізу.
Поріг виживання обох штамів був вищим у рикотта сиру, ніж у гамбургер (малюнки 1, 2 та 3). Кількість log 7,5 та 7,6 cfu/г ST398 все ще отримували при Т4 (рН 2) у контролі та в рикотта сиру відповідно. Найбільш значне зниження ST398 було зафіксовано при T3 (pH 3) в експерименті з гамбургерами, в якому ми зафіксували на один log cfu/g менше, ніж його концентрація при початковому pH (T0; pH 6.0) (Таблиця 1). Подібним чином штам ST1 в рикотта сир можна було виявити з незначним зниженням протягом експерименту до Т3 (рН 3), коли кількість одиниць 7,6 КОЕ/г все ще була отримана. Після цього його вже не можна було виявити (Т4; рН 2,0). На відміну від цього, у гамбургерах спостерігалося значне зниження, при кількості log 6,5 cfu/g, при Т2 (рН 4), після чого його вже не було виявлено (Таблиця 1).
3.2 Загальна кількість бактерій
загальна кількість бактерій показала зменшення протягом експерименту. Детальніше, при Т0 загальна кількість бактерій у рикотта сиру та експерименту з гамбургерами, коливалися між log 7,4 та 7,0 cfu/g відповідно. При T2 (pH 4) загальна кількість бактерій в обох матрицях зберігала однакові значення зі збільшенням світла для рикотта сиру (log 7,6 cfu/g) та незначне зниження для гамбургера (log 6,9 cfu/g). При Т4 (рН 2) загальний вміст бактерій більше не можна було виявити ні в одній з матриць.
4 ОБГОВОРЕННЯ
Золотистий стафілокок та його стійкий до метициліну варіант (MRSA) - це мікроорганізми, які мають великий вплив як на людину, так і на ветеринарію (ВООЗ, 2014). Помітна пристосованість до стафілококів та його коеволюція з господарем (ими) дозволяють йому бути успішним як умовно-патогенний мікроген та бути стійким до змін середовища (Clements & Foster, 1998). S. aureus також є одним з основних збудників харчових продуктів, представляючи провідне джерело харчової інтоксикації (Fetsch & Johler, 2018; Le Loir, Baron, & Gautier, 2003). Крім того, MRSA визначено важливою причиною ентероколіту, особливо у госпіталізованих пацієнтів та у тих, у кого знижена кислотна продукція шлунка (Pressly et al., 2016). Виявлення MRSA у різноманітних продуктах харчування тваринного походження, як наслідок зараження тваринами та/або людьми (Normanno et al., 2007), розпочало наукову дискусію щодо його ролі у спричиненні інфекцій через споживання їжі, але виживання MRSA в кислих умовах шлунку людини ще не досліджено.
Припускаючи, що шлунковий бактерицидний бар'єр в основному залежить від кислоти (Drasar, Shiner, & McLeod, 1969; Hornick et al., 1971; Peterson, Mackowiak, Barnett, Marling-Cason, & Haley, 1989), оскільки низький рН здатний контролюючи популяцію бактерій у шлунковому середовищі (Smith, 2003), ми досліджували здатність MRSA долати шлунковий бар’єр людини, імітуючи кислі умови шлунку.
Наскільки нам відомо, це перше дослідження, яке досліджує поведінку штамів MRSA в кислих умовах шлунку людини. Хоча ми виявили відмінності між кислотною стійкістю двох штамів MRSA, які використовувались у наших експериментах, наші результати демонструють, що певні штами MRSA мають сильну (імовірну) здатність виживати в умовах кислого стресу. Як наслідок, вони можуть пройти шлунковий бар’єр і дійти до кишечника, де можуть викликати активну інфекцію (Bergevin et al., 2017; Pressly et al., 2016; Watanabe et al., 2001).
На закінчення, наші результати дають нові знання щодо долі MRSA в кислих умовах шлунка людини in vitro і можуть сприяти кращому визначенню ролі MRSA у дебатах про безпеку харчових продуктів.
КОНФЛІКТ ІНТЕРЕСІВ
Автори не мають заявляти про конфлікт інтересів.
ЗАВЕРШЕННЯ
Опубліковано із внеском від 5 х 1000 фондів IRPEF на користь Університету Фоджії на згадку про Джанлуку Монтеля.
- Жовчний міхур; Умови жовчних проток El Camino Health
- Профілактика діабету Ви маєте контроль над своєю долею
- Перша допомога при непритомності в надзвичайних ситуаціях -
- Фонд «Супутні захворювання та подагричний артрит»
- Дієта золотовушка в умовах розведення