Для блокування поглинання гексоз потрібно одночасне вибивання щонайменше 20 генів-транспортерів Saccharomyces cerevisiae
Institut für Mikrobiologie, Heinrich-Heine-Universität, Universitätsstr. 1, Геб. 26.12.01, D-40225 Дюссельдорф, Німеччина
Institut für Mikrobiologie, Heinrich-Heine-Universität, Universitätsstr. 1, Геб. 26.12.01, D-40225 Дюссельдорф, Німеччина
Institut für Mikrobiologie, Heinrich-Heine-Universität, Universitätsstr. 1, Геб. 26.12.01, D-40225 Дюссельдорф, Німеччина
Institut für Mikrobiologie, Heinrich-Heine-Universität, Universitätsstr. 1, Геб. 26.12.01, D-40225 Дюссельдорф, Німеччина
Institut für Mikrobiologie, Heinrich-Heine-Universität, Universitätsstr. 1, Геб. 26.12.01, D-40225 Дюссельдорф, Німеччина
Institut für Mikrobiologie, Heinrich-Heine-Universität, Universitätsstr. 1, Геб. 26.12.01, D-40225 Дюссельдорф, Німеччина
Institut für Mikrobiologie, Heinrich-Heine-Universität, Universitätsstr. 1, Геб. 26.12.01, D-40225 Дюссельдорф, Німеччина
Institut für Mikrobiologie, Heinrich-Heine-Universität, Universitätsstr. 1, Геб. 26.12.01, D-40225 Дюссельдорф, Німеччина
Institut für Mikrobiologie, Heinrich-Heine-Universität, Universitätsstr. 1, Геб. 26.12.01, D-40225 Дюссельдорф, Німеччина
Institut für Mikrobiologie, Heinrich-Heine-Universität, Universitätsstr. 1, Геб. 26.12.01, D-40225 Дюссельдорф, Німеччина
Institut für Mikrobiologie, Heinrich-Heine-Universität, Universitätsstr. 1, Геб. 26.12.01, D-40225 Дюссельдорф, Німеччина
Institut für Mikrobiologie, Heinrich-Heine-Universität, Universitätsstr. 1, Геб. 26.12.01, D-40225 Дюссельдорф, Німеччина
Анотація
Сімейство транспортерів гексози Saccharomyces cerevisiae містить 18 білків (Hxt1–17, Gal2). Тут ми демонструємо, що всі ці білки, крім Hxt12, і додатково три члени сімейства транспортерів мальтози (Agt1, Ydl247, Yjr160) здатні транспортувати гексози. У дріжджовому штамі видалено HXT1–17, GAL2, AGT1, YDL247w і YJR160c, споживання глюкози та транспортна діяльність були повністю скасовані. Однак у якості додаткової делеції гена сенсора глюкози ВЯП3 частково відновлений ріст гексоз, наші дані вказують на існування ще більшої кількості білків, здатних транспортувати гексози в дріжджах.
1. Вступ
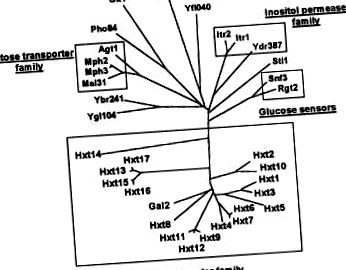
Переважними джерелами вуглецю для більшості прокаріотичних та еукаріотичних клітин є вуглеводи, перш за все моносахаридна глюкоза. Ця біомолекула становить більшу частину органічної речовини на землі. Обов'язковим і важливим етапом утилізації глюкози є її транспорт через плазматичну мембрану в клітини, процес, який досягається транспортерними білками. У різних організмах еволюціонували різні механізми, що опосередковують транспорт глюкози, тобто протонні системи симпорту, котранспортери Na + -глюкози, системи, що зв'язують білок, системи фосфотрансферази та полегшені дифузійні системи [1-3]. Одними з найбільш відомих організмів, що використовують глюкозу, є дріжджі Saccharomyces cerevisiae. Сімейство пермеаз дріжджових цукрів складається з 34 білків, 18 з яких - підродина транспортера гексози [4-6] (рис. 1). Оскільки транспорт через плазматичну мембрану є важливим кроком у контролі швидкості метаболізму глюкози, з'ясування функцій цієї безлічі білків, пов'язаних з транспортером глюкози, є принципово важливим питанням. Більше того, це може надати розуміння загальних принципів транспорту глюкози в інших організмах.
2 Матеріали та методи
2.1 Штами дріжджів та умови росту
Штами дріжджів були такими, як описано в таблиці 1. Середовище та умови росту були такими, як описано в [7]. Властивості росту визначали на синтетичному середовищі (YNB + (NH4) 2SO4 + джерело вуглецю), доповненому лише для ауксотрофних потреб.
| Процідити | Генотип | Джерело |
| CEN.PK2‐1C (= VW1A) | MATα leu2‐3,112 ura3‐52 trp1‐289 his3 ‐ Δ1 MAL2‐8 c SUC2 hxt17Δ | К.‐Д. Ентіан |
| EBY.VW367 + | CEN.PK2‐1C hxt13Δ: loxP hxt15Δ: loxP hxt16Δ: loxP hxt14Δ: loxP hxt12Δ: loxP hxt9Δ: loxP hxt11Δ: loxP hxt10Δ: loxP hxt8Δ: loxP hxt514Δ: loxP hxt2Δ: loxP | Це дослідження |
| EBY.VW1000 | EBY.VW367 + hxt367Δ: loxP gal2Δ | Це дослідження |
| EBY.VW2000 | EBY.VW1000 snf3Δ: loxP | Це дослідження |
| EBY.VW4000 | EBY.VW1000 stl1Δ: loxP agt1Δ: loxP ydl247wΔ: loxP yjr160cΔ: loxP | Це дослідження |
| EBY.VW5000 | EBY.VW4000 snf3Δ: loxP rgt2Δ: loxP | Це дослідження |
| EBY.FY100B | MATα ura3‐52 trp1Δ63 his3Δ200 (отримано з FY1679) | Це дослідження |
| EBY.FY367 + | EBY.FY100B hxt13Δ: loxP hxt15Δ: loxP hxt16Δ: loxP hxt17Δ: loxP hxt14Δ: loxP hxt12Δ: loxP hxt9Δ: loxP hxt11Δ: loxP hxt10Δ: loxP hxt8Δ: loxP hxt514Δ: loxP hxt2Δ: loxP | Це дослідження |
2.2 Побудова мутантів множинної делеції
| Δhxt13/Δhxt17 | 5′‐ CGCACCACCCGTGGAAAAAGAGTGGTCAGATGGATTTGATGACAA CAGCTGAAGCTTCGTACGC ‐3 ′ |
| 5′‐ TTGAGAACTTCAAAAATTTCTTCCAATCCTTCTTCTCGGTCTTAC GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Δhxt15/Δhxt16 | 5′‐ ATGGCAAGCGAACAGTCCTCACCAGAAATTAATGCAGATAATCTAA CAGCTGAAGCTTCGTACGC ‐3 ′ |
| 5′‐ AGCATGTTTATCAAGCGCGCATATTGATCAATTAAAACTCTTTGGGAA GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Δhxt14 | 5′‐ GGCAGGGGAAGGGATTATAATGTAACCATTAAGTATCTAGATGAT CAGCTGAAGCTTCGTACGC ‐3 ′ |
| 5′‐ TCCTAGTTTGAAATCAATTTTGGATACAATCATTGGTGTTAAAAG GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Δhxt12 | 5′‐ ATCTTTGGTTGGGATACCGGTACCATTTCTGGTTTTGTTAACCTTTC CAGCTGAAGCTTCGTACGC ‐3 ′ |
| 5′‐ GGACAAAGAAAAAGACATAAAAGTATGCAAAAACCAGACAGCCTAAGA GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Δhxt11 | 5′‐ ATGTCAGGTGTTAATAATACATCCGCAAATGAGTTATCTACTACCATG TTCGTACGCTGCAGGTCGAC ‐3 ′ |
| 5′‐ GGACAAAGAAAAAGACATAAAAGTATGCAAAAACCAGACAGCCTAAGA GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Δhxt10 | 5′‐ ATGGTTAGTTCAAGTGTTTCCATTTTGGGGACTAGCGCCAAGGCATCC TTCGTACGCTGCAGGTCGAC ‐3 ′ |
| 5′‐ AATTATTTACTATCAACAATAACTAATGGTGTACTGCTTGTTGGTTGTGG GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Δhxt9 | 5′‐ GTAGCAAATGCACCATCTGTAAAAACTGAGCATAATGACTCTAAAAAC TTCGTACGCTGCAGGTCGAC ‐3 ′ |
| 5′‐ GGACAAAGAAAAAGACATAAAAGTATGCAAAAACCAGACAGCCTAAGA GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Δhxt8 | 5′‐ ATGACTGATCGTAAAACCAACTTGCCAGAAGAACCGATTTTCGAAGAG TTCGTACGCTGCAGGTCGAC ‐3 ′ |
| 5′‐ GGTCTAAAACATTCTTTTGTAGAAGGGTTTCTCGTCATGCTGTAATTT GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Δhxt5 ‐ hxt1 ‐ hxt4 | 5′‐ ATGTCGGAACTTGAAAACGCTCATCAAGGCCCCTTGGAAGGGTCTGCTACT TTCGTACGCTGCAGGTCGAC ‐3 ′ |
| 5′‐ TTAGATCATCAGCGTTGTAGTCAGTACCTCTCTTGTTTGGTGGAACCAAG GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Δhxt2 | 5′‐ ATGTCTGAATTCGCTACTAGCCGCGTTGAAAGTGGCTCTCAACAAACT TTCGTACGCTGCAGGTCGAC ‐3 ′ |
| 5′‐ TATTCCTCGGAAACTCTTTTTTCTTTTGAGATCCAGCTACCAGAT GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Δhxt3 ‐ hxt6 ‐ hxt7 | 5′‐ ATGAATTCAACTCCAGATTTAATATCTCCACAAAAGTCAAGTGAGAATTCG TTCGTACGCTGCAGGTCGAC ‐3 ′ |
| 5′‐ AAGTTTCTTTGTCTCCGTCCCACTCAACTTTCTGAGAACAAATGATC GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Δstl1 | 5′‐ ATGAAGGATTTAAAATTATCGAATTTCAAAGGCAAATTTATAAGCAGA TTCGTACGCTGCAGGTCGAC ‐3 ′ |
| 5′‐ ACCCTCAAAATTTGCTTTATCGTTCACTGTATCTTCATTTTTGATGTT GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Δagt1/Δagt1: lacZ | 5′‐ ATGAAAAATATCATTTCATTGGTAAGCAAGAAGAAGGCTGCCTCAAAA TTCGTACGCTGCAGGTCGAC ‐3 ′ |
| 5′‐ TAATTCTCGCTGTTTTATGCTTGAGGACTGACTGATACTCTCTCATCAGC GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Δydl247w/Δyjr160c | 5′‐ ATGAAAAACTTATCTTTTCTCATAAACAGAAGAAAGGAAAATACAAGT TTCGTACGCTGCAGGTCGAC ‐3 ′ |
| 5′‐ TTCCTCTGCAATGGAAGCTTCGATATCTCCCTTGGGGTCGTTATG GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Δsnf3 | 5′‐ ATGGATCCTAATAGTAACAGTTCTAGCGAAACATTACGCCAAGAGAAA TTCGTACGCTGCAGGTCGAC ‐3 ′ |
| 5′‐ TATTTCAAATCATTATTTTCATTTACAGGTTGATTAGTGGCGTTTTC GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Δrgt2 | 5′‐ ATGAACGATAGCCAAAACTGCCTACGACAGAGGGAAGAAAATAGTCAT TTCGTACGCTGCAGGTCGAC ‐3 ′ |
| 5′‐ GGGGGAAGTGTATTGGCTGTGCTTACTAGCGAGGTCACTCGTCCAATT GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Гомологія до генів транспортера цукру, напівжирний; гомологія до kanMX касета, курсив. | |
2.3 Побудова плазмід надмірної експресії транспортера цукру
2.4 Інші методи молекулярної біології
Геномна заміна AGT1 області кодування за допомогою ПЛР-ампліфікації lacZ ‐ kanMX репортерська касета була використана для злиття промотору та перших 48 нуклеотидів усічених AGT1 ORF до E. coli lacZ ген [12]. Для ПЛР-ампліфікації lacZ ‐ kanMX використовували репортерську касету, плазміду pUG6lacZ [12] та праймери, перелічені в таблиці 2. ДНК та РНК готувались та маніпулювали згідно з опублікованими процедурами [13, 14] .
2.5 Аналізи засвоєння цукру та дослідження ферментації
Аналізи поглинання цукру та дослідження ферментації були такими, як описано [15]. Дослідження ферментації проводили в 50 мМ фосфатному буфері калію, рН 6,3, доповненому 1% глюкозою. Транспорт глюкози вимірювали як поглинання глюкози D - [U-14 C] (Amersham). Активність засвоєння глюкози у дикого типу та у hxt мутантні клітини визначали при концентрації глюкози 10 або 50 мМ протягом 15 або 60 с.
3 Результати
3.1 Делеція всіх генів транспортера гексози
Оскільки послідовність геному дріжджів завершувалась, загалом 18 різних генів, HXT1 – HXT17 і GAL2, були виявлені, що кодують білки, що належать до сімейства транспортерів гексози дріжджів (рис. 1) [5, 16]. На сьогодні функціонально охарактеризовано лише сім білків-транспортерів гексози, Hxt1–4, 6, 7 та Gal2 (оглянуто в [16]). Однак нічого не відомо про фактичні функції Hxt5 та Hxt8 – Hxt17.
Для того, щоб розібрати функцію повного сімейства транспортерів гексози S. cerevisiae, ми видалили всіх 18 членів сімейства із штаму дріжджів CEN.PK2‐1 (таблиця 1) послідовністю одноетапних делецій гена за допомогою loxP ‐ kanMX ‐ loxP маркер опору, призначений для багаторазового використання [8]. Крім того, деякі делеції були зроблені у штамі EBY.FY100B, отриманому з FY1679 [17]. Південний аналіз показав, що, на відміну від штаму FY1679, штам дикого типу CEN.PK2‐1C не містить HXT17 ген (дані не показані). Гени транспортера гексози видаляли послідовно, починаючи з HXT17/16. Видалення всіх генів з HXT17/16 до HXT8 плюс HXT5, HXT4, HXT2 і HXT1 у штамах EBY.FY100B та CEN.PK2‐1C отримані мутантні штами EBY.FY367 + та EBY.VW367 +, відповідно. Ці штами, які все ще містилися HXT3, HXT6 і HXT7, не виявляв дефектів росту на середовищах, що містять глюкозу, фруктозу або маннозу, порівняно з відповідними штамами дикого типу (рис. 2).
3.2 Перевиробництво всіх транспортерів гексози
Вже було показано, що Hxt1 – Hxt4, Hxt6 та Hxt7 є основними транспортерами гексози у дріжджах і можуть транспортувати глюкозу, фруктозу та маннозу [15, 18]. Щоб дослідити, чи всі інші пов’язані з транспортером гексози білки, якщо вони присутні в достатній кількості, мають внутрішню здатність транспортувати глюкозу або одну з інших гексоз, кожна з інших HXT гени надмірно експресувались з багатокопійних плазмід під контролем сильних MET25 промоутер в hxt1–17 gal2 делеційний штам. Ми виявили, що всі білки Hxt, але Hxt12, здатні транспортувати принаймні одну з різних гексоз і дозволяють ріст hxt1–17 gal2 делеційний штам, хоча і з різною специфікою субстрату (рис. 3). Ми не змогли функціонально висловити Hxt12, підтримуючи думку HXT12 є псевдогеном [4, 5] .
3.3 Клонування та видалення додаткових транспортерів глюкози
Проаналізувати транскрипційну регуляцію AGT1 ген, який кодує загальний α-глюкозидний транспортер [19, 20], AGT1 область кодування у штамі CEN.PK2‐1C замінено на lacZ ‐ kanMX репортерська касета. Вимірювання активності β-галактозидази показало, що AGT1 ген індукується мальтозою (1382 мО/мг білка), але репресується глюкозою (23 мО/мг білка). Результати показують, що Agt1 і, можливо, також інші гомологи пермеази мальтози, Mph2 та Mph3, опосередковують залишковий поглинання глюкози hxt1–17 gal2 штам після попереднього росту на мальтозі, але пригнічується глюкозою, що призводить до припинення споживання та росту глюкози. Згідно з цими спостереженнями, делеція всіх трьох генів, AGT1, YDL247w/MPH2 і YJR160c/MPH3, в hxt1–17 gal2 мутантний штам повністю скасував залишкове споживання глюкози (рис. 4).
3.4 Додаткове видалення генів сенсора глюкози
ВЯП3 і RGT2 кодують датчики глюкози, які генерують сигнал глюкози у відповідь на низьку та високу концентрації глюкози, відповідно, що в кінцевому підсумку призводить до індукції транскрипції декількох HXT гени (оглянуто в [21]). Дивно, але після видалення ВЯП3 ген, але не RGT2 ген у hxt1–17 gal2 або hxt1–17 gal2 agt1 mph2 mph/mph3 мутантний штам, частково відновився ріст клітин на глюкозі, фруктозі, маннозі та сахарозі (рис. 2). Крім того, hxt1–17 gal2 agt1 mph2 mph/snf3 rgt2 делеційний штам все ще міг рости на цих гексозах. Ці результати вказують на пригнічувальну функцію Snf3 на додатковий білок, який здатний транспортувати гексози. Дійсно, ми виявили, що STL1 ген знизився після видалення ВЯП3 в hxt1–17 мутантний штам (дані не наведені). Однак видалення STL1 ген у hxt1–17 gal2 agt1 mph2 mph/snf3 rgt2 мутантний штам не запобігав залишковому росту на гексозах (рис. 2), а також його надмірна експресія не відновлювала ріст hxt1–17 gal2 навантаження на гексози.
4 Обговорення
Тут ми продемонстрували, що понад 20 різних білків у дріжджах здатні транспортувати гексози. Попередні результати показали, що видалення лише HXT1-HXT7 у дріжджовому штамі MC996A запобігав ріст мутантних клітин на глюкозі, припускаючи, що інший HXT гени не експресуються або не функціональні [18]. На відміну від них, hxt1–7 делеційний мутант, сконструйований на тлі штаму CEN.PK, який був використаний у цій роботі, все ще міг рости на глюкозі, хоча і повільно (неопубліковані дані). Ми припускаємо, що ці відмінності можна пояснити вищою дихальною здатністю штаму CEN.PK [22]. Вища частота дихання, очевидно, дозволяє клітинам CEN.PK катаболізувати глюкозу навіть при дуже низьких показниках засвоєння. Так само, видалення HXT1–4 і HXT6/7 в іншому лабораторному штамі [23] не повністю усунув транспорт глюкози. Інгібування мітохондріального транспорту електронів/окисне фосфорилювання було необхідним для запобігання залишкового росту глюкози, що припускає, що незначні транспортери глюкози все ще активні.
- Чи може генетика впливати на те, що ми любимо їсти Розуміння ролі генів у харчовій поведінці
- НЕ ТРАНУЙТЕ ТЕСЛЯНИХ БДЖІЛ
- Ентальпійне набрякання макромолекул фотонних блокових полімерних плівок
- Для WOWW потрібна мужність! Фактор; Woww Фактор Жінки
- Легко мариновані яйця (консервування не потрібно) - витратьте на копійки