Дисфункція астроцитів після навантаження пурину, пов’язаного з молібденом, може спричинити хворобу Паркінсона з деменцією
Предмети
Анотація
Вступ
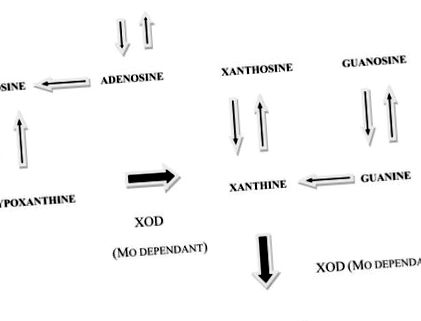
Катаболізм пуринів у людей та овець. XOD - це молібдензалежний фермент ксантиноксидаза-дегідрогеназа. Достатність молібдену призводить до відмінностей від дефіциту молібдену. Результат для достатньої кількості людей та овець: (1) Активність ксантиноксидази-дегідрогенази висока. (2) Дієтичні пурини катаболізуються в кишечнику та печінці та виводяться з організму. (3) Їх не можна «врятувати», отже вони не досягають ЦНС. Результат для людей та овець з дефіцитом Mo: (1) Активність ксантиноксидази-дегідрогенази дуже низька. (2) Дієтичні пурини не катаболізуються, отже досягають загального кровообігу. (3) Деякі з них “врятовані” і досягають ЦНС, решта виводиться без катаболізму
Навантаження пурину та дисфункція астроцитів
Клінічні ефекти навантаження аденозином або навантаження гуанозином ще не вивчені. Однак відомо, що аденозинові рецептори найбільше зосереджені в нігробриатумі, а рецептори гуанозину в гіпокампі, мигдалині та черевному смугастому тілі, і це може свідчити про роль аденозину в ініціації PD та гуанозину в деменції. Така пропозиція не буде суперечити патологіям, які вже описані в літературі щодо БД з деменцією, оскільки пропозиція стосується лише ініціюючого фактора, а не змін, що відбудуться після такої первинної події. Кілька дисфункцій вегетативної нервової системи є загальним явищем у БД. Ці прояви, як видається, спричинені процесом нейродегенеративного захворювання, який відбувається як у центральній, так і в периферичній нервовій системі. 4 Хоча представлена тут пропозиція про ініціювання захворювання їм не відразу пояснюється, імовірно, це пояснюється патологіями, які з часом слідують за нею.
Прогнозовані наслідки навантаження аденозином
Люди з дефіцитом Mo, які регулярно вживають аденозин або продукти, що містять аденин, поступово завантажуватимуть ЦНС цим пурином. У хронічно прогресивному і незворотному процесі кількість аденозину в ЦНС зростатиме, і може слідувати дисфункція нігро-смугастого тіла. Цей нейрональний сайт у мозку є областю високої концентрації рецепторів аденозину A2a, і аденозин діє як агоніст цих рецепторів. Пуриновий кофеїн може зменшити ризик розвитку ПД, діючи як антагоніст аденозину А2а-рецептора 5, отже, очікується, що агоніст аденозину матиме протилежний ефект. Певна група астроцитів регулює позаклітинний глутамат мозку в смугастому тілі за допомогою механізму рецепторів аденозину А2а. 6,7,8
Очікується, що навантаження аденозином буде інгібувати поглинання глутамату астроцитами, асоційованими з рецепторами А2а, у нігро-стриатумі, і це дозволить підвищити рівень позаклітинного глутамату. 8 Нейротоксичність глутамату може сприяти дегенерації нейгро-смугастих нейронів, що відбувається.
Прогнозовані наслідки навантаження гуанозином
Завантаження пурину та мутації генів PD, пов’язані з астроцитами
Бут та ін. 15 розглянули роль дисфункції астроцитів у БД, розглянувши як гени, що є причиною розвитку БД, так і аспекти біології астроцитів, в яких вони були причетні. Вони припустили, що деякі порушення біології астроцитів пов'язані з дегенерацією нейронів у БД. Існує щонайменше 17 моногенних мутацій, причетних до розвитку PD, і білки, кодовані вісьма з них, відіграють певну роль в біології астроцитів. Поглинання та вивільнення глутамату, пов’язане з астроцитами, є важливою частиною механізму завантаження пурину, запропонованого в цій перспективі. Аденозин буде інгібувати, а гуанозин посилювати поглинання глутамату. Отже, щодо аденозину представляє інтерес, що як білок DJ-1, асоційований з геном PARK7, так і білок альфа-синуклеїну, асоційований з геном SNCA, беруть участь у функції астроцитів поглинання глутамату. Більш конкретно, обидва вони негативно впливають на специфічні для астроцитів транспортери глутамату, отже, інгібують поглинання глутамату.
Мо дефіцит
Висновки
Потрібні подальші дослідження потенційної ролі дефіциту Mo, прийому аденозину та гуанозину, навантаження пурину та дисфункції астроцитів в етіології БД з деменцією. Моделітна дефіцитна модель овець була б корисним інструментом для запуску цього процесу, оскільки вона могла б наочно продемонструвати, що навантаження аденозином спричинить рухові нервові ефекти, що узгоджуються з ефектами PD та деменцією гуанозину, що відповідають деменції, пов’язаній з PD. Протокол, вже опублікований Бурком щодо ксантозину 1 та інозину 2, може бути легко модифікований для забезпечення досліджень прийому аденозину та гуанозину.
Список літератури
Бурк, К. А. Хвороба рухових нейронів у овець з дефіцитом молібдену, що харчуються ендогенним пуриновим ксантозином: можливий механізм хитання трибулуса. Авст. Ветеринар. J. 90, 272–274 (2012).
Бурк, К. А. Депривація молібдену, прийом пурину та асоційований з астроцитами синдром рухових нейронів у овець: передбачувані клінічні ефекти інозину. Авст. Ветеринар. J. 93, 79–83 (2015).
Бурк, К. А. Дефіцит молібдену викликає рухові нервові ефекти, які відповідають аміотрофічному бічному склерозу. Спереду. Нейрол. 7, 28 (2016).
Simuni, T. & Sethi, K. Немоторні прояви хвороби Паркінсона. Енн Нейрол. 64, S65 – S80 (2008).
Chen, J. F. та співавт. Нейропротекція кофеїном та інактивацією рецепторів аденозинового рецептора A (2a) на моделі хвороби Паркінсона. J. Neurosci. 21, 1–6 (2001).
Nishizaki, T. АТФ- та аденозин-опосередкована сигналізація в центральній нервовій системі: аденозин стимулює вивільнення глутамату з астроцитів через рецептори аденозину A2a. J. Pharmacol. Наук. 94, 100–102 (2004).
Бернсток, Г. Фізіологія та патофізіологія пуринергічної нейромедіації. Фізіол. Преподобний. 87, 659–797 (2007). 87, 659-797.
Матос, М. та співавт. Аденозинові рецептори A2a модулюють поглинання глутамату в культивованих астроцитах і гліосомах. Глія 60, 702–716 (2012).
Фуджіта, Т. та ін. Експресія нейронального трансгену у домінантно-негативних мишей SNARE. J. Neurosci. 34, 16594–165604 (2014).
Пападопулос, В. Бензодіазепін/інгібітор зв'язування діазепаму периферичного типу: біологічна роль у функціонуванні стероїдогенних клітин. Endocr. Преподобний. 14, 222–240 (1993).
Палецкі, Р. Ф. Клонування та характеристика гуаніндезамінази з мозку мишей та щурів. Неврологія 109, 15–26 (2002).
Траверса, У. та ін. Специфічні (3 H) -гуанозин-зв'язуючі сайти в мембранах мозку щурів. Бріт. J. Pharmacol. 135, 969–976 (2002).
Schmidt, A. P., Lara, D. R. & Souza, D. O. Пропозиція пуринергічної системи на основі гуаніну в центральній нервовій системі ссавців. J. Pharmacol. Тер 116, 401–416 (2007).
Frizzo, M. E. та співавт. Активація поглинання глутамату гуанозином у первинних культурах астроцитів. Нейрорепортаж 12, 879–881 (2001).
Бут, Х. Д. Е., Херст, В. Д. та Уейд-Мартінс, Р. Роль дисфункції астроцитів у патогенезі хвороби Паркінсона. Тенденції Neurosci. 40, 358–370 (2017).
Цонгас, Т. А., Меглен, Р. Р., Вальравенс, П. А. і Чаппелл, В. Р. Молібден у харчуванні: оцінка середньодобового споживання в США. Am. J. Clin. Nutr. 33, 1103–1107 (1980).
Міністерство сільського господарства, лісового та рибного господарств Сполученого Королівства. 1994 Загальне дієтичне дослідження: метали та інші елементи, споживання молібдену з їжею, додаток 2 Експертної групи з питань огляду вітамінів та мінералів молібдену. (MAFF, Лондон, 2002).
Ван Ден Іден, С. К. та співавт. Захворюваність на хворобу Паркінсона: варіації за віком, статтю та расою/етнічною приналежністю. Am. J. Епідеміол. 152, 1015–1022 (2003).
Duncan, G. W. та співавт. Захворюваність на хворобу Паркінсона на північному сході Англії. Вікове старіння 43, 257–263 (2013).
Шоу, П. Дж. В Аміотрофічний бічний склероз. (Браун, Р. Х., Майнінгер, В. і Суош, М.едс) Ч. 6 (Мартін Дуніц, Лондон, 2000).
Weisskopf, M. G., O’Reilly, E., Chen, H., Schwarzschild, M. A. & Ascherio, A. Урат плазми та ризик хвороби Паркінсона. Am. J. Епідеміол. 166, 561–567 (2007).
Рід, Д. М. і Броуді, Дж. А. Аміотрофічний бічний склероз та паркінсонізм-деменція Гуаму 1945-1972 рр., 1. Описова епідеміологія. Am. J. Епідеміол. 101, 287–301 (1975).
Miller, W. R. & Sanzolone, R. F. Дослідження можливого зв’язку геохімії гірських порід та ґрунту із виникненням високих показників нейродегенеративних захворювань на Гуамі та гіпотеза про причину захворювань. Звіт 03-126. (Геологічна служба США, Денвер, 2003).
Платон, C. C. та співавт. Аміотрофічний бічний склероз та паркінсонізм-деменційний комплекс Гуаму: зміна рівня захворюваності протягом останніх 60 років. Am. J. Епідеміол. 157, 149–157 (2003).
Подяки
Немає кого заявити. Підготовка цього рукопису була власною.
Інформація про автора
Приналежності
Ветеринарна діагностична лабораторія, Orange сільськогосподарський інститут, Orange, NSW, Австралія
Крістофер А. Бурк
Ви також можете шукати цього автора в PubMed Google Scholar
Внески
Автор є єдиним автором.
Відповідний автор
Декларації про етику
Конкуруючі інтереси
Автор не заявляє конкуруючих фінансових інтересів.
Додаткова інформація
Примітка видавця: Springer Nature залишається нейтральним щодо юрисдикційних вимог в опублікованих картах та інституційних приналежностей.
- Тіло в організмі як детермінанта жіночої дисфункції гонад - Повний текст
- Байкалін послаблює ожиріння, спричинене дієтою, ожиріння та дисфункцію печінки, реакцію на дозу та потенціал
- Запитайте докторів міфів про Леводопу Паркінсона; s Хвороба
- Вивчення глюкозою BOLD fMRI дослідження гіпоталамічної дисфункції у мишей, які отримували жир з високим вмістом жиру та
- 4 хірургічні методи лікування Паркінсона - глибока стимуляція мозку, таламотомія, паллідотомія,