Динаміка обміну жирової тканини в метаболічному здоров’ї та захворюваннях людини
Анотація
Вступ
Жирова тканина є важливим органом і є основним місцем накопичення енергії у вигляді триацилгліцеринів (ТГ). Біла жирова тканина (WAT) та коричнева жирова тканина (BAT) є переважаючими типами у ссавців. Оскільки WAT та BAT мають різне походження у розвитку, і більшість жирових тканин людини є WAT, саме цей тип буде основним предметом цього огляду. Традиційно дослідження функції ВАТ оберталися навколо її значної ролі в контролі енергетичного гомеостазу шляхом накопичення та вивільнення ліпідів у відповідь на потреби в енергії. Однак WAT має додаткові властивості, включаючи секреторні функції (вивільнення адипокінів), які впливають на чутливість до інсуліну та метаболічний гомеостаз, сприяючи патогенезу ожиріння та супутнім супутнім захворюванням [1].
ВАТ розподіляється по всьому тілу в декількох депо, кожна з різними функціями. Факти свідчать, що регіональний розподіл ВАТ, а не загальне ожиріння, може бути сильнішим предиктором метаболічних ризиків для здоров'я. Накопичення жиру у верхній частині тіла (а саме вісцеральної жирової тканини [VAT], але також і підшкірної черевної порожнини [scABD]) підвищує ризик розвитку цукрового діабету 2 типу та серцево-судинних захворювань, тоді як у нижній частині тіла, підшкірній сідничній та підшкірній стегновій ( scFEM) жир може бути метаболічно захисним [2]. Статевий диморфізм у розподілі жиру також добре задокументований: жінки, незважаючи на те, що вони мають в середньому більший відсоток жиру в організмі, ніж чоловіки, демонструють переважне накопичення жиру в “захисних” депо нижньої частини тіла [3]. І навпаки, чоловіки, як правило, депонують більше жиру у складі ПДВ верхньої частини тіла [4]. Статеві відмінності у розподілі жиру та різні функції жирових депо були розглянуті в попередніх оглядах [5, 6].
Хоча більша частина жирового зростання відбувається в дитинстві та підлітковому віці, ВАТ зберігає здатність розширюватися і в зрілому віці у відповідь на коливання енергетичного балансу. Величина ожиріння під час розвитку ожиріння визначається динамічними змінами синтезу та видалення (тобто обороту) жирових клітин (попередніх адипоцитів та адипоцитів) та TG. Незважаючи на негативні наслідки для здоров’я, пов’язані з ожирінням, мало відомо про обмін ВАТ in vivo у людей. Цей огляд містить короткий підсумок результатів, отриманих методами in vitro, а також огляд двох підходів in vivo, що застосовуються для оцінки обміну жирових клітин та TG. Нарешті, обговорюється роль ПДВ у метаболічному здоров’ї та захворюваннях.
Жировий оборот
Жирове розширення
Однак роль адипогенезу (тобто гіперплазії) у ризиках для здоров'я є спірною. Недавні спостереження повідомили про більш високу поширеність дрібних жирових клітин у резистентних до інсуліну осіб та у хворих на діабет 2 типу порівняно зі здоровими людьми, що свідчить про гіперпластичне розширення [8, 14,15,16]. Важливо, що ми показали, що 8 тижнів перегодовування на 40% (
7,6 кг збільшення маси тіла) призвело до більшого погіршення чутливості до інсуліну у осіб, які мали менші адипоцити на вихідному рівні, порівняно з тими, хто мав більші адипоцити [17]. Інше дослідження перегодовування людини продемонструвало, що менший розмір адипоцитів на початковому рівні передбачав зниження чутливості до інсуліну після збільшення ваги на 3,2 кг протягом 4 тижнів [18]. Ці останні дослідження суперечать гіпотезі про жирову розширюваність і вказують на те, що збільшена популяція малих адипоцитів (що свідчить про гіперплазію) пов'язана з порушеннями метаболічних наслідків для здоров'я.
Відмінності депо в жировому розширенні
Протилежні асоціації розподілу жиру у верхній частині тіла та нижчого відділу тіла із метаболічним здоров’ям, ймовірно, зумовлені внутрішніми характеристиками складів WAT. Мало досліджень оцінювали регіональні відмінності в адипогенезі у людей. Повідомлялося про депо-відмінності в преадипоцитах, культивованих з WAT, при цьому жир scABD має вищу проліферативну та диференційовану здатність, ніж жир scFEM [19, 20] та ПДВ [21]. Інша оцінка розміру адипоцитів запропонувала депо-специфічне розширення жиру у відповідь на перегодовування: головним чином гіпертрофія в жирі scABD і в першу чергу гіперплазія в жирі scFEM [22].
Статеві відмінності в жировому розширенні
Дослідження у 1980-х рр. Повідомили про гіперпластичне розширення (вище число адипоцитів) депо нижньої частини тіла у жінок та абдомінальних депо у чоловіків [23]. Більш пізні аналізи розміру жирових клітин свідчать про те, що розширення жирової тканини нижньої частини тіла в основному визначається гіперплазією у жінок, а гіпертрофією у чоловіків [24]. Вищий відсоток ранніх диференційованих адипоцитів був виявлений у складі scFEM жінок порівняно з чоловіками [20].
Смерть адипоцитів
На додаток до розширення жиру, загибель адипоцитів є життєво важливим компонентом оболонки жиру [25]. Дослідження на гризунах виявляють коливальну картину жирової клітинності, включаючи цикли гіпертрофії, гіперплазії та загибелі адипоцитів, із збільшенням загибелі адипоцитів у ожирілих гризунів [25, 26]. Даних у людей небагато. Підвищена загибель адипоцитів спричинена ожирінням людини [25]. Повідомляється про підвищену реакцію на апоптотичні подразники ПДВ (проти scABD-жиру) преадипоцитів [27, 28]. Одне дослідження припускає, що преадипоцити scABD жінок, що страждають ожирінням, більш сприйнятливі до апоптозу, ніж преадипоцити scFEM [20]. На сьогоднішній день жодні дослідження не оцінювали in vivo загибель адипоцитів у людей та її функціональний зв’язок із розподілом жиру та метаболічним здоров’ям.
Дослідження in vivo для вимірювання жирового обороту
2 H метод маркування
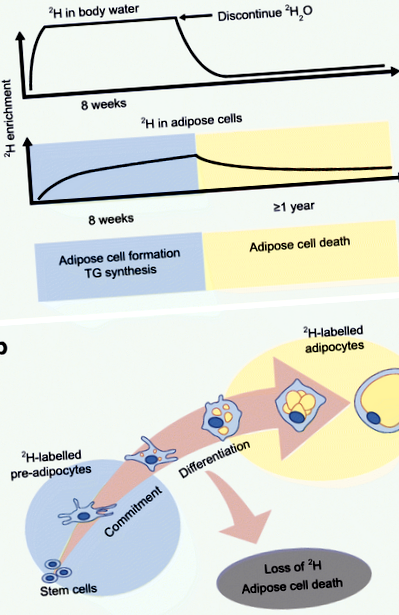
Лабораторією Hellerstein був розроблений новий метод для оцінки in vivo жирової кінетики за допомогою включення стабільного ізотопу дейтерію в жирову тканину [30]. Протокол, який був затверджений на мишах, а потім і на людях, включає початкове збільшення 2 H2O (важкої води) для досягнення системного збагачення біля води плато 2 H з водою з подальшим достатнім щоденним споживанням для підтримки значень збагачення [30 ] (Рис. 1). Потім 2 год важкої води вводять у жирові клітини, і збагачення ізотопу вимірюють за допомогою мас-спектрометрії та застосування аналізу розподілу масових ізотопомерів (MIDA). Заходи 2-міченого синтезу ДНК позначають новоутворені попередні адипоцити та адипоцити (за допомогою пре-адипоцитарної диференціації) [31], тоді як включення 2 Н у гліцеринову частину являє собою синтез TG [32].
2 протокол маркування H для оцінки жирового обороту in vivo. (a) Метод мічення дейтерію підтверджений для надання in vivo оцінок утворення жирових клітин, синтезу TG та загибелі адипоцитів у людини шляхом включення стабільного ізотопу 2 H у воду тіла та жирову тканину. 2 H вводять у вигляді 2 H2O таким чином, щоб досягти системного збагачення майже 2 плато 2 H водою тіла з подальшим щоденним споживанням для підтримання збагачення. Збагачення ізотопу жирових клітин вимірюється за допомогою мас-спектрометрії та застосування MIDA. (b) Збагачення 2 H в жировій тканині (попередні адипоцити та адипоцити) забезпечує заходи щодо формування та загибелі жирових клітин. Ця цифра доступна як слайд, який можна завантажити
Hellerstein та його колеги застосували підхід до маркування 2 H, щоб надати in vivo докази того, що адипоцити генеруються у людей у дорослому віці [33]. Нещодавно ми оцінювали кінетику in vivo у підшкірній ВАТ із депо scABD та scFEM, використовуючи 8-тижневе включення 2 H у жирові клітини у жінок із ожирінням [34]. Ми вперше повідомили про депо-відмінності в кінетиці in vivo з вищим утворенням жирових клітин (преадипоцити та адипоцити) та швидкістю синтезу TG у депо scFEM щодо депо scABD [34, 38]. Ці дані демонструють, що in vivo кінетика жирових клітин відрізняється між депо WAT у людей та посилює інші експериментальні спостереження, які вказують на стегно як на більш ефективне депо для розширення та розміщення ліпідів у жінок [2, 5]. Цікаво, що швидкість утворення жирових клітин як у складах scABD, так і у scFEM позитивно корелювала із процентним вмістом жиру в організмі, ІМТ та ожирінням вісцерального відділу, в той час як негативно пов’язана з чутливістю до інсуліну [35]. Ці нові дані кидають виклик гіпотезі розширюваності жирової тканини і забезпечують перші докази зв'язку між аспектами порушеного метаболічного здоров'я та вищим, а не нижчим, утворенням жирових клітин in vivo.
Лабораторія Hellerstein також була першою, хто застосував метод маркування 2 H для безпосереднього вимірювання синтезу та обміну TG у людській ВАТ in vivo [33]. Визначено, що період напіввиведення TG становить
6 місяців [33], подібно до попередніх оцінок, зроблених непрямими методами [36]. Інші лабораторії застосували підхід маркування 2 H, щоб продемонструвати, що кінетика TG у ВАТ відіграє значну роль у метаболізмі, повідомляючи, що in vivo швидкість синтезу TG була значно нижчою у резистентних до інсуліну осіб, ніж у чутливих до інсуліну осіб [37]. Цікаво, що нещодавно ми виявили расові та депо-відмінності у заміщенні TG, з вищим рівнем синтезу TG у білих проти чорних особин та у scFEM проти депо scABD [38]. Ці дані інтригують, оскільки були описані расові відмінності у стані кардіометаболічного стану [39].
14 C метод датування
Обмін адипоцитів in vivo у людини також оцінювали шляхом вимірювання інтеграції атмосферних 14 С, вивільнених під час випробувань ядерних бомб під час холодної війни (1955–1963), у геномну ДНК ВАТ [40]. Після припинення періоду випробувань ядерної бомби рівні 14 С в навколишньому середовищі експоненціально знизились, і 14 С було включено в рослини. Вживання рослин або тварин, які їли рослини, призвело до концентрації 14 C в організмі людини, що відображає концентрацію в атмосфері в даний момент часу. Отже, цей ретроспективний аналіз оцінив чисті зміни жирового обороту протягом періоду приблизно чотирьох десятиліть шляхом вимірювання рівнів 14 С у ДНК за допомогою прискорювальної мас-спектрометрії та співвідношення цих значень із даними атмосферного повітря 14 С.
Про це повідомили Спалдінг та ін
8,4% адипоцитів scABD in vivo замінюються щороку, незалежно від віку або ступеня ожиріння [40]. Автори також припустили, що рівень вироблення адипоцитів та рівень смертності були рівноважними у осіб із ожирінням на ранніх стадіях і що загальна кількість жирових клітин жорстко регулюється, навіть із збільшенням або втратою ваги. Ці дані свідчать про те, що загальна кількість адипоцитів може бути встановлена в дитинстві та підлітковому віці та незмінна протягом дорослого віку. Однак необхідні додаткові дослідження для оцінки жирообміну у осіб з ожирінням, які поступово набирають вагу протягом тривалого періоду часу, оскільки можуть відбуватися зміни загальної кількості адипоцитів. Дійсно, одне дослідження показало, що загальна кількість адипоцитів зростала у складі scFEM жінок під час перегодовування [22]. Оскільки дані in vitro, засновані на індексі морфології адипоцитів, підтверджують гіпотезу про розширюваність жирової тканини (обговорювану вище), Арнер та ін. Спостерігали зв’язок значень морфології з генеруванням адипоцитів in vivo [12]. Цікаво, що особи, які демонструють більше гіпертрофічного розширення жиру (вищий морфологічний індекс), виробляють менше адипоцитів in vivo на рік, ніж особи, що демонструють гіперплазію.
Spalding та його колеги також застосували метод датування 14 C для вивчення довгострокового обміну ліпідів WAT in vivo. Повідомлялося, що середній вік TG адипоцитів scABD, що відображається як тривалість зберігання TG у ВАТ до незворотного видалення за допомогою ліполізу (тобто тривалості життя TG), є
1,6 року [41]. Оскільки автори оцінювали вік адипоцитів як
9,5 років це означає, що ТГ замінюються приблизно шість разів протягом тривалості життя адипоцитів. Нижчий вік ТГ був суттєво пов’язаний з вищим ліполізом адипоцитів in vitro (стимульованим), що означає ліполіз як важливу детермінанту видалення ТГ. Цікаво, що різниці у віці ТГ між статями та розмірами адипоцитів не було. Чисте сховище TG було розраховано, щоб представити кількість TG, що зберігається у WAT щороку. Люди з ожирінням мали вищий рівень зберігання ТГ та вік ТГ порівняно з людьми, що не страждають ожирінням, що означає, що високий рівень зберігання та низький рівень видалення жирових ТГ можуть бути визначальними для ожиріння [41]. Цікаво, що середній вік TG, але не зберігання TG, корелював із резистентністю до інсуліну, як оцінювали HOMA-IR. Загалом, Спалдінг та його колеги припускають, що зберігання та виведення ліпідів (ТГ), подібно до обороту адипоцитів, є постійним у дорослому віці. Тим не менше, відсутність змін у віці ТГ, як оцінюється довгостроково, не зменшує наявність короткочасних змін у динаміці ліпідного обороту.
Перспективи підходів in vivo для вимірювання жирового обороту
- Визначники впливу на експресію гена жирової тканини людини на дієту, стать, метаболічний статус та цис
- Епікардіальна жирова тканина в основі ускладнень ожиріння SpringerLink
- Дієтичні схеми та результати здоров’я (серцево-судинна, метаболічна, ендокринна, неврологічна, скелетна)
- Голодування може зцілити людський організм від хвороб і змінити процес старіння
- Зберігання жиру як жирової тканини з книги «Їжа та регулювання ваги» Стівена Гісласона