Дієтичний NaCl регулює ниркову амінопептидазу N: відповідність гіпертонії у щура Даля
З секції кардіології (M.F., T.L.W., B.P.R., D.L.G., R.S.D.), Медичний факультет, Університет Іллінойсу в Чикаго, та Адміністрація ветеранів відділу Вест-Сайда (M.F., B.P.R., R.S.D.), Система охорони здоров'я Чикаго, Чикаго, Іллінойс.
З секції кардіології (M.F., T.L.W., B.P.R., D.L.G., R.S.D.), Медичний факультет, Університет Іллінойсу в Чикаго, та Адміністрація ветеранів відділу Вест-Сайда (M.F., B.P.R., R.S.D.), Система охорони здоров'я Чикаго, Чикаго, Іллінойс.
З секції кардіології (M.F., T.L.W., B.P.R., D.L.G., R.S.D.), Медичний факультет, Університет Іллінойсу в Чикаго, та Адміністрація ветеранів відділу Вест-Сайда (M.F., B.P.R., R.S.D.), Система охорони здоров'я Чикаго, Чикаго, Іллінойс.
З секції кардіології (M.F., T.L.W., B.P.R., D.L.G., R.S.D.), Медичний факультет, Університет Іллінойсу в Чикаго, та Адміністрація ветеранів відділу Вест-Сайда (M.F., B.P.R., R.S.D.), Система охорони здоров'я Чикаго, Чикаго, Іллінойс.
З секції кардіології (M.F., T.L.W., B.P.R., D.L.G., R.S.D.), Медичний факультет, Університет Іллінойсу в Чикаго, та Адміністрація ветеранів відділу Вест-Сайда (M.F., B.P.R., R.S.D.), Система охорони здоров'я Чикаго, Чикаго, Іллінойс.
Ви переглядаєте останню версію цієї статті. Попередні версії:
Анотація
Амінопептидаза N (APN) - це рясна металогідролаза в щітковій ділянці клітин проксимальних канальців нирок, яка розкладає ангіотензин III (Ang III) до ангіотензину IV (Ang IV) і поряд з дипептидиламінопептидазою деградує Ang IV. Ми дослідили вплив дієти з високим вмістом солі на активність нирок APN та кількість транскриптів у штамів щурів Sprague-Dawley та Dahl (SS/Jr). Рівень транскриптів APN та вміст білка були в 2 рази більшими (P 1 Ang III поділяє багато фізіологічних функцій Ang II у серцево-судинній та нервовій системах, включаючи стимуляцію секреції вазопресину, альдостерону та катехоламінів. 1 Подібно до Ang II, він діє як протизапальний засіб, стимулюючи вироблення цитокінів MCP-1 та активуючи NF-kB та AP-1. Постулюється, що Ang III сприяє запальній реакції та росту клітин із прогресуванням ниркової хвороби. 2,3 Однак вважається, що Ang IV має незначну біологічну активність, оскільки рецептори Ang II AT1 і AT2 мають слабку спорідненість до Ang IV, а інфузія Ang IV не викликає Ang II-залежних ефектів. 4,5 Нещодавно в кортикальних збірних протоках та мезангіальних клітинах 6 були виявлені рецептори до Ang IV, а Ang IV, на відміну від Ang III, посилював нирковий кровотік та мозкову вазодилатацію. 7 Таким чином, APN може знаходитись у критичному положенні для модуляції поглинання солі в нефронах та нирково-судинному опорі, контролюючи метаболізм Ang III до Ang IV. Ми припустили, що APN може грати механістичну роль у адаптації солі та гіпертонії.
APN є головною складовою мембран, що межують з щітками, клітин проксимальних канальців нирок та ентероцитів. 8,9 APN (номенклатура ферментів IUBMB ec 3.4.11.2, ap-n), відома також як мікросомальна амінопептидаза або амінопептидаза М, - гомодимерна, зв’язана з мембраною, цинкзалежна пептидаза, пов’язана з частинками амінопептидаза, яка переважно вивільняє нейтральні амінокислоти з N-кінцевий кінець олігопептидів і має специфічність, подібну до цитозольної лейцин амінопептидази. 10,11. APN належить до сімейства M1 клану пептидаз МА, який включає зв’язані з мембраною глікопротеїни типу II і був клонований з 6 різних видів ссавців. У цьому дослідженні ми дослідили вплив вмісту харчової солі на APN нирок у нормотензивних та чутливих до солі Даль щурів (SS).
Методи
Тварини
Протоколи використання тварин були затверджені Інституційним комітетом з питань догляду та використання тварин у Чикаго-Вест-Сайд. Самцям щурів Sprague-Dawley, Lewis та Dahl SS/Jr вагою від 250 до 300 грам, отриманих від Harlan Sprague-Dawley (Indianapolis, Ind), вводили базальну (0,3%) та високосолену (8%) щурячу дієту ( Purina серії 5500) протягом 10 днів. Для підтвердження дієти вимірювали натрій у сечі. Внутрішньоаортальні вимірювання артеріального тиску проводили, як описано раніше. Раніше повідомлялося про телеметричні вимірювання артеріального тиску за ці періоди. 12
Підготовка РНК
Нирки видаляли і швидко заморожували в рідкому азоті. Загальну РНК виділяли TRIzol (Invitrogen) з подальшим видаленням залишкових забруднень за допомогою набору RNeasy Total RNA Isolation Kit (Qiagen). Для високоякісних полі (А) + мРНК загальна РНК, підготовлена TRIzol, супроводжувалася використанням набору мРНК Oligotex (Qiagen).
Ланцюгова реакція полімерази в режимі реального часу
Ампліфікації зеленої полімеразної ланцюгової реакції (ПЛР) SYBR проводили, як описано раніше. 12 праймерів APN були розроблені на основі номера доступу до бази даних GenBank AFO39890 (ген APN Rattus norvegicus, екзон 2 та часткові компакт-диски) з використанням програмного забезпечення Primer Express версії 1.0 (PE Applied Biosystems) та перевірені за допомогою віртуальної ПЛР (вперед: 5 ′ TCCTGGAGCCTGGTGAATCC 3 ′; реверс: 5, GGAAAGGCGGTGACACTAAT 3 ′). Праймери для GAPDH були такими: вперед = 5 ′ GAAGGGCTCATGACCACAGT 3 ′; реверс = 5 ′ GGATGCAGGGATGATGTTCT 3 ′. ПЛР дала унікальні смуги передбачуваних розмірів. Послідовність цих клонованих продуктів підтвердила генну специфічність. Спостерігалось майже логарифмічно-лінійне посилення, причому посилення відбувалося між циклами 26 і 32. Кожен зразок і реакція повторювались 3 рази. Експресія нормалізувалась до GAPDH як ендогенного еталону та щодо експресії гена базальної солі як калібратора.
Західний аналіз
Імуноблот-аналіз гомогенатів нирок проводили, як описано раніше. 12 мембран імунопробовували мишачим поліклональним антигуманним антитілом APN (CD13 Ab-3 Laboratory Vision). Вторинним антитілом було кон'юговане антитіло до IgG HRG кози (Santa Cruz Biotechnology). Плямки контролювали на відмінності в завантаженні зразків шляхом нормалізації на актин.
Діяльність APN
Активність APN вимірювали в загальному екстракті нирки (приготовленому, як описано для вестерн-блот) методами Ryan et al. 13 та Salardi et al., 14, за винятком того, що ми використовували фторогенний субстрат Arg-Phe-AFC (Enzyme System Products, Livermore, Calif) ніж радіоактивний субстрат. Швидкість збільшення флуоресценції була лінійною протягом> 20 хвилин. Субстрат без екстракту нирки використовували як заготовку. Активність ферменту виражали у мікромолях AFC, що виробляються в хвилину на міліграм білка, використовуючи справжній AFC як калібратор.
Радіаційне гібридне картографування
Використовували гібридну панель щур-хом'як, що складається з 106 клонів із середньою швидкістю утримання локусу 28%, створеною Пітером Гудфеллоу (Кембридж, Великобританія) (Research Genetics, Хантсвілль, Алабама). Кожен маркер тестували окремо (жоден з них не мультиплексувався) та перевіряли принаймні двічі. Наявність або відсутність гена амінопептидази визначали за допомогою ПЛР за допомогою ген-специфічних праймерів (вперед: 5 ′ ATTTGCCCCCTTTTTACGAG 3 ′; реверс: 5 ′ ACTGCATGGGAATGTCACAA 3 ′; передбачуваний розмір продукту: 448 п.н.). Продукти ПЛР розчиняли на 3% -ному агарозному гелі та аналізували за допомогою системи документування гелю Bio-Rad. Дані були передані до Інституту генних досліджень Otsuka (http://e4000.otsuka.gr.jp:8012/cgi-bin/RH/rhNgv.pl) для тестування на каркасні карти.
Маркери генного локусу були інтегровані у віртуальну порівняльну карту (http://rgd.mcw.edu/tools/vcmap/vcmap.cgi?Ver=5.0) і пов’язані з відомими кількісними локусами ознак (QTL) та маркерами гормонів щурів за допомогою Медичного коледжу Огайо (http://home.mco.edu/depts/physiology/research/rat/marker.html), Массачусетський технологічний інститут (http://www-genome.wi.mit.edu/rat/public/), Оксфорд (http://www.well.ox.ac.uk/rat_mapping_resources/) та Arb (http://www.niams.nih.gov/rtbc/ratgbase/index.htm) і карти гормонів щурів.
Статистика
Кількість транскриптів/білка та активність у штамах порівнювали за допомогою ANOVA та змінювали між штамами двосторонніми т тест. Значимість була встановлена на рівні P 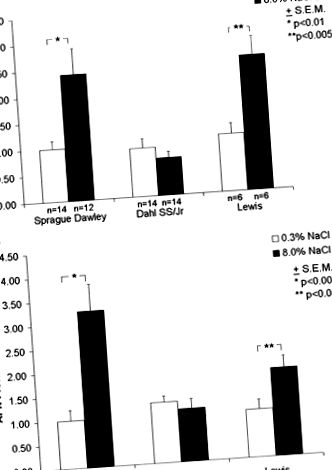
Фігура 1. Рівень APN у нирках у щурів Sprague-Dawley, Lewis та Dahl SS/Jr на 8% або 0,3% сольових дієтах (див. Методи). A, кількість стенограм APN, виміряна за допомогою (кінетичної) RT-PCR із використанням зеленого SYBR. В, кількість білка APN визначається західним аналізом (див. Методи). Експресія генів у штамах у порівнянні з ANOVA та зміна між штамами за допомогою 2-сторони т тест. Середнє значення ± SE; n = кількість щурів.
Активність нирок APN
Активність APN вимірювали в мембранних екстрактах з нирок через 10 днів або на 8%, або на 0,3% сольових дієтах (рис. 2). На дієті із сольовим вживанням 0,3% активність була ≈3-кратна та у 2 рази більша у щурів Dahl SS/Jr та Lewis порівняно з щурами Sprague-Dawley. Активність APN збільшилась на ≈10-кратну та 2-кратну у щурів Спрег-Доулі та Льюїса відповідно на 8% проти 0,3% сольових дієт. Однак ніяких змін у активності щурів Dahl SS/Jr на тих же дієтах не спостерігалося.
Малюнок 2. Загальна активність APN у мембранних екстрактах з нирок щурів Sprague-Dawley, Lewis та Dahl SS/Jr на 8% та 0,3% сольових дієтах (див. Методи). Експресія генів у штамах у порівнянні з ANOVA та зміна між штамами за допомогою 2-сторони т тест. Середнє значення ± SE; n = кількість щурів.
Хромосомне картографування гена APN
Маркер був виявлений у 26% гібридів. Оцінка LOD за двоточковим аналізом показала тісну кореляцію локусу з D1Rat42, D1Rat38, D1Got122 та D1Got115. Найближчий зв'язок був з D1Rat42 (θ = 0,086, LOD = 17,749). D1Rat42 та D1Rat38 знаходились у межах QTL 1b артеріального тиску, що було вроджено визначено у Dahl SS/Jr X Lewis. 15 Відносини до інших маркерів та схрещувань вказані на малюнку 3.
Малюнок 3. Принципова схема віртуальної хромосоми 1 із відносним розташуванням APN на артеріальному тиску QTL та іншими маркерами. Позиції маркерів у визначених хрестиках, позначених праворуч на малюнку (див. Методи).
Обговорення
Результати свідчать про те, що APN може опосередковувати соляну адаптацію та відігравати певну роль у патогенезі гіпертонічної хвороби СС. Адаптація до дієти з високим вмістом солі у щурів Спраг-Доулі та Льюїса супроводжується збільшенням кількості та активності APN, що припускає, що посилений метаболізм Ang III до Ang IV може бути механізмом зменшення поглинання Na + та ниркового судинного опору при адаптації до дієта з високим вмістом солі. З цих досліджень неможливо визначити, чи сприяє зміна активності APN порівняно з підтримкою тиску при адаптації солі, оскільки тимчасова залежність підвищення артеріального тиску до збільшення транскрипту APN у щурів була не оцінюється. Навпаки, дієта з високим вмістом солі не збільшує кількість ниркової APN та активність у щурів Dahl SS/Jr. Це узгоджується з гіпотезою, що знижена активність APN сприяє підвищенню чутливості до солі. Оскільки Ang III діє на рецептори AT2, які присутні в товстій висхідній петлі Генле, менший метаболізм Ang III у щурів Dahl SS на 8% -ній сольовій дієті може бути механізмом збільшення надходження натрію в товсту висхідну петлю Генле в щур Даля СС. 16–18
Оскільки у щурів Dahl SS були виявлені знижені рівні Ang I та Ang II у плазмі, реніну та альдостерону, 19–25, як вважають, система RAS зазвичай зазнає нормальних компенсаторних змін у відповідь на гіпертонію і не відіграє ролі в патогенезі. гіпертонії в цьому штамі. Однак нинішні висновки піднімають можливість того, що Ang III і IV відіграють механістичну роль у адаптації солей та в патогенезі гіпертонії. Ці вимірювання можуть також допомогти пояснити виявлення більшої ниркової активності APN у Dahl SS/Jr, ніж у Sprague-Dawley на 0,3% -ній сольовій дієті, навіть незважаючи на те, що у щурів Dahl SS/Jr більший рівень поглинання Na + нирками. Для подальшого вирішення цього питання необхідні вимірювання метаболітів ангіотензину, включаючи ангіотензини II, III та IV, у цих штамів щурів. Не можна виключати можливість того, що інші субстрати APN, які включають різноманітні аліфатичні розгалужені N-кінцеві амінокислоти, 26 відіграють роль у артеріальному тиску.
Подальша підтримка APN як гена-кандидата для гіпертонії у щура Dahl SS/Jr надається висновком про те, що він відповідає повідомленому QTL артеріального тиску в хромосомі 1. 27,28 Це узгоджується з APN, але не демонструє ген винуватця в QTL, який впливає на кров'яний тиск. Оскільки цей QTL був визначений із серії вроджених штамів щурів із сегментами хромосоми 1 щурів Льюїса, втручених у Dahl SS/Jr, 27,28, це забезпечує додаткову підтримку APN як ген-кандидат у щура Dahl SS/Jr, оскільки ми ідентифікували його шляхом порівняння штаму Льюїса та штаму щурів Спраг-Доулі, який є родоначальником, із щуром Даля SS/Jr.
Оскільки відбір у цьому дослідженні базувався на відмінностях в ряді транскриптів генів, ми припускаємо, що функціональні поліморфізми/алелі гена APN, асоційовані з гіпертонічною хворобою SS, знаходяться в некодуючих флангових та/або інтронічних областях гена APN, оскільки відбувається змінена регуляція достаток стенограм. Ген APN складається з 20 екзонів, які кодують сегменти, що відрізняються за розміром від 18 до 205 амінокислот. 11 Однак не можна виключати можливість існування функціональних відмінностей у кодуючій області, особливо тому, що активність APN відрізняється у щурів Спраг-Доулі від щурів Льюїса та Даля SS/Jr на 0,3% сольових дієтах, навіть незважаючи на те, що кількість білків APN однакова . Якщо посттрансляційні модифікації APN, а не гена APN, важливі для патогенезу гіпертонії, гени модифікаторів винуватців (наприклад, кінази, фосфатази тощо) повинні косегрегувати з гіпертонією, а не з геном APN. Послідовність та подальший аналіз косегрегації повинні допомогти вирішити цю проблему в майбутньому.
Перспективи
Роль, яку амінопептидази та APN відіграють у артеріальному тиску людини, ще має бути визначена. Ідентифіковано тридцять три поліморфізми гена лейцин-амінопептидази, отриманого адипоцитами, один з яких (поліморфізм Lys528Arg) нещодавно був пов’язаний із істотною гіпертонією людини. 29 Ген APN був присвоєний області довгого плеча (q11-qter) хромосоми 15 людини, області, в якій є дані про QTL для артеріального тиску. 30
- Клінічні ефекти профілактичного дієтичного лікування на камені в нирках - ScienceDirect
- Вплив на артеріальний тиск зниженого натрію в їжі та дієтичні підходи до зупинки гіпертонії
- Харчова кислотна навантаження та споживання калію пов'язані з артеріальним тиском та поширеністю гіпертонії у
- Комбінований вплив на нирки надмірної ваги та гіпертонії
- Вплив дієтичних підходів до зупинки гіпертонії (DASH) на дієту на тиск-натріурез