Дієтичні глюкозинолати сульфорафан, фенетил ізотіоціанат, індол-3-карбінол/3,3′-диіндолілметан: антиоксидантний стрес/запалення, Nrf2, епігенетика/епігеноміка та хіміопрофілактична ефективність раку in vivo
Анотація
Глюкозинолати - це група сірковмісних глікозидів, що містяться у багатьох видах рослин, включаючи хрестоцвіті овочі, такі як брокколі, капуста, брюссельська капуста та цвітна капуста. Накопичувані дані все більше підтверджують корисний вплив дієтичних глюкозинолатів на загальний стан здоров'я, в тому числі як потенційних протипухлинних засобів, через їх роль у запобіганні ініціації канцерогенезу через індукцію клітинних захисних детоксикаційних/антиоксидантних ферментів та їх епігенетичних механізмів, включаючи модифікацію метилювання CpG ракових генів, регуляція модифікації гістонів та зміни експресії мікроРНК (miРНК). У цьому контексті захисний механізм, опосередкований Nrf2-антиоксидантним стресом та протизапальними сигнальними шляхами, може сприяти клітинному захисту від окисного стресу та реактивних метаболітів канцерогенів. У цьому огляді ми підсумовуємо хіміопрофілактичну роль раку похідних глюкозинолатів, що зустрічаються в природі, як інгібіторів канцерогенезу, з особливим акцентом на конкретні молекулярні мішені та епігенетичні зміни в моделях тварин in vitro та in vivo на раку людини.
Вступ
Хіміопрофілактика раку є основною стратегією профілактики раку, яка використовує природні дієтичні фітохімікати або терапевтичні препарати з відносно низькою токсичністю для інгібування злоякісної трансформації ініційованих клітин на етапах просування або прогресування [1, 2]. Таким чином, хіміопрофілактика може включати запобігання потраплянню канцерогенів до цільових місць, активації метаболізму або подальшої взаємодії з важливими клітинними макромолекулами (наприклад, ДНК, РНК та білками) на стадії ініціації [3, 4]. Цікаво, що профілактика та/або захист від хімічних канцерогенів фітохімікатами, присутніми в глюкозинолатосодержащих хрестоцвітних овочах, представляє великий інтерес, оскільки вони можуть забезпечити безпечну та економічну стратегію боротьби з раком [5, 6 ••]. У цьому контексті численні епідеміологічні та фармакологічні дослідження показали, що споживання хрестоцвітних овочів має значний потенціал для хіміопрофілактики раку людини [7].
Біосинтез та метаболізм глюкозинолатів
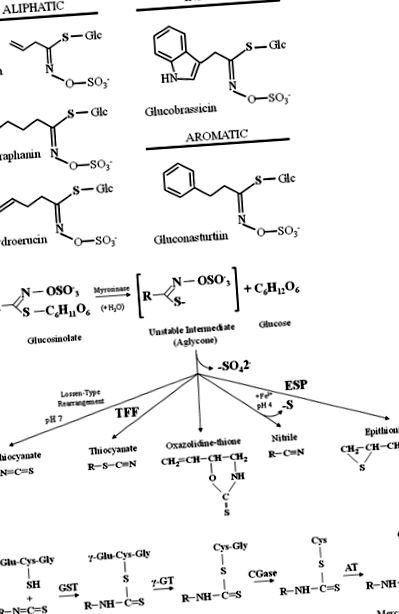
a Приклади аліфатичних, індольних та ароматичних глюкозинолатів, що містяться в овочах Brassicaceae. b Загальна модель гідролізу глюкозинолатів мірозиназою та білки-специфікатори, позначені як TFP (тіоціанат-утворюючи білок) та ESP (епітіоспецифічний білок). c Метаболізм ізотіоціанатів шляхом меркаптурної кислоти. Ізотіоціанати кон’югуються з глутатіоном глутатіоном S-трансферази (GST) і послідовно розщеплюється γ-глутамілтранспептидазою (γ-GT), цистеїнілгліциназа (CGase), і N-ацетилтрансфераза (AT) створити N-кон'югати ацетилцистеїну (меркаптурні кислоти)
Кілька епідеміологічних та фармакологічних досліджень продемонстрували, що глюкозинолати та продукти їх розпаду, ізотіоціанати, можуть зменшити ризик канцерогенезу та окремих захворювань людини [14]. Ізотіоціанати з дієтичних овочів, які в даний час досліджуються для використання в якості хіміопрофілактичних засобів, включають SFN з брокколі, цвітної капусти та капусти, PEITC з крес-салату, редьки та ріпи, алілізотіоціанат (AITC) з капусти, гірчиці та хрону, бензил-ізотіоціанат (BITC), 3-метилсульфінілпропіл (іберин) з брокколі, брюссельської капусти та капусти, 4-метилтіобутил з руколи та 3-метилтіопропіл з капусти [13]. Подібним чином, індол I3C, який під впливом шлункової кислоти зазнає самоконденсації з утворенням DIM, також присутній у хрестоцвітних овочах, включаючи брокколі, капусту, цвітну капусту, брюссельську капусту, зелень та капусту і використовується як хіміопрофілактичний засіб [23 ].
Після прийому всередину ізотіоціанати всмоктуються з шлунково-кишкового тракту шляхом пасивної дифузії в капілярну мережу крові, оборотно зв’язуючись із вільними білками тіолів плазми (білок тіокарбамоїлювання) та перетинаючи плазматичну мембрану в клітини тканин [20]. Таким чином, ізотіоціанати метаболізуються за допомогою меркаптурної кислоти і спочатку кон’югуються з глутатіоном глутатіоном S-трансферази (GST) і послідовно розщеплюються γ-глутамілтранспептидазою (γ-GT), цистеїнілгліциназою (CGase) та N-ацетилтрансфераза (AT), створюючи N-кон'югати ацетилцистеїну (меркаптурні кислоти), які транспортуються в нирку і активно виділяються з сечею для виведення з організму [14] (рис. 1в).
Дієтичні похідні глюкозинолату та модуляція ферментів біотрансформації фази I та фази II
Хіміопрофілактична дія природних дієтичних похідних глюкозинолатів при раку, індукованому опосередкованим Nrf2 антиоксидантним стресом та протизапальними сигнальними шляхами
Дієтичні похідні глюкозинолату та модуляція запалення
Ядерний фактор-каппа-B (NF-κB) є фактором транскрипції та ключовим молекулярним зв'язком між запаленням та раком, який регулює кілька генів, продукти яких пригнічують апоптоз та підсилюють прогресування клітинного циклу, ангіогенез та метастазування [52, 59]. Крім того, значна кількість генів-мішеней NF-κB кодує медіатори вродженої імунної відповіді та запалення, які включають цитокіни, хемокіни, протеази, NOS2 та COX2 [52, 60]. У цьому контексті показано, що харчові похідні глюкозинолату інгібують процеси, опосередковані NF-κB, in vitro та in vivo, відіграючи важливу роль, оскільки NF-κB бере участь у експресії понад 500 генів, що беруть участь у захворюваннях людини, включаючи рак [15]., 61]. Таким чином, похідні глюкозинолату здатні інгібувати регульовані NF-κB шляхи, що ініціюються цими активаторами, блокуючи прозапальні сигнали на різних рівнях; однак молекулярні механізми, за допомогою яких здійснюються ці взаємодії, є складними і недостатньо вивченими [15, 61].
Було досліджено кілька клітинних мішеней похідних глюкозинолатів для модуляції сигнального шляху NF-κB. Наприклад, SFN здатний пригнічувати сигнальний каскад TLR4, впливаючи на ефективні ефекти MyD88, p38 мітоген-активовану протеїнкіназу (MAPK) та JNK, взаємодіючи з глутатіоном або іншими окислювально-відновними регуляторами, такими як тіоредоксин або Ref-1, які опосередковано здатний погіршити здатність до зв'язування ДНК NF-κB та безпосередньо зв'язувати основні тіолові групи p50, впливаючи на зв'язування ДНК NF-κB з потенційною участю регуляції Akt [15, 62, 63]. Крім того, описано, що DIM, PEITC та SFN пригнічують фосфорилювання IKK/IkB та ядерну транслокацію p65 NF-κB, інгібуючи транскрипційну активність NF-κB та впливаючи на такі важливі медіатори, як IL-6, iNOS, TNF-α та ЦОГ-2 [15, 64, 65]. Подібним чином, PEITC також здатний знижувати рівень експресії білка iNOS і COX-2, що призводить до зниження експресії обох прозапальних медіаторів, а також повідомляється, що пригнічує фосфорилювання інтерферонового регуляторного фактора 3 (IRF3), викликаний стимуляцією Toll-подібний рецептор, який зменшує активацію інтерферонів I типу (ІФН) та ІФН-індукованих генів [13, 66].
Харчові похідні глюкозинолату та епігенетичні механізми, що модулюють канцерогенез, запалення та реактивні види кисню
Епігенетична регуляція включає модифікації ДНК без змін послідовності, що призводять до змін у експресії генів або фенотипі [31]. Нещодавно велика кількість доказів продемонструвала, що епігенетичні зміни, такі як метилювання ДНК, модифікація гістонів та некодуючі мікроРНК, постійно сприяють канцерогенезу, а складові в раціоні, включаючи похідні глюкозинолатів, мають потенціал змінити ряд цих епігенетичних подій [15, 18, 26]. Хоча більшість досліджень клітинного впливу харчових похідних глюкозинолатів головним чином зосереджувались на детоксикаційних ефектах ферментів, все більше доказів продемонстрували хіміопрофілактичний вплив харчових похідних глюкозинолатів на регуляцію замовчуваних генів при раку.
Цікаво, що Вонг та ін. описав загальногеномні ефекти SFN та DIM на метилювання промоторів у нормальних клітинах епітелію простати та клітинах раку простати [11 ••]. Відповідно, лікування як SFN, так і DIM зменшувало експресію DNMT у нормальних клітинах епітелію передміхурової залози (PrEC) та андроген-залежних (LnCAP) та андроген-незалежних (PC3) клітинах раку простати. Зокрема, SFN та DIM змінили метилювання промотору в різних наборах генів у нормальних епітеліальних клітинах простати та клітинах раку простати; однак вони поділили подібні генні мішені в одній клітинній лінії, змінивши багато пов'язаних з раком змін метилювання, включаючи аберативно метильовані гени, які не регулюються під час прогресування раку (наприклад, міграція клітин, адгезія клітин, сигналізація клітинних клітин та регуляція транскрипції). ).
Модифікації гістонів були загальновизнаними як критично важливі чинники приглушення генів за допомогою посттрансляційних модифікацій гістонів на аміно-кінцевих хвостах [26]. Наприклад, відкритий стан хроматину та активація гена опосередковані ацетилтрансферазами гітону (HAT), які переносять ацетильні групи в ε-аміногрупу залишків лізину в хвостох частинах гістону, тоді як конденсований стан хроматину та відповідне мовчання генів зазвичай регулюються Ферменти HDAC, які видаляють ацетильні групи гістону, каталізуючи їх перехід до коферменту А (CoA) [26, 103]. Подібним чином, метилювання гістону залишків лізину та аргініну, опосередкованого гистоновими метилтрансферазами (HMT) та деметилазами (HDM), також було описано як механізм, що активує або пригнічує експресію генів при різних формах раку [15, 104]. Наприклад, метилювання H3K4, H3K36 і H3K79 було пов'язане з транскрипційно активним хроматином, тоді як метилювання H3K9, H3K27 та H4K20 було пов'язано з репресованим транскрипцією хроматином, складаючи два найважливіших механізми глушіння в клітинах ссавців [26, 105 ].
Ці результати також спостерігалися в інших увічнених клітинах шкіри та трансформованих клітинних лініях. На відміну від цього, повідомлялося, що DIM значно зменшує експресію білка HDAC2, але не експресію HDAC1, HDAC3, HDAC4, HDAC6 або HDAC8 у андроген-нечутливих РС-3 та андроген-чутливих LNCaP клітинних лініях раку простати [106]. Цікаво, що в тому ж дослідженні спостерігалося, що лікування I3C незначно пригнічує активність HDAC у клітинах LNCaP без інгібування HDAC у клітинах PC-3. Подібним чином було показано, що DIM пригнічує експресію білків HDAC2 та HDAC3 у клітинах TRAMP-C1 із супутнім збільшенням апоптозу, зменшенням проліферації клітин та посиленою експресією Nrf2 та Nrf2-гена NQO1 у тканинах передміхурової залози [83]. DIM може селективно викликати опосередковану протеасомами деградацію деацетилаз гістону класу I (HDAC1, HDAC2, HDAC3 та HDAC8), не впливаючи на білки HDAC класу II у клітинах раку товстої кишки людини in vitro та in vivo в ксенотрансплантатах пухлини [94]. Таким чином, виснаження HDAC було пов’язане з індукцією пошкодження ДНК, що спричинило апоптоз.
Дієтичні похідні глюкозинолату: Дослідження in vivo
Природні глюкозинолати та продукти їх розпаду широко використовувались як хіміопрофілактичні засоби в дослідженнях in vivo, включаючи хімічно індуковані моделі раку на гризунах та розвиток раку, зумовлений онкогеном, у трансгенних мишей [110]. Основні дослідження, що документують хіміопрофілактику раку глюкозинолатами при хімічно індукованому раці гризунів та моделях трансгенних мишей, зведені в таблицю 2. Наприклад, ми показали, що місцеве застосування SFN зменшує частоту індукованих DMBA/TPA пухлин шкіри у Nrf2 (+/+ ) миші дикого типу (Nrf2 WT), але не у мишей Nrf2 KO, оброблених сульфорафаном, демонструючи, що хіміопрофілактичний ефект SFN при індукованих DMBA/TPA пухлинах шкіри опосередковується Nrf2 [44]. Подібним чином, інгібування пухлинного розвитку шкіри також спостерігалось із використанням SFN при хімічно індукованому раку шкіри у мишей CD-1 під час стадії просування [111]. На відміну від цього, ми також повідомляли, що лікування SFN у мишей ApcMin/+ веде до регуляції різних наборів генів, що беруть участь в апоптозі, зростанні/підтримці клітин та запаленні у поліпах тонкої кишки, як виявлено за допомогою аналізу профілю експресії генів за допомогою мікрочипів Affymetrix [112 ].
Незважаючи на те, що було проведено великі дослідження дієтичних фітохімікатів, що сприяють загальному розумінню похідних глюкозинолатів з точки зору їх хімічних та біологічних функцій та сприятливого впливу на здоров'я людини, клінічних досліджень учасників людської діяльності щодо біологічних ефектів дієтичного глюкозинолату не вистачає і обмежується визначенням вплив сирих хрестоцвітних овочів або їх екстрактів при деяких біологічних параметрах [110, 124]. Наприклад, описано інгібуючу дію крес-салату на окислювальний метаболізм 4- (метилнітрозаміно) -1- (3-піридил) -1-бутанону в клітинах периферичної крові учасників [125]. Аналогічним чином, рандомізоване та контрольоване плацебо дослідження з використанням напою, напоєного паростками брокколі, виявило зворотну зв'язок між екскрецією дитиокарбаматів та аддуктами афлатоксину-ДНК із сечею [126]. Подібним чином споживання паростків брокколі знижувало активність гистондеацетилази в мононуклеарних клітинах периферичної крові у людей [88].
На сьогодні зареєстровано 31 клінічне дослідження з використанням SFN (www.clinicaltrials.gov; дата звернення 22 жовтня 2014 р.). З цих досліджень було завершено десять та повідомлено дані пацієнтів, які лікувалися раком передміхурової залози та молочної залози, серцево-судинними захворюваннями, імунними захворюваннями та аутизмом. Подібним чином, PEITC, який мав менше зареєстрованих досліджень, включає одне з чотирьох досліджень, проведених для запобігання раку легенів у осіб, які палять. Завершено чотири дослідження з семи зареєстрованих для лікування 3IC для пацієнтів з раком передміхурової залози та молочної залози, а також спеціальне дослідження з профілактики раку у здорових учасників. Нарешті, завершено чотири дослідження з десяти зареєстрованих на DIM для пацієнтів, які лікуються раком простати та шийки матки, а також конкретні дослідження профілактики раку у здорових учасників. Підводячи підсумок, ці висновки свідчать про те, що харчові похідні глюкозинолату можна широко використовувати в подальших проспективних епідеміологічних та хіміопрофілактичних дослідженнях.
Висновки та перспективи на майбутнє
- Підкислення в їжі покращує засвоюваність фосфору, але зменшує експресію H K -ATP-ази у
- Характеристики дотримання дієти та втручання - ScienceDirect
- Коригування дієти та харчова терапія під час лікування ротоглоткової дисфагії
- Дієтичний аргінін стимулює гуморальний та опосередкований клітинами імунітет у курей, яким щеплені та
- Споживання дієтичних антиоксидантів у шкільному віці та розвитку функції легенів аж до підліткового віку