Дієта з обмеженим вмістом білка під час вагітності після запліднення змінює поведінкові фенотипи нащадків
Анотація
Передумови
Епідеміологічні дослідження показують, що гіпотрофія у внутрішньоутробний період підвищує ризик психічних розладів, таких як синдром гіперактивності з дефіцитом уваги та розлад аутистичного спектра, що було експериментально підтверджено з використанням моделей на тваринах. Однак попередні експериментальні дієти з недостатнім харчуванням або з обмеженим вмістом білка (PR) впливали на інші етапи, окрім стадії плода, такі як формування яйцеклітини перед заплідненням, склад молока під час лактації та поведінка годування матері.
Результати
Ми провели запліднення in vitro та перенесення ембріонів на мишах і дозволили дієті PR та фолієвій кислоті, яка доповнює фолієву кислоту, впливати лише на середовище плода. Комплексне фенотипування нащадків PR та контрольної дієти продемонструвало помірні відмінності у поведінці страху/тривоги, пошуку новизни та просоціальної поведінки, незалежно від добавок фолієвої кислоти. Також були виявлені зміни в експресії генів та генетичному метилюванні в мозку.
Висновки
Ці результати дозволяють припустити, що епігенетичні фактори ембріона/плода впливають на поведінкові та епігенетичні фенотипи потомків. У цьому дослідженні спостерігалися значні епігенетичні зміни в мозку нащадків, викликані обмеженням материнського білка. Наскільки нам відомо, це перше дослідження з оцінки впливу гіпотрофії матері на поведінкові фенотипи за допомогою репродуктивних технологій.
Передумови
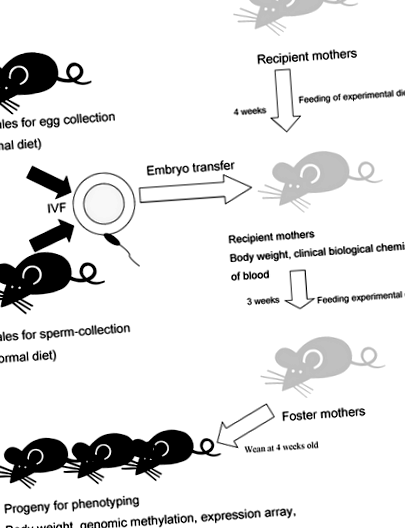
Однак дієта PR для матері впливає не тільки на середовище плода, а й на формування яйцеклітини перед заплідненням, стан харчування материнського молока та поведінку годувальниці, і тому вона може змішувати різні показники на різних етапах. У цьому дослідженні ми провели запліднення in vitro (ЕКО) для народження новонароджених, а потім отримали нащадків, усиновлених прийомними матерями до відлучення. Це дозволило дієті PR впливати лише на стадію розвитку плода.
Методи
Заява про етику експериментів на тваринах
Всі описані тут процедури були розглянуті та схвалені Інституційним комітетом з догляду та використання тварин філії Цукуба РІКЕН і виконувались відповідно до Керівних принципів догляду та використання лабораторних тварин РІКЕН (№ 10-013).
Експериментальний дизайн
Експериментальна стратегія. Коротко описана експериментальна конструкція цього дослідження. Звичайна дієта (CE-2) годувалася жінками, які використовувались для збору ооцитів, і самцями, які використовувались для збору сперми. Матері-реципієнтки споживали контрольну дієту (CD) або експериментальну дієту (PR та FA) протягом 1 місяця перед перенесенням ембріонів. Ембріони генерували заплідненням яєць спермою мишей C57BL/6J (B6). Після пологів за допомогою кесаревого розтину новонароджених робили вихованці ICR, які споживали дієти на CD, PR або FA. Після відлучення нащадків споживали контрольну дієту (CD). Сироватку відокремлювали від крові, взятої у жінок ICR. Мозкову тканину збирали у нащадків після поведінкових тестів
Експериментальні дієти
CD був дуже схожий на стандартну форму AIN93G [15]. Тестові дієти були модифіковані з рецептури AIN93G наступним чином: PR, співвідношення безвітамінного казеїну зменшилось з 20 до 5%; FA, 0,8 г/кг фолієвої кислоти додавали до PR (табл. 1). CD і PR містили 0,02% фолієвої кислоти (ваговий склад), а FA - 0,1% фолієвої кислоти (ваговий склад). Експериментальні дієти були придбані у комерційного постачальника (Oriental Yeast Co. Ltd, Токіо, Японія). Ці дієти були ізокалорійними (4 ккал/г у кожному кормі) і годувались матерями-реципієнтами за бажанням. Крім того, прийомним матерям за вигодою годували лише дієту на CD.
Усі миші, які використовувались як матері-реципієнтки та прийомні мами, а також для збору яйцеклітини та сперми, були придбані у комерційного постачальника (CLEA Japan, Inc.).
Запліднення in vitro та перенесення ембріонів
Клініко-біохімічний тест
Ми провели клініко-біохімічний тест із використанням сироватки, відібраної у жінок ICR у віці 13 тижнів. Миші споживали експериментальну дієту протягом 7 тижнів. Забір крові, відділення сироватки та аналіз проводили, як описано раніше [20]. Коротше кажучи, ми зібрали 200 мкл крові з ретро-орбітальної пазухи за допомогою піпетки Пастера (Thermo Fisher Scientific Inc., Waltham, MA). Зібрану кров переносили в мікропробірку, що містить розчин коагулянта Вако (Wako Pure Chemical Industries Co, Осака, Японія), а сироватку відокремлювали центрифугуванням двічі (600–2500 ×g протягом 5–15 хв). Ми вимірювали загальний білок (TP), азот сечовини (UN), альбумін (ALB), загальний холестерин (T-CHO), HDL-холестерин (HDL-C), тригліцериди (TG) та LDL-холестерин (LD-C) в сироватці з автоматичним клініко-біохімічним аналізатором (JCA-BM2250, JEOL, Ltd., Токіо, Японія). Кількість предметів: CD, 7; PR, 7; FA, 6.
Вилучення ДНК/РНК
Ми збирали цілий мозок у дорослих чоловічих нащадків (віком 19 тижнів), які використовувались у поведінкових аналізах, аналізах метилювання та масивах експресії. Дорослі самці були евтаназовані через вивих шийки матки. Зразки мозку промивали PBS і негайно заморожували з використанням рідкого азоту. Заморожені тканини зберігали при -80 ° C. РНК і ДНК витягували одночасно за допомогою AllPrep ДНК/РНК Mini Kit (Qiagen, Валенсія, Каліфорнія, США) із цілого мозку, включаючи мозок та мозочок. Потім ми провели масиви метилювання та експресії генів, як описано нижче.
Геномне метилювання
Аналіз метилювання ДНК на рівні генома проводили, як повідомлялося раніше, з невеликими змінами [21]. Геномна ДНК була фрагментована нечутливими до метилювання ферментами рестрикції (MseЯ, BfaЯ і CSP6I), щоб отримати фрагменти розміром від 200 до 1000 пар основ. Збагачення метильованої ДНК проводили за допомогою набору для збагачення метильованої ДНК MethylMiner (Thermo Fisher Scientific Inc.). Коротко, CpG-щільна метильована ДНК була виділена з фрагментованої геномної ДНК шляхом зв'язування з домом метил-CpG білка MBD2, який з'єднаний з парамагнітним стрептавідином Dynabeads M-280 за допомогою біотинного лінкера. Частину фрагментованої ДНК (вхід) не обробляли і використовували як контроль. ДНК ампліфікували та очищали за допомогою комплекту GenomePlex Complete Whole Genome Amplification (WGA) та набору для очищення PCE GenElute (Sigma-Aldrich St. Louis, MO, USA). Для аналізу геномного метилювання ми використовували Mouse Promoter 1.0R Array (Affymetrix) проти метильованої (IP) та вхідної ДНК (IN). Кількість предметів: CD, 3; PR, 4; ФА, 4.
Вираження масиву
Експресійний аналіз за допомогою мікрочипів ДНК проводили за допомогою системи Agilent (G4846A; Комплект мікрочипів цілого мишачого геному (4x44K) Agilent Technologies, Санта-Клара, Каліфорнія, США). Зонди для мікрочипів були підготовлені та марковані Cy3 відповідно до протоколу виробника (Agilent Technologies). Масиви сканували за допомогою системи сканерів мікрочипів G2505C (Agilent Technologies). Дані були нормалізовані за допомогою Р. пакет stats з функцією qspline пакету “affy” в біопровіднику [22].
Дійсність даних метилювання та масиву виразів
Результати аналізу масивів метилювання були підтверджені в попередніх дослідженнях [21, 23]. У цих дослідженнях дані кількісної оцінки метилювання на основі масивів показали сильну відповідність результатам, отриманим в результаті послідовності бісульфітів (р = 0,81 - 0,88) [21, 24]. Крім того, дані масиву виразів також були перевірені в попередніх дослідженнях. Дані виразів, отримані одноколірною платформою мікрочипів, показали сильну відповідність аналізу TaqMan (р = 0,876) у масштабному проекті контролю якості мікрочипів [25].
Наявність даних
Дані масиву експресії та метилювання були депоновані в омнібусі експресії гена NCBI (http://www.ncbi.nlm.nih.gov/geo/), а номери приєднання наборів даних такі: GSE79847.
Тести поведінки
Ми провели такі поведінкові тести: тест на відкритому полі (6-тижневий вік), тест на дослідження об’єкта (7-тижневий вік), тест на соціальну взаємодію (8-тижневий вік), тест активності в клітці будинку (9 до 10-тижневого віку), тест на перехід світла/темряви (11-тижневий вік), тест на кондиціювання страху (12-тижневий вік) та тест на підвішування хвоста (вік 13 тижнів). Результати поведінкових тестів чутливі до попереднього досвіду [26]. Щоб придушити наслідки попереднього досвіду, поведінкові тести проводили в порядку меншої стимуляції, як описано вище. Ми використовували мишей-самців для поведінкових тестів, щоб усунути наслідки еструального циклу у самок. Кількість предметів: CD, 10; PR, 10; ФА, 7.
Випробування на відкритому полі
Випробування на відкритому полі проводили, як описано раніше [27]. Кожну мишу поміщали в кут апарату на відкритому полі (шириною 400 мм × 400 мм завдовжки × 300 мм заввишки; O’Hara & Co., Ltd., Токіо, Японія), виготовленого з білого полівінілхлориду. Відстань, яку подолала кожна тварина у відкритому полі, реєстрували протягом 20 хв за допомогою системи відеозображення (Image OF9; O’Hara & Co., Ltd.).
Об’єктно-дослідний тест
Ми провели тест на дослідження об’єкта, як описано раніше [27]. Коротко кажучи, кожну мишу поміщали в апарат на відкритому полі без нового об'єкта на 20 хв аклімації перед тестуванням. Прозора акрилова трубка (нижній діаметр 66 мм; верхній діаметр 44 мм; висота 154 мм), що містить мармур, була розміщена в центрі відкритого поля. Загальний час, витрачений на дослідження об’єкта, і частоту дослідження протягом 10 хв визначали за допомогою комерційної системи відеозображення (O’Hara & Co., Ltd.). Розвідка визначалася як відстань
Результати
Вага тіла та параметри, пов’язані з білками матерів-реципієнтів
Вплив обмеження материнського білка на поведінкові фенотипи потомства
У сукупності ці результати дозволяють припустити, що PR-дієта у матерів-реципієнтів, незалежно від прийому ФА, підвищує сприйнятливість до страху/занепокоєння, пошуку новинок та просоціальної поведінки потомків.
Вплив обмеження білка на епігенетичні зміни
Обговорення
У цьому дослідженні ми дослідили вплив гіпотрофії матерів через дієту для PR на розвиток та психічні розлади нащадків шляхом всебічного фенотипування поведінки. Обстеження включало сім різних аналізів на страх/тривогу, пошук новин та просоціальну поведінку, а також інші, які можуть бути пов'язані з поведінкою, подібною до AD/HD та ASD. Ми виявили суттєві відмінності в аналізах на подібні до страху/тривоги, пошуку новинок та просоціальної поведінки, що свідчить про те, що фактори навколишнього середовища в ембріоні/плоді відіграють важливу роль у сприйнятливості потомків до цієї поведінки. Це може бути паралельно епідеміологічним дослідженням, які показують, що фактори навколишнього середовища чи харчування впливають на поведінкові симптоми AD/HD [32] та ASD [33].
Як і в попередньому дослідженні [9], в цьому дослідженні для поведінкових тестів використовувались лише миші чоловічої статі, щоб усунути фенотипічні варіації у самок мишей, спричинені десинхронізацією естрального циклу. Миша В6 виявляє статеві диморфізми у кількох поведінкових фенотипах, включаючи рухову функцію в тесті ротароду, навчання та пам’ять у тесті морського лабіринту Морріса та тесті кондиціонування страху, а також рухову активність у тесті на відкритому полі [43]. Помірний вплив обмеження материнського білка на поведінкові фенотипи потомків, що спостерігаються у цьому дослідженні, може бути гендерно-специфічним явищем.
Рівні метилювання промоторів у цих генах не корелювали з рівнями експресії генів. У цьому дослідженні чітко спостерігались епігенетичні зміни в мозку нащадків, викликані обмеженням материнського білка. Причинний зв’язок між епігенетичними та поведінковими змінами ще слід дослідити.
Результати цього дослідження дозволяють припустити, що хоча обмеження материнського білка під час вагітності є помірним фактором ризику розвитку або психічних розладів нащадків, це може бути підтверджено взаємодією з генетичними факторами, включаючи специфічні мутації або генетичні варіації. Крім того, ефекти попереднього запліднення та постнатального/лактаційного гіпоживлення матері можуть суттєво сприяти фенотипу.
Щоб перевірити цю гіпотезу, може знадобитися вивчити вплив гіпонутрійного впливу у внутрішньоутробному періоді на відомі моделі розладів розвитку, такі як моделі AD/HD та ASD, або інші штами мишей, та з'ясувати адитивні наслідки або взаємодію для поведінкових фенотипів.
Висновки
PR-група виявляла поведінку, пов'язану зі страхом/тривогою, та неуважність до нового об'єкта чи нової миші більше, ніж у групи контрольної дієти. Як і слід було очікувати, мозок дорослих з групи PR демонстрував відмінності в закономірностях аналізу масивів експресії та геномного метилювання.
Фактори зовнішнього середовища ембріона/плода відіграють важливу роль у сприйнятливості до змін поведінки потомків. Це дослідження, наскільки нам відомо, першим, хто оцінює вплив гіпотрофії матері на поведінкові фенотипи за допомогою репродуктивних технологій.
Скорочення
Витоки здоров’я та захворювання
- Дієта після пологів, чому ми дієтуємо після вагітності
- Дієта під час вагітності
- Дієта під час вагітності - що їсти Гейзінгер
- Вивчіть протокол диференціального впливу дієти та втручань на основі фізичної активності під час вагітності
- Міфи про дієту під час вагітності проти