Дієта з низьким вмістом вуглеводів для лікування гестаційного цукрового діабету
Крістіна Морено-Кастилія
1 Кафедра ендокринології та харчування, лікарня Університету Арнау де Віланова, Ллейда, Іспанія
2 Медичний факультет, Університет м. Лейда, м. Лейда, Іспанія
Марта Ернандес
1 Кафедра ендокринології та харчування, лікарня Університету Арнау де Віланова, Ллейда, Іспанія
2 Медичний факультет, Університет м. Лейда, м. Лейда, Іспанія
3 Institut de Recerca Biomedica de Lleida, Ллейда, Іспанія
Мерсе Бергуа
1 Кафедра ендокринології та харчування, лікарня Університету Арнау де Віланова, Ллейда, Іспанія
2 Медичний факультет, Університет м. Лейда, м. Лейда, Іспанія
Марія С. Альварес
1 Кафедра ендокринології та харчування, лікарня Університету Арнау де Віланова, Ллейда, Іспанія
Марія А. Арсе
1 Кафедра ендокринології та харчування, лікарня Університету Арнау де Віланова, Ллейда, Іспанія
Карен Родрігес
1 Кафедра ендокринології та харчування, лікарня Університету Арнау де Віланова, Ллейда, Іспанія
3 Institut de Recerca Biomedica de Lleida, Ллейда, Іспанія
Монтсеррат Мартінес-Алонсо
3 Institut de Recerca Biomedica de Lleida, Ллейда, Іспанія
4 Кафедра основних медичних наук, Університет м. Лейда, м. Лейда, Іспанія
Монтсеррат Іглесіас
1 Кафедра ендокринології та харчування, лікарня Університету Арнау де Віланова, Ллейда, Іспанія
Магдалина Матеу
1 Кафедра ендокринології та харчування, лікарня Університету Арнау де Віланова, Ллейда, Іспанія
Марія Д. Сантос
1 Кафедра ендокринології та харчування, лікарня Університету Арнау де Віланова, Ллейда, Іспанія
2 Медичний факультет, Університет м. Лейда, м. Лейда, Іспанія
3 Institut de Recerca Biomedica de Lleida, Ллейда, Іспанія
Лінда Р. Пачеко
1 Кафедра ендокринології та харчування, лікарня Університету Арнау де Віланова, Ллейда, Іспанія
3 Institut de Recerca Biomedica de Lleida, Ллейда, Іспанія
Йоланда Бласко
1 Кафедра ендокринології та харчування, лікарня Університету Арнау де Віланова, Ллейда, Іспанія
Єва Мартін
1 Кафедра ендокринології та харчування, лікарня Університету Арнау де Віланова, Ллейда, Іспанія
Нурія Бальселлс
1 Кафедра ендокринології та харчування, лікарня Університету Арнау де Віланова, Ллейда, Іспанія
Нурія Аранда
5 Unitat de Salut Publica i Nutricio, Universitat Rovira i Virgili, Institut d’Investigació Sanitària Pere Virgili, Реус, Іспанія
Дідак Маурісіо
1 Кафедра ендокринології та харчування, лікарня Університету Арнау де Віланова, Ллейда, Іспанія
2 Медичний факультет, Університет м. Лейда, м. Лейда, Іспанія
3 Institut de Recerca Biomedica de Lleida, Ллейда, Іспанія
Анотація
МЕТА
Лікувальна дієтотерапія, заснована на контролі кількості та розподілу вуглеводів (CHO), є початковим методом лікування гестаційного цукрового діабету (GDM), але існує потреба у рандомізованих контрольованих дослідженнях, що порівнюють різні дієтичні стратегії. Метою цього дослідження було перевірити гіпотезу, згідно з якою дієта з низьким вмістом СНО для лікування ГРМ призведе до нижчого рівня лікування інсуліном із подібними результатами вагітності порівняно з контрольною дієтою.
ДИЗАЙН ДИЗАЙН І МЕТОДИ
Загалом 152 жінки з ГДМ були включені в це відкрите, рандомізоване контрольоване дослідження і їм було призначено дотримуватися дієти з низьким вмістом СНО (40% від загального вмісту енергії в раціоні як СНО) або контрольної дієти (55% від загальної кількості дієтичний вміст енергії як CHO). Споживання CHO оцінювали за 3-денними записами про їжу. Також були оцінені основні результати вагітності.
РЕЗУЛЬТАТИ
Частота жінок, які потребували інсуліну, суттєво не відрізнялася між групами лікування (низький рівень СНО 54,7% проти контролю 54,7%; Р = 1). Щоденні записи про їжу підтверджували різницю в кількості споживаної СНО між групами (Р = 0,0001). Не виявлено відмінностей у акушерських та перинатальних результатах між групами лікування.
ВИСНОВКИ
Лікування жінок із ГРМ за допомогою дієти з низьким вмістом СНО не призвело до зменшення кількості жінок, які потребують інсуліну, і призвело до подібних результатів вагітності. У GDM кількість CHO (40 проти 55% калорій) не впливала на потребу в інсуліні та результати вагітності.
Гестаційний цукровий діабет (GDM) визначається як непереносимість глюкози з її настанням або першим розпізнаванням під час вагітності. Поширеність GDM становить ~ 7% (від 1 до 14%), залежно від популяції та використовуваних діагностичних критеріїв (1). В Іспанії загальна поширеність GDM становить 8,8% (2). GDM асоціюється із збільшенням ускладнень у матері та новонароджених під час вагітності (3).
Лікувальна дієтотерапія (МНТ) є наріжним каменем лікування ГДМ і заснована на контролі кількості та розподілу вуглеводів (СНО) для отримання оптимального контролю глікемії без кетозу. Вміст енергії також важливий для відповідного збільшення ваги вагітних. Для загальної популяції CHO повинен становити 45–65% від загальної добової калорійності, а щоденне споживання> 175 г CHO для вагітних (4). Це споживання найкраще розподіляти на три прийоми їжі та від двох до чотирьох перекусів (5). Хоча контроль кількості та типу СНО широко використовується для оптимізації концентрації глюкози в крові, інші методи також важливі для управління ГДМ. Це включало введення вибору здорової їжі, контроль порцій, практику приготування їжі та регулярні фізичні навантаження (6).
В Іспанії клінічні рекомендації стверджують, що якщо рівень глюкози в крові не контролюється за допомогою МНТ, то слід розпочати лікування інсуліном. MNT - це засіб для зниження значень глюкози в крові після їжі, або шляхом зміни розподілу СНО, або шляхом зміни будь-якого з компонентів глікемічного навантаження (ГЛ) (добуток вмісту СНО в порції їжі та її глікемічного індексу [ГІ]) . За останні роки було опубліковано два рандомізованих контрольованих дослідження (RCT) щодо впливу дієт із низьким вмістом шлунково-кишкового тракту на GDM. Мойсей та ін. (7) продемонстрували значно нижчу частку жінок, які відповідають критеріям для початку лікування інсуліном при призначенні дієти з низьким рівнем шлунково-кишкового тракту, без будь-яких відмінностей у ключових акушерських та фетальних результатах. Луї та ін. (8) не виявили жодних відмінностей у необхідності лікування інсуліном, з однаковими результатами вагітності, у жінок, які дотримувались дієти із помірним зниженням шлунково-кишкового тракту, ніж контрольна група, яка отримувала дієту з помірним вмістом шлунково-кишкового тракту.
У наших умовах MNT для GDM в основному базується на контролі кількості та розподілу CHO, а не на контролі GI. Наскільки нам відомо, не існує РКД, які демонструють перевагу дієти з попередньо визначеною кількістю СНО. Американська діабетична асоціація на п’ятій міжнародній семінарі-практикумі з гестаційного цукрового діабету рекомендувала проводити дослідницькі дослідження в цій галузі (6).
Ми провели РКД, щоб оцінити, чи може дієта з низьким вмістом СНО (40% калорій) порівняно з контрольною дієтою (55% калорій) зменшити потребу в лікуванні інсуліном у жінок із ГДМ без збільшення несприятливих наслідків вагітності.
ДИЗАЙН ДИЗАЙН І МЕТОДИ
Дослідження було відкритим, паралельним, рандомізованим контрольованим дослідженням з двома групами, що порівнювало два дієтичні втручання, призначені для лікування ГДМ. Участь у випробуванні була запропонована всім жінкам з діагнозом ГРМ в єдиній амбулаторії діабету та вагітності в довідковій лікарні системи охорони здоров’я провінції Лейда (Каталонія, північний схід Іспанії) у період з листопада 2008 року по липень 2011 року.
Набір та рандомізація предметів
Критеріями включення були жінки у віці 18–45 років (включно) з діагнозом ГРМ із одноплідною вагітністю та гестаційним віком ≤35 тижнів. Критеріями виключення були небажання дотримуватися встановленої дієти, нездатність розуміти іспанську мову та супутні захворювання під час вагітності, крім ожиріння, гіпертонії та/або дисліпідемії.
Діагноз GDM був поставлений відповідно до Національних клінічних рекомендацій щодо діабету та вагітності 2006 року. В Іспанії всіх жінок обстежують на ГДМ на 24-28 тижнях вагітності за допомогою 50-г тест на глюкозу. Якщо є фактори ризику GDM, скринінговий тест проводиться в першому триместрі. Якщо 1-годинне значення глюкози скринінгового тесту становить ≥7,8 ммоль/л, пацієнтові призначено 100-г тест на глюкозу, а діагноз ГРМ ставиться відповідно до критеріїв Національної групи діабету (2,9).
Участь у випробуванні була запропонована всім жінкам на першому амбулаторному прийомі. У період з листопада 2008 року по липень 2011 року 152 пацієнти були рандомізовані в одну з двох груп лікування. Груповий розподіл проводився за допомогою запечатаного конверта. З 313 пацієнтів, оцінених на відповідність вимогам, 161 було виключено, оскільки вони не відповідали критеріям включення (n = 128) або відмовились брати участь (n = 33) (Додаткова Рис. 1).
Місцевий комітет з питань етики схвалив протокол, і всі пацієнти підписали письмову форму інформованої згоди.
Догляд за пацієнтами та спостереження
Учасники отримували плановий догляд з боку лікувальної групи відповідно до інституційного протоколу, який базувався на місцевих та національних рекомендаціях. Пацієнтів спостерігали через 1 тиждень після розподілу досліджень, після чого відвідували кожні 1-3 тижні, залежно від клінічного судження.
Всім жінкам було надано глюкометр (Accu-Chek Aviva; Roche Diagnostics SL, Барселона, Іспанія) та доручено проводити самоконтроль рівня глюкози в крові (SMBG). Пацієнтам також було наказано реєструвати результати SMBG за такою схемою: шість контрольних контролів на день протягом першого тижня (до і через 1 годину після трьох основних прийомів їжі) і, якщо значення глюкози були цільовими, чотири контрольні контрольні групи на день протягом решта спостереження (натщесерце та через 1 год після трьох основних прийомів їжі). Кетонурія проводила самоконтроль щодня перед сніданком та раз на тиждень перед обідом та вечерею за допомогою напівкількісного методу (Keto-Diastix; Quimica Farmaceutica Bayer SL, Барселона, Іспанія). За повідомленнями виробника, результати оцінки кетонів сечі були відсутні, легкі (1+), помірні (2+) або високі (3+). За винятком різних дієтичних процедур, всі інші стратегії управління були однаковими для обох груп.
Дієтичні втручання
Енергетичний вміст дієти для кожного пацієнта розраховували, виходячи з ваги, що передує вагітності (Додаткова таблиця 1) з мінімум 1800 ккал/день. Дві досліджувані дієти мали схожий вміст білка (20% від загальної добової кількості калорій), але різну кількість СНО (40% у дієті з низьким вмістом СНО та 55% у контрольній дієті) та жиру (40% у низько Дієта CHO та 25% у контрольній дієті, головним чином за рахунок збільшення споживання оливкової олії). Команда дієтологів розробила конкретні дієти вручну для цілей дослідження (Додаткова таблиця 2). Дієти були розділені на три основних прийоми їжі та три перекуси, всі із зазначеною кількістю порцій CHO. Жодних змін у розподілі СНО не дозволялося, поки пацієнт знаходився на самому дієтотерапії. Після початку інсуліну можна було б внести зміни в розподіл СНО для оптимізації лікування інсуліном, оскільки пацієнти вже досягли первинного результату дослідження.
Харчовий аналіз та оцінка відповідності
Споживання CHO оцінювали за методом розрахункової оцінки їжі протягом 3 послідовних днів, включаючи вихідні або святкові дні (10). Всім жінкам пропонували записати свій початковий прийом їжі, що містить СНО, за допомогою цього методу. Перша дієтична оцінка була зроблена після початкового пропису дієти, а друга оцінка відбулася після наступного призначення, на якому дієтичний план для пацієнта був переглянутий для дотримання. Цей метод був використаний через його технічну простоту та вартість. На інтерв'ю для дієти була використана книга з графічним зображенням порцій їжі (11). Один дієтолог, який був засліплений щодо розподілу груп пацієнтів, задокументував записи про їжу в окрему базу даних. Для оцінки загальної кількості СНО, крохмалю та цукру використовували дві таблиці складів їжі (12,13).
Інсулінотерапія
Рішення про початок лікування інсуліном було прийнято ендокринологом згідно з інституційним протоколом і дотримувалося суворих критеріїв: лікування інсуліном починали, якщо принаймні два значення SMBG одночасно в один день тижня в інтервалі від 1 тижня були вищими за цільові . Глікемічні цілі були такими: глікемія натще і перед їжею ≤5,3 ммоль/л та 1-годинна глікемія після їжі ≤7,8 ммоль/л. Регулярний людський інсулін використовували для лікування екскурсій після прийому глюкози (Actrapid Innolet; Novo Nordisk AS, Багсверд, Данія). Інсулін NPH перед сном призначався для корекції гіперглікемії натще (Insulatard Flexpen; Novo Nordisk AS). Початкові дози інсуліну розраховували згідно з додатковою таблицею 1.
Збір даних
Наступні дані оцінювали та реєстрували під час кожного наступного візиту: вага, кров’яний тиск, кількість результатів SMBG поза цільовими значеннями, доза інсуліну та кетонурія. Вага перед доставкою - це остання вага, зареєстрована в медичній картці протягом будь-якого з 4 тижнів, що передували пологам. Всі пологи відбувалися в нашій лікарні. Ускладнення вагітності, дані спостереження за УЗД та результати вагітності, включаючи вагу та довжину новонародженого з урахуванням терміну вагітності, виникнення гіпоглікемії новонароджених (гликемія 90-й центиль) за допомогою іспанських таблиць ваги новонароджених з урахуванням статі та терміну вагітності (14). Макросомію визначали як вагу при народженні ≥4 кг.
Розрахунок обсягу вибірки
На основі попередніх клінічних даних місцевої клініки ми встановили, що 40–50% пацієнтів із ГРМ не досягають бажаних концентрацій глюкози в крові, незважаючи на наступне дієтичне лікування, і згодом потребують інсулінотерапії. Ми розробили дослідження, щоб надати 80% статистичної потужності (двостороння довіра 95%), щоб знайти мінімальну різницю у 22% щодо ризику інсулінізації (45% - це очікуваний показник інсулінованих жінок у контрольній групі). Ми передбачали, що 10% пацієнтів будуть втрачені для подальшого спостереження. Розрахункова кількість пацієнтів для включення становила 152 (76 на групу).
Статистичний аналіз
Статистичний аналіз проводив біостатист, засліплений щодо розподілу дієти учасниками. До проведення основних аналізів порівняльні вихідні характеристики порівнювали між групами втручання та контрольної групи, щоб виявити потенційні незручності. Точний тест Фішера застосовували для оцінки відмінностей між обома дієтами у розподілі якісних змінних. Тест log-rank використовувався для оцінки відмінностей у розподілі часу до введення лікування інсуліном або дати доставки. Оцінку середнього часу споживання інсуліну разом із 95% ДІ розраховували окремо для кожної групи, якщо тест показав статистично значущу різницю. Для оцінки відмінностей кількісних змінних між двома групами, таких як доза інсуліну перед початком, збільшення ваги матері у порівнянні з першим відвідуванням та глікемія новонароджених, використовували тест Манна – Уітні. Тест Манна-Уітні також використовувався для оцінки відмінностей між обома групами в споживанні СНО, отриманих з 3-денних записів про їжу (загальна СНО, а також крохмалі та цукру окремо).
Аналіз намірів для лікування проводили з 95% ДІ та рівнем значимості 0,05. Весь статистичний аналіз проводився за допомогою програмного забезпечення R (версія 2.15.1) (15).
РЕЗУЛЬТАТИ
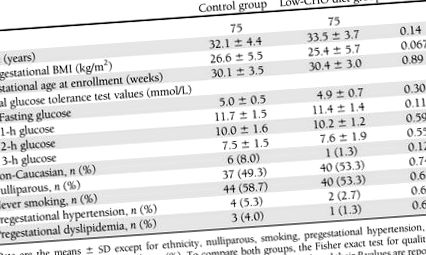
Загальний дизайн та тематика досліджень проілюстровано на додатковій фіг. 1. Загалом 152 жінки були випадковим чином призначені за однією з двох дієт, 76 у кожній групі. Однак один пацієнт, рандомізований до контрольної групи, відмовився від згоди перед тим, як отримати будь-яке дієтичне втручання. Після рандомізації ще один пацієнт із групи дієти з низьким вмістом СНО був виключений під час другого прийому через серйозне порушення протоколу (критерії включення/виключення: вагітність близнюками). Загалом 130 пацієнтів закінчили випробування. Як було показано в таблиці 1, не було значних відмінностей у базових характеристиках між цими двома групами .
Таблиця 1
Базові характеристики учасників дослідницької групи
Щодо основного результату дослідження, аналіз намірів для лікування показав, що сукупний показник лікування інсуліном становив 54,7% (41 жінка з 75) у контрольній групі та 54,7% (41 жінка з 75) у групі з низьким рівнем СНО дієтична група, без суттєвих відмінностей між групами (Р = 1). Цей результат залишався незмінним навіть після корекції гестаційного віку (відношення щільності захворюваності 1,06 [95% ДІ 0,69–1,63]; Р = 0,792). Аналіз основного результату в популяції, яка відповідала протоколу, показав, що не було відмінностей у кумулятивній швидкості лікування інсуліном між жінками, які закінчили дослідження на дієті з низьким вмістом СНО (38 жінок із 70; 54,3%) та контрольною групою (33 жінки 60; 55%) (Р = 1). Не було суттєвих відмінностей між двома групами щодо дози інсуліну та часу лікування інсуліном під час першого відвідування або під час останньої менструації (рис. 1).
- Гестаційний цукровий діабет у матері пов’язаний із тривалим дитячим офтальмологічним захворюванням
- Математична модель діабету та ліпідного обміну, пов’язана з дієтою, чутливістю до лептину, інсуліном
- Медичне схуднення, лікування розладів харчування, найкращий дієтолог з діабету у Філадельфії, Південь
- Дієта в середземноморському стилі може зменшити ризик ішемічного інсульту, нове дослідження - Diabetes Insider
- Книги Дженні Руль Діабет і дієта