Дієта, пов’язана із запаленням та хворобою Альцгеймера
Тип статті: Оглядова стаття
Філія: Біологічний факультет, Університет Ламар, Бомонт, Техас, США
Листування: [*] Листування: Маріам Васефі, асистент, кафедра біології, Університет Ламар, Будівля біології Хейса, кімната 101А, П.О. Box 10037, Бомонт, Техас 77710, США. Тел .: +1409880 7090; Електронна пошта: [електронна пошта захищена] .
Ключові слова: хвороба Альцгеймера, дієта, чутливість до глютену, запалення, мікробіом, окислювальний стрес
Анотація
Нейрокогнітивні розлади, такі як хвороба Альцгеймера (АД), вражають мільйони людей у всьому світі і характеризуються когнітивним спадом. Дослідження на людях та тваринах показали, що хронічна імунна відповідь та запалення є важливими факторами патогенезу БА. Хронічне запалення може прискорити агрегацію амілоїд-β-пептидів і пізніше гіперфосфорилювання білків тау. Точна етіологія БА не ясна, але генетика та фактори навколишнього середовища, такі як вік, сімейна історія та спосіб життя, пов’язані з нейродегенеративними захворюваннями. Звички у способі життя, такі як неправильне харчування, пов’язані із запаленням і можуть прискорити або уповільнити прогресування нейродегенеративних захворювань. Тут ми пропонуємо огляд потенційних станів та факторів, що стимулюють запальні процеси при БА. Розуміння запальних механізмів, що впливають на розвиток АД, може допомогти захистити від деменції та АД.
ВСТУП
Через глобальне старіння населення до 2050 р., Як очікується, кількість людей, які живуть з деменцією, зросте втричі [1], що загрожує глобальною епідемією деменції [2]. Хвороба Альцгеймера (БА) - один із найпоширеніших видів деменції. Орієнтовні щорічні витрати на догляд за хворими на АД та деменцією збільшаться з 307 до 1,5 трильйонів доларів. Затримка настання AD на 1–5 років призводить до економічного виграшу від 183 227 до 511 208 доларів [3]. На додаток до економічної вигоди, затримка АД є корисною для здоров'я людей та населення.
AD - це повільно прогресуючий нейродегенеративний розлад, який характеризується бляшками амілоїду-β (Aβ) та нейрофібрилярними клубками, які накопичуються в мозку за роки або навіть десятиліття до появи симптомів. Запалення мозку, пов’язане зі старінням, може призвести до збільшення амілоїдного нальоту та утворення клубків тау та сприяти розвитку БА. Виявлення запальних шляхів у мозку призвело до того, що деякі дослідники припустили, що імунологічні/запальні механізми відіграють фундаментальну роль у розвитку БА [4–6]. Факти свідчать, що у пацієнтів з АД спостерігається хронічне запалення, яке одночасно зумовлюється та посилює порушення регуляції імунної системи.
Вплив дієтичних факторів, таких як споживання вуглеводів, рослинних олій, багатих омега-6 жирними кислотами, та омега-3 жирних кислот може мати значний вплив на імунну відповідь та запалення [16–18]. Дієта та умови, пов’язані з їжею, можуть спричинити хронічне запалення, що збільшує ризик розвитку деменції та АТ. Спосіб життя, що включає здорове харчування та фізичну активність, може захистити від зниження когнітивних здібностей та затримати початок АД [16, 19]. У цьому огляді обговорюватимуться дієта та умови, пов’язані з їжею, які можуть спричинити хронічне запалення, яке може бути пов’язане з БА, на основі їх основних біологічних механізмів дії. Мета цієї оглядової статті - дослідити зв’язок між дієтою та запаленням та її вплив на когнітивний стан. Для збору даних було використано керівництво PRISMA. Початкова стратегія пошуку визначила деякі n = 1426 паперів; n = 120 досліджень було включено після відбору реферату та n = 47 статей відповідали критеріям включення. Нове розуміння того, як звички способу життя, такі як дієта, вписуються в патологію БА через хронічну запальну реакцію, може допомогти розробити нові стратегії для затримки прогресування захворювання.
ВІТАМІНИ
Вітамін В
Вітамін С
Добре встановлено, що особи з легкими когнітивними порушеннями та БА мають знижений рівень аскорбінової кислоти у плазмі [26–29]. Вітамін С, або аскорбінова кислота, теоретично стримує патологію АД та нейродегенерацію двома основними механізмами: модуляцією окисного стресу та нейрозапаленням [26, 30]. Протизапальні властивості аскорбінової кислоти в основному пояснюються її здатністю блокувати стимульоване ліпополісахаридом продукцію медіаторів запалення [31], пригнічуючи таким чином MAPK та NF-κСистеми В [26, 32]. Крім того, добавки аскорбінової кислоти зменшують накопичення амілоїдного нальоту в моделях мишей AD [33–36]. Оглядове дослідження показало, що добавки антиоксидантних вітамінів (С і Е) пов'язані зі зниженням частоти та поширеності АД [37].
Інші корисні дії включають захист мозку від опосередкованого глутаматом окисного стресу або екситотоксичності [26, 38]. Надмірне вивільнення глутамату призводить до гіперактивації рецепторів N-метил-d-аспартату (NMDA) та пошкодження нейронів. Однак аскорбінова кислота запобігає опосередкованій глутаматом екситотоксичність, інгібуючи зв'язування глутамату з рецепторами NMDA [39–41].
Вітамін D
Вітамін Е
Вітамін Е здійснює нейропротекторні дії, модулюючи пізнання за допомогою антиоксидантної та протизапальної активності [49, 55]. Подальше дослідження гіпокампу щурів показало, що дефіцит вітаміну Е посилює депонування Аβ за рахунок зменшення експресії генів, що кодують білки, які опосередковано або безпосередньо беруть участь у кліренсі Аβ, наприклад, фермент, що руйнує інсулін [56, 57]. Вперше Сантос та його колеги повідомили, що вітамін Е (2000 МО/день вітаміну Е або плацебо протягом двох років) уповільнює прогресування АД [58]. З тих пір кілька клінічних досліджень досліджували ефективність вітаміну Е при лікуванні БА. Однак деякі випробування не виявляють користі [59–62].
Вітамін К
Докази показують, що люди з АД часто мають низькі сироваткові концентрації вітаміну К [63–65]. Крім того, пацієнти геріатрії, які використовують антагоністи вітаміну К як антикоагулянти, частіше страждають когнітивними порушеннями, ніж пацієнти, яким не призначали ці препарати [66]. Вітамін К бере участь у розвитку та виживанні нейронів завдяки антиапоптотичним та протизапальним ефектам, які опосередковуються газом 6, білком S та сфінголіпідами [67]. Вітамін К може зменшити ризик розвитку АД шляхом модуляції метаболізму сфінголіпідів, що призводить до посилення кліренсу Aβ. Сфінголіпіди - це клас ліпідних молекул, які надають мембрані специфічні характеристики, регулюючи тим самим субклітинний трафік та шляхи передачі сигналів. Сфінголіпіди можуть сприяти накопиченню Aβ в ендосомному та лізосомному відділах [68]. Дефіцит вітаміну К може зменшити активність ферментів, які беруть участь у метаболізмі сфінголіпідів, що призводить до неправильного метаболізму сфінголіпідів і, зрештою, до поганого кліренсу Aβ та зниження когнітивних функцій [56]. Не вистачає клінічних випробувань на людях щодо взаємозв’язку між вітаміном К та поліпшенням АТ.
Незважаючи на багатообіцяючу теоретичну базу щодо антиоксидантної та протизапальної ролі вітамінів, рандомізовані клінічні випробування не продемонстрували нейропротекторної дії добавок вітамінів на розвиток або профілактику БА. Лікування вітамінами може показати ненадійний вплив на АД через різницю в 1) антиоксидантному та протизапальному ефекті вітамінів у кожної людини, 2) дієті та харчовому статусі пацієнтів, 3) прогресуванні захворювання та 4) типах авітаміноз у пацієнтів. Однак було встановлено, що у осіб з легкими когнітивними порушеннями та БА може бути знижений рівень одного або декількох вітамінів у плазмі крові.
Випадкове лікування осіб з легким та середнім типом АД вітамінами С та Е, α-ліпоєва кислота та кофермент Q3 зменшують окислювальний стрес у мозку; однак це не вплинуло на патологію амілоїду або тау, пов’язану з біомаркером ліквору, а також порушило потенційну проблему швидшого зниження когнітивних функцій [69]. Корнеллі повідомив, що пацієнти з АД, які отримували інгібітор холінестерази у поєднанні з низькою дозою антиоксидантів (карнозин, кофермент Q10, вітамін Е, вітамін С, бета-каротин, селен, L-цистеїн, вітаміни В6, В9 та В12 та Гінкго білоба) показав значне поліпшення [70]. Наявні дані є недостатніми і не повністю підтримують роль вітамінів із зниженням когнітивних функцій щодо запобігання або лікування АД, і необхідні подальші дослідження.
БАЛАНС ОМЕГА-3/ОМЕГА-6 ЖИВИХ КИСЛОТ
Дисбаланс омега-3/омега-6 жирних кислот у типовій західній дієті викликає шкідливі периферичні запальні процеси [71, 72]. Факти свідчать, що дії омега-3 сприяють протизапальному стану, тоді як дії омега-6 посилюють запалення [71, 72]. Збільшений прийом омега-6 жирних кислот призводить до перевиробництва омега-6 похідних сигнальних молекул (ейкозаноїдів), які, виробляючись у великих кількостях, сприяють появі запального стану за допомогою різноманітних механізмів, включаючи вивільнення про -запальні цитокіни [73]. Крім того, підвищений вміст омега-6 у раціоні людини збігається із зростанням поширеності ожиріння, що є значним фактором ризику розвитку та прогресування АД, що призводить до широкомасштабного системного запалення [71, 72]. Систематичний огляд 13 досліджень на тваринах та 14 досліджень на людях підтверджує зв'язок між дієтичними омега-3/омега-6 жирними кислотами та ризиком розвитку АД [74]. Докази підтверджують роль омега-3 як протизапальної жирної кислоти у запобіганні когнітивному зниженню АД на ранній стадії захворювання.
ЧУТЛИВІСТЬ КЛЮТЕНУ
Целіакія (CD) - це аутоімунне захворювання, спричинене проковтуванням глютену, яке вражає приблизно 1% населення [75, 76]. Нещодавно CD стали розуміти лише як один із можливих клінічних проявів захворювань на чутливість до глютену [75, 77]. Нецеліакійна чутливість до глютену (NCGS) - це синдром, що характеризується симптомами, пов’язаними з ковтанням глютену при відсутності алергії на CD або пшеницю [77].
Нецеліакійна чутливість до глютену
NCGS може спровокувати патологію АД, ініціюючи надмірну реакцію імунної системи після прийому глютену, що призводить до хронічного стану запалення [77, 78]. Перші дослідження NCGS показали, що в її патогенез бере участь лише вроджена імунна система [78, 79], але останні дослідження виявили наявність антигліадинових антитіл, що може свідчити про участь адаптивного імунітету [80, 81]. Діагностичні ускладнення та неоднозначні симптоми сприяють розповсюдженню неправильного управління захворюваннями, що подовжує активацію імунної системи та пов'язане із цим запалення [81]. Якщо визнається, що NCGS сприяє розвитку хронічного запального стану методом, аналогічним ожирінню або черепно-мозковій травмі [4], визнаним фактором ризику розвитку АД, то NCGS може призвести до нейрозапалення мозку та патогенезу АД.
Целіакія
У індивідуумів CD генетична сприйнятливість присутня у вигляді специфічних мутацій основних алелів гістосумісності (клас МНС II) [82]. Молекули класу МНС класу II присутні на антиген-презентуючих клітинах, де їх роль полягає у поданні антигенних пептидів іншим імунним клітинам, таким як Т-клітини. Мутовані форми гена можуть зв’язувати пептиди глютену та активувати Т-клітини в слизовій оболонці тонкої кишки [82, 83]. Після активації ці Т-клітини збільшують вироблення цитокіну IFN-γ, що призводить до пошкодження слизової тонкої кишки [82, 84, 85].
Особи з КД мають підвищену проникність тонкого кишечника як наслідок аутоімунної патології [78]. Бактерії та гриби, які колонізують травний тракт, виділяють із зовнішніх мембран амілоїди, ліпополісахариди [31] та інші мікробні ексудати [86–90]. В умовах підвищеної проникності кишечника ці мікробні амілоїди та ліпополісахариди можуть виходити з травного тракту та спонукати імунну систему до збільшення секреції прозапальних цитокінів [88, 91, 92]. Таким чином, підвищена проникність кишечника при CD може сприяти виникненню хронічного периферичного запального стану і, отже, патогенезу БА. Для подальшого обговорення цієї теми див. Наступний розділ про мікробіом.
МІКРОБІОМ
Мікробіом впливає на діяльність ЦНС, а ЦНС - на діяльність мікробіома [93, 94]. Порушення, що змінюють склад мікробіому кишечника, можуть стимулювати різні шляхи, що в підсумку збільшують ризик розвитку АД. Мікробіота кишечника може порушуватися під впливом лікування антибіотиками, змін дієти, нестероїдних протизапальних препаратів, харчових добавок, різних станів здоров’я та патогенних інфекцій [88, 95–99].
Підвищена проникність кишечника та виділення бактерій
Бактерії та гриби, що колонізують травний тракт людини, виділяють із зовнішніх мембран амілоїди, ліпополісахариди [31] та інші мікробні ексудати [86–90, 100]. Наприклад, кишкова паличка утворюють позаклітинні амілоїди, кучеряві волокна, які полегшують адгезію на поверхні. Продукти амілоїду мікробіомів, такі як CsgA, кучері та пептиди Aβ42, розпізнаються рецепторами TLR2/TLR1, які опосередковуються протизапальними реакціями [90]. Люди, здається, підтримують протягом усього життя великі кількості амілоїдного білка, що виділяється мікробіотою кишечника, що в кінцевому підсумку може сприяти патогенезу БА під час старіння [101–103]. Як старіння, так і порушення регуляції мікробіоти кишечника сприяють збільшенню проникності або “негерметичності” кишечника [94, 104]; таким чином, за певних умов ці мікробні амілоїди та ліпополісахариди можуть виходити із шлунково-кишкового тракту та спричиняти посилення секреції прозапальних цитокінів імунною системою [88, 91, 92]. Підвищена секреція прозапальних цитокінів може сприяти настанню резистентності до інсуліну, визнаного фактора ризику розвитку АД [88, 105]. Крім того, збільшення загального запального стану може само по собі сприяти патогенезу БА.
Крім того, витікаючі з бактерій амілоїди можуть спричинити збільшення АФК та подальшу активацію NF-κB, що призводить до регуляції мікроРНК-34a. NF-κВ є важливим посередником запальних реакцій, включаючи експресію прозапальних генів, таких як цитокіни, активація та диференціація вроджених імунних клітин, таких як запальні Т-клітини, та активація запальних каспаз, таких як NLRP3, інфламасома [106]. Крім того, NF-κВ збільшує експресію мікроРНК-34, здається, регулює експресію ініціюючих рецепторів, експресованих на мієлоїдних клітинах 2 (TREM2) [88]. Оскільки TREM2 безпосередньо бере участь у зондуванні та кліренсі пептидів Aβ40 і Aβ42, ймовірно, що його регуляція призведе до порушення фагоцитозу пептидів та посилення агрегації амілоїдів [88, 107, 108].
Крім того, зміни в кількості нейромедіаторів γ-аміномасляна кислота (ГАМК), серотонін (5-гідрокситриптамін), похідний від мозку нейротрофічний фактор та глутамат внаслідок змін стану мікробіомів можуть сприяти патогенезу БА [94, 109].
Гіпотеза гігієни
ОБГОВОРЕННЯ
Середземноморська дієта - це дієта з низьким вмістом вуглеводів з нежирною кількістю білка. Кромер та його колеги характеризують надмірне споживання вуглеводів, що спричиняє шкідливий вплив на здоров'я людини, як “карботоксичність”. Дієти з низьким вмістом вуглеводів при достатньому споживанні білка спричиняють кетогенез, тобто перетворення жиру в організм у кетони. Кетогенез надає організму нейропротекторні властивості за рахунок зменшення запалення та окисного стресу та збільшення аутофагії [130].
Мало відомо про зв’язок між чутливістю до глютену та зниженням когнітивних здібностей. Однак дефіцит поживних речовин, запалення та сильна імунна відповідь у мозку ставлять пацієнтів із ЦД на більш високий ризик зниження когнітивних функцій.
Як вказує література, запалення сприяє патогенезу БА. Запальні шляхи можуть прискорити прогресування AD [131] та деяких інших вікових захворювань [132]. Протизапальна терапія повинна бути корисною для затримки прогресування АТ. Однак результати далеко не остаточні [131]. Важливо знати, що хронічне запалення пов’язане з нейробіологією та прогресуванням АТ [133] за допомогою різних механізмів, таких як вироблення та кліренс Aβ. Бляшки Aβ можуть спровокувати запалення в петлі позитивного зворотного зв’язку [132].
ВИСНОВОК
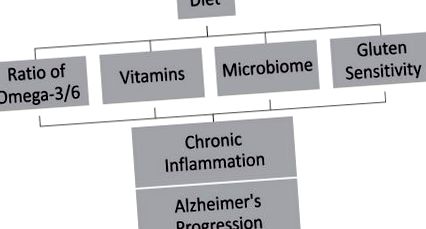
Дієта відіграє важливу роль у впровадженні антиоксидантних та протизапальних факторів, формуванні мікробіомів та лікуванні таких проблем травлення, як чутливість до глютену, які можуть уповільнити запалення та розвиток АД (рис. 1). Запальні події протягом життя індивіда свідчать про наявність хронічного запального стану. Кумулятивні ефекти цього хронічного запалення можуть впливати на різні стадії БА [132]. Вироблення протизапальних підходів до звичок у способі життя, швидше за все, може уповільнити прогресування або затримати початок АТ. Втручання у поведінку здоров’я, таке як дієтичне вживання, може затримати або уповільнити прогресування АД [134–136] на 3–5 років [3]. Навчання громадськості щодо затримки АД шляхом раннього виявлення хвороби в поєднанні з раннім втручанням може виступати ефективними методами для послаблення АД. Крім того, необхідні інтервенційні дослідження для того, щоб розглянути, чи дієта з низьким вмістом антиоксидантів та протизапальних речовин сприяє прогресуванню БА та чи може дієта з високим вмістом антиоксидантів та протизапальної дії зменшити ризик когнітивних порушень та розвитку АТ.
Дієта може прискорити прогресування хвороби Альцгеймера протягом хронічного запалення.
КОНФЛІКТ ІНТЕРЕСІВ
Автори не мають конфлікту інтересів.
- Жир, доля та хвороби, чому фізичних вправ та дієти недостатньо, Пітер Глюкман
- Жирова хвороба печінки пов'язана з тяжкістю гострого панкреатиту. Систематичний огляд і
- Детокс від екземи Малохімічна дієта для усунення запалення шкіри від Карен Фішер
- Жирова хвороба печінки у дітей щодо дієти та вправ щодо запобігання та зміни стану
- Надмірна експресія CYP2J2 послаблює неалкогольну жирову хворобу печінки, спричинену дієтою з високим вмістом жиру у мишей