Дієта на основі злаків модулює деякі маркери окисного стресу та запалення у худих і ожирілих щурів Цукера
Анотація
Передумови
Потенціал злаків з високою антиоксидантною здатністю зменшувати окислювальний стрес та запалення при ожирінні невідомий. Це дослідження досліджувало вплив пшеничних висівок, ячменю або контрольної дієти (α-целюлоза) на розвиток окисного стресу та запалення у худих і ожирілих щурів Цукера.
Методи
Сім тижнів, худорлявих і ожирілих самців щурів Цукерів (n = 8/група) годували дієтами, що містили пшеничні висівки, ячмінь або α-целюлозу (контроль). Через 3 місяці на цих дієтах вимірювали систолічний артеріальний тиск та аналізували плазму на вміст глюкози, інсуліну, ліпідів, здатності поглинання радикалів кисню (ORAC), малонового диальдегіду, глутатіонпероксидази та концентрації адипокіну (лептин, адипонектин, інтерлейкін (ІЛ) -1β, IL-6, TNFα, інгібітор активатора плазміногену (PAI) -1, хемотаксичний білок моноцитів (MCP) -1). Також визначали швидкість секреції адипокіну з експлантів вісцеральної та підшкірної жирової тканини.
Результати
Щурі ожиріння мали вищу масу тіла, систолічний артеріальний тиск та ліпіди в крові натще, глюкозу, інсулін, лептин та IL-1β порівняно з худими щурами, і ці показники не зменшувались споживанням дієти на основі пшеничних висівок або ячменю. ORAC у сироватці крові, як правило, був вищим у ожирілих щурів, яких годували пшеничними висівками та ячменем, порівняно з контролем (р = 0,06). У ожирілих щурів підвищений рівень малонового диальдегіду в плазмі крові (с
Передумови
Дієти з високим вмістом клітковини, включаючи зернові волокна, пов’язані зі зменшенням запальних маркерів [9, 10]. Існує безліч можливих механізмів цієї асоціації. Оскільки дослідження втручання у схуднення у пацієнтів із ожирінням покращують запалення підшкірної та вісцеральної жирової тканини низького ступеня [11–13], дослідження втручання з харчовими волокнами, які зменшують вагу, можуть побічно зменшити запалення [14]. Втручання клітковини псилію у щурів із цукером із ожирінням, зменшення приросту маси тіла і згодом зниження рівня фактора некрозу циркулюючої пухлини (TNF) -α [15]. Харчові волокна також зменшують маркери запалення незалежно від втрати ваги. Під час реакції після прийому їжі злакова клітковина викликає менший приріст рівня інтерлейкіну (IL) -6 у плазмі порівняно з картопляною їжею [16]. Ця нижча запальна реакція пояснюється низьким глікемічним впливом злакової клітковини, яка при тривалому споживанні може сприяти зниженню запального статусу. Крім того, злакові культури з високим вмістом фенольних сполук можуть також безпосередньо зменшувати накопичення ліпідів в адипоцитах та преадипоцитах [17], і було показано, що вони зменшують запалення на різних моделях тварин [18–20].
Щурі з цукером Цукер є найбільш широко використовуваною тваринною моделлю ожиріння, оскільки у них розвивається дисліпідемія, легка непереносимість глюкози, гіперінсулінемія, гіпертонія та запалення низького ступеня, прояви, подібні до тих, що визначають метаболічний синдром людини [21, 22]. Крім того, у цукерів із ожирінням Цукер виникає окислювальний стрес. Окислені ліпіди підвищуються в сироватці крові, сечі та печінці до 14-тижневого віку [23–25], а механізми антиоксидантного захисту плазми, такі як глутатіонпероксидаза, порушуються [24, 26]. Відповідно щур Цукера є відповідною моделлю для вивчення впливу харчових компонентів на окислювальний стрес, пов’язаний із порушенням обміну речовин у людей із зайвою вагою та ожирінням.
Це дослідження мало на меті порівняти дію дієт, що містять пшеничні висівки (часто споживану фракцію клітковини в Австралії) та цільнозерновий ячмінь з високим вмістом в пробірці антиоксидантна здатність на маркерах окисного стресу та запалення у худих і ожирілих щурів Цукера. Було висловлено гіпотезу про те, що дієта на злаках збільшить антиоксидантну здатність та зменшить окислювальний стрес у ожирілих щурів, а також зменшить запалення в судинній системі та жировій тканині порівняно з дієтою з низьким вмістом антиоксидантів.
Методи
Процедури для тварин та годівлі
Самці щурів Цукера віком шість тижнів із ожирінням фа/фа (n = 24) та худим Фа /? (n = 24) були отримані з будинку для тварин з університету Фліндерса, Бедфорд-Парк, Південна Австралія. Щурів поселяли в дротяних клітках у приміщенні з контрольованим опаленням та освітленням (23 ° C з 12-годинним циклом світло/темрява) і мали вільний доступ до їжі та води. Після прибуття щурів адаптували до нечищеного комерційного раціону протягом одного тижня. Їх розподілили випадковим чином у три групи (n = 8 на групу) і годували однією з трьох дієт (таблиця 1) протягом дванадцяти тижнів.
По закінченню дослідження щурів голодували протягом ночі (15 год), а потім знеболювали пентобарбіталом натрію та фемеральною артерією, проконтрольованою для вимірювання артеріального тиску та частоти серцевих скорочень (система збору даних Biopac, Санта-Барбара, Каліфорнія). Кров збирали з черевної аорти, обробляли для отримання сироватки та плазми ЕДТА і зберігали при -80 ° C до аналізу. Видалено та зважено основні органи та жирову тканину, включаючи брижу, придатки яєчка, заочеревинний та паховий жир. Усі процедури за участю тварин були схвалені Комітетом з питань харчової та харчової наук Співдружності з питань етики тварин.
Аналізи крові
Концентрацію тригліцеридів у плазмі та загальний вміст холестерину вимірювали за один прохід на автоматичному аналізаторі BM/Hitachi 902 із застосуванням стандартних ферментативних наборів Roche (Roche Diagnostics Co, Indianapolis, IN). Глюкозу в плазмі крові вимірювали за допомогою біоаналізатора YSI 2700 Select (Yellow Springs, OH), використовуючи стандарт подвійного калібрування 2747. Концентрації інсуліну, лептину, адипонектину, IL-1β, IL-6, хемотаксичного білка моноцитів (MCP-1), інгібітора активатора плазміногену (PAI) -1 та TNF-α визначали у плазмі крові за допомогою мультиплексного набору щурячих адипокінів ( Millipore, Сент-Чарльз, Міссурі, США) відповідно до інструкцій виробника. Аналізи проводили в один цикл, і середній коефіцієнт варіації внутрішньо аналізу (CV) коливався від 3-8%. Багатоаналітичне профілювання проводили на робочій станції LiquiChip 200 (Qiagen, Мельбурн, Австралія), а дані флуоресценції аналізували за допомогою програмного забезпечення LiquiChip Analyzer (версія 1.0.5, Qiagen, Мельбурн, Вікторія, Австралія).
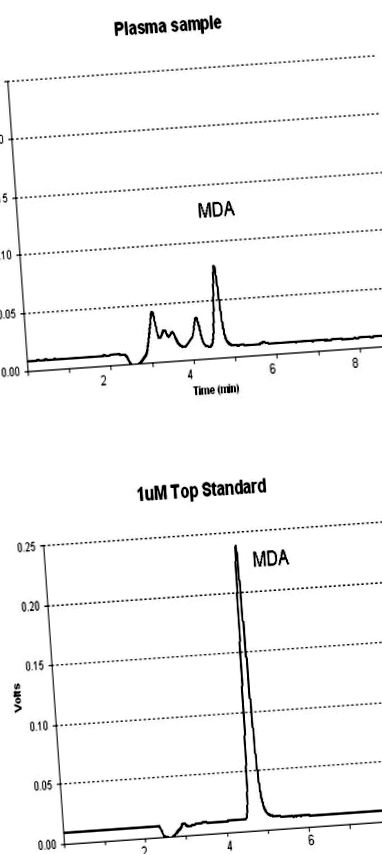
Типові хроматограми (A) зразка плазми та (B) 1 мкМ стандарт малонового диальдегіду (MDA).
Експерименти з експлантацією тканин
Експерти жирової тканини з пахової (підшкірної) та надниркової (вісцеральної) жирової тканини були підготовлені для аналізу культури тканин за методикою, описаною раніше [36]. Експланти культивували в α-мінімальному незамінному середовищі протягом 24 годин, оновлювали, а потім збирали після ще 24 годин інкубації. Потім зібраний носій стерилізували фільтром і зберігали при -80 ° C до використання. Концентрації адипонектину, IL-1β, IL-6, TNF-α, MCP-1 та PAI-1 (загальна кількість) у середовищі, кондиційованому жировою тканиною, визначали з використанням адипоциту щура Lincoсплетення Набір (Millipore, Сент-Чарльз, Міссурі, США) відповідно до інструкцій виробника. Багатоаналітичне профілювання проводили на робочій станції LiquiChip 200 (Qiagen, Мельбурн, Австралія), а дані флуоресценції аналізували за допомогою програмного забезпечення LiquiChip Analyzer (версія 1.0.5, Qiagen, Мельбурн, Вікторія, Австралія).
Статистичний аналіз
Дані представлені як середнє арифметичне ± SEM для кожної групи лікування. Вплив типу дієти та фенотипу щурів на швидкість росту визначали за допомогою двостороннього дисперсійного аналізу (ANOVA); для всіх змінних проведено двосторонній ANOVA. Відмінності між лікуваннями аналізували за допомогою пост-хок-тесту Тукі. Ці аналізи проводились із використанням SPSS версії 17.0 (SPSS Inc., Chicago Il USA). Значення р
Результати
Прийом їжі та збільшення маси тіла
Щурі щури споживали на 30% більше їжі, ніж худі щури (ожиріння; 33 ± 5, нежирне; 21 ± 3 г/день, р. Таблиця 3 Вплив контролю, дієти на основі пшеничних висівок та ячменю на приріст ваги, вагу органів та тканин худих і ожирілі щури Цукера 1
Заходи серцево-судинної системи
Щури з ожирінням мали повільніший пульс (ожиріння; 419 ± 9, худорляве; 462 ± 8 ударів на хвилину, p Рисунок 2
Антиоксидант і окислені ліпіди
Щури з ожирінням мали значно вищий ORACac, ніж худі щури (ожиріння; 2,2 ± 0,2, худне: 1,0 ± 0,2 мкмоль еквіваленту тролоксу/мл, р. Таблиця 4 Вплив контролю, дієти на основі пшеничних висівок та ячменю на антиоксидантну здатність сироватки крові та глутатіонпероксидазу та малоновий діальдегід концентрація 1
Щурі ожиріння мали значно нижчий рівень глутатіонпероксидази у плазмі порівняно з худими щурами (худі; 1108 ± 30, ожиріння; 953 ± 27 мкмоль/хв/мл, p Рисунок 3
Секреція лептину та MCP-1 з підшкірної залози (лептин; r = 0,453, p = 0,018, MCP-1; r = 0,447, p = 0,020), але не вісцерального жиру корелювала з рівнем їх циркуляції в плазмі. PAI-1 у плазмі не корелював з рівнем PAI-1 у підшкірному або вісцеральному жирі. Підшкірна жирова секреція MCP-1 корелювала з рівнем інсуліну в плазмі крові (r = 0,456, p = 0,017), лептину (r = 0,524, p = 0,005) та PAI-1 (r = 0,480, p = 0,011).
Обговорення
При ожирінні спостерігається збільшення рівня запальних цитокінів у жировій тканині та в кровообігу, що сприяє окисному стресу. Ми визначили, чи дієта на основі злаків модулює як запалення, так і окислювальний стрес. Дієта з пшеничними висівками знижувала концентрацію PAI-1 у плазмі, але не впливала на інші рівні адипокіну; лептин, IL-1β або IL-6. Цю зміну PAI-1 не можна пояснити швидкістю секреції PAI-1 з підшкірної або вісцеральної жирової тканини. Цілком ймовірно, що альтернативний сайт синтезу PAI-1, печінка, відповідав за регуляцію рівня циркулюючого PAI-1. Попередні дослідження показують, що коротколанцюгові жирні кислоти, що утворюються внаслідок бродіння харчових волокон у товстій кишці, пригнічують печінковий синтез факторів згортання через інгібування вивільнення жирних кислот [38]. Крім того, дослідження асоціацій та когорт також показують зворотний зв'язок між дієтами з високим вмістом клітковини та рівнями PAI-1 [39–41]. Таким чином, відмінності у ферментації пшеничних висівок у порівнянні з ячмінною та α-целюлозою могли сприяти зниженню рівня PAI-1.
Дієта з ячменю не впливала на збільшення ваги або ожиріння у худих або ожирілих щурів Цукера порівняно з дієтою Control, хоча обидві дієти містили значний рівень некрохмальних полісахаридів (4,5%). Це узгоджується з дослідженням, яке годувало повних щурів Цукером дієтою на основі вівсяних висівок, яка містила вищі рівні β-глюкану (10%) [42], ніж поточне дослідження (2%). Однак на іншій моделі ожиріння на тваринах (миші з ожирінням, спричиненими дієтою), подібний рівень дієтичного β-глюкану, як передбачено в поточному дослідженні (2% β-глюкану із зерна ячменю), показав зменшення приросту ваги, але не вага жирової тканини [43]. Крім того, ніякого додаткового зменшення приросту маси тіла та ожиріння не спостерігалося при 4-процентній дієті з β-глюканом. Загалом, це свідчить про те, що ячмінь та овес (багаті β-глюканом) мають обмежений вплив на зменшення збільшення ваги, пов’язаного з генетичною моделлю ожиріння. Однак зерна ячменю можуть запобігти розвитку ожиріння, спричиненого дієтою, покращуючи чутливість до інсуліну шляхом зміни обміну глюкози та ліпідів [43]. Крім того, інші сорти ячменю, що містять високий вміст інших видів харчових волокон, таких як фруктан та амілоза, можуть забезпечити додаткові переваги для метаболічного здоров'я, але це заслуговує на подальше дослідження.
У поточному дослідженні пшеничні висівки не впливали на збільшення маси тіла та ожиріння у худих або ожирілих щурів Цукера. Подібним чином, Neyrinck та співавт. [44] показали, що дієта на 10% пшеничних висівок не зменшує збільшення маси тіла або ожиріння порівняно з дієтою на 10% целюлози у мишей із ожирінням, спричинених дієтою. Основним некрохмальним полісахаридним компонентом пшеничних висівок є арабіноксилан, який є розчинною клітковиною, яка швидко ферментується в товстій кишці. Абарбіноксилан покращує метаболізм ліпідів та глюкози у людей та щурів [45–49], але не зменшував маси тіла та ожиріння, коли пацієнти з діабетом 2 типу споживали фракцію клітковини протягом п’яти тижнів [50]. Тому потенціал пшеничних висівок як такі у покращенні метаболічного здоров'я здається обмеженим.
Оскільки дієти на зернах пшеничних висівок та ячменю не зменшували збільшення маси жирової тканини, ймовірно, що вміст фенолів у цих злаках був недостатнім для гальмування накопичення ліпідів. В пробірці дослідження підтверджують прямий вплив фенольних речовин на інгібування накопичення ліпідів в адипоцитах та преадипоцитах [17]. Зокрема, було показано, що фенольні речовини рутин та о-кумарова кислота мають найбільший вплив на інгібування адипогенезу в адипоцитах 3T3-L1 [51] і ці фенольні речовини при згодовуванні щурам, зменшують вагу перитонеальної та епідидимальної жирової тканини [52]. Однак цим щурам вводили більш ніж у 2,5 рази більший рівень фенольних речовин, ніж передбачено дієтами з пшеничних висівок або ячменю в поточному дослідженні.
Незважаючи на те, що щури Цукера із ожирінням мали нижчий пульс і вагу, а також систолічний та пульсовий тиск, ніж худі щури, тип дієти не впливав на ці заходи. Son et al [53] повідомили, що щури, які споживають дієту з високим вмістом жиру на основі ячменю, мають більший просвіт аорти і тоншу товщину стінок, ніж щури, які споживають дієту на основі рису, що свідчить про зменшення накопичення ліпідів та/або нальоту в серцево-судинна система цих тварин. Вони також показали, що тригліцериди плазми, загальний і холестерин ЛПНЩ знижуються за допомогою дієти з ячменю. Оскільки дієти містили високий рівень жиру та холестерину (20 г/100 г жиру, забезпеченого соєвою олією, яловичим жиром, салом та кукурудзяною олією, а також 1 г/100 г холестерину) порівняно з цим дослідженням, це може пояснити, чому в поточному дослідженні не було виявлено впливу ячмінних або пшеничних висівок на тригліцериди або загальний холестерин.
Висновки
Індуковані ожирінням зміни маркерів, пов’язані з метаболічним синдромом, у щурів Цукера були подібними у тварин, яких годували контролем, дієтами на основі пшеничних висівок або ячменю. Висівки та ячмінь пшениці продемонстрували незначні зміни в показниках окисного стресу у пацуків Цукера із ожирінням, але невідомо, чи можуть сорти злаків з вищими рівнями фенолу забезпечити більше зниження окисного стресу у цих тварин. Крім того, дієта з пшеничних висівок знизила рівень PAI-1 у плазмі крові у пацюків із ожирінням до рівня, який спостерігався у худих щурів. Це зниження рівня PAI-1 не залежало від зміни швидкості секреції жирової тканини, тому вплив помірного антиоксидантного харчування на регуляцію PAI-1 в інших місцях, таких як печінка, слід додатково досліджувати.
- Асиметрична префронтальна активація кори у зв'язку з маркерами переїдання у людей із ожирінням
- Оцінка перлового пшона проти дієти на основі рису щодо біодоступності чотирьох мікроелементів SpringerLink
- Добавки кардамону покращують біомаркери запального та окисного стресу при гіперліпідемії,
- 8 простих способів розпочати боротьбу з окислювальним стресом сьогодні; Кава Neuro
- Чутливість до бромокриптину та інсуліну у худих та ожирілих суб'єктів Суспільство ендокринологів ім