Дефіцит тестостерону, спричинений кастрацією, збільшує ожиріння у самців щурів тканинно-специфічно та залежно від дієти
Анотація
Передумови
Дефіцит тестостерону у чоловіків клінічно пов'язаний з розвитком метаболічного синдрому, який проявляється ожирінням, стеатозом печінки та діабетом 2 типу. Ми досліджували наслідки дефіциту тестостерону, спричиненого кастрацією, на ожиріння організму та експресію генів, пов’язаних з метаболізмом ліпідів та поглинанням глюкози та сигналізацією андрогенів у самців щурів, які харчувались нормальним раціоном (НД) або дієтою з високим вмістом жиру (ХФД).
Методи
Зміни в метаболізмі ліпідів та глюкози та передачі сигналів андрогенів досліджували на фізіологічних та молекулярних рівнях у м’язах, печінці та жировій тканині некастрованих та кастрованих щурів під час годування ND або HFD.
Результати
Індукований кастрацією дефіцит тестостерону схиляє тварин до НД до раннього розвитку жирової печінки шляхом активації синтезу жирних кислот (ФА), тоді як HFD активує печінкове поглинання ФА CD36 експресія, що призводить до розвитку стеатозу печінки. У щурів, яких годували ND, кастрація викликала накопичення м’язового жиру шляхом активації CD36 вираз. У підшкірному жирі щурів, яких годували ND, кастрація збільшувала ожиріння та експресію генів, пов’язаних із синтезом FA, але зменшувала експресію гена-транспортера глюкози. У черевному жирі щурів, яких годували ND, кастрація збільшувала ожиріння, регулюючи гени, пов’язані з синтезом FA, а HFD сприяла ожирінню, викликаючи поглинання FA, транспортер глюкози та експресію генів, пов’язаних із синтезом FA. У щурів, яких годували ND, кастрація знижувала ріст тіла та вагу м’язів і знижувала регуляцію експресії генів андрогенних сигналів у м’язі longissimus dorsi.
Висновки
Дефіцит тестостерону збільшує ожиріння тканинним специфічним та залежним від дієти способом. Дефіцит тестостерону зменшує вагу тіла та м’язів і знижує рівень андрогенної сигналізації.
Вступ
Тестостерон відіграє важливу роль у метаболізмі ліпідів та глюкози [1]. Келлі та ін. [2] припустив, що тестостерон зменшує відкладення жиру в організмі, регулюючи експресію генів, пов’язаних з метаболізмом ліпідів та глюкози. Низький рівень тестостерону або дефіцит тестостерону дерегулює метаболізм ліпідів та глюкози, що призводить до збільшення ожиріння в печінці та периферичних тканинах [2,3,4,5]. Дефіцит тестостерону пов’язаний із підвищеним ожирінням вісцеральної системи [6]. Низький рівень тестостерону передбачає розвиток метаболічного синдрому, який проявляється як ожиріння, неалкогольна жирова хвороба печінки та діабет типу 2 у чоловіків [1, 7] та лабораторних тварин [2, 5]. Ефекти дефіциту тестостерону на ожиріння та метаболізм ліпідів/глюкози суперечливі. Наприклад, дефіцит андрогенів у поєднанні з дієтою з високим вмістом жиру (HFD) посилював ожиріння та резистентність до інсуліну у мишей-самців [5]. На відміну від цього, рівень глюкози та інсуліну в сироватці крові у самців щурів не впливав на дефіцит тестостерону та СНС [8]. Отже, наслідки дефіциту тестостерону на метаболізм ліпідів та глюкози вимагають подальших досліджень.
Відкладення жиру в організмі модулюється метаболічними ліпідними шляхами, які опосередковують поглинання, синтез і деградацію жирних кислот (FA) [9,10,11]. Транспортер FA36 CD36 опосередковує поглинання FA і відіграє важливу роль у стеатозі печінки [12]. Доступна обмежена інформація про роль CD36 у відкладанні жиру у щурів із дефіцитом тестостерону. Келлі та ін. [2] повідомлялося про різницю у впливі тестостерону на функцію підшкірної (sc) проти вісцеральної жирової тканини: миші з фемінізованими яєчками (з нефункціональним андрогенним рецептором [AR] та низьким рівнем тестостерону) демонстрували зниження КЛЮЧ4 експресія в sc, але не в вісцеральній жировій тканині. Подальші дослідження впливу дефіциту тестостерону на експресію генів, пов’язаних з метаболізмом ліпідів та глюкози в периферичних тканинах (включаючи печінку та скелетні м’язи) та жирові депо (sc та черевна [жирна] тканина) необхідні для розуміння механізмів яке ожиріння регулюється.
Дефіцит тестостерону зменшує ріст та м’язову масу у орхідектомії та AR-нокаутованих мишей [5] та зменшує м’язову масу у чоловіків [13]. Ці результати свідчать про важливість тестостерону для росту тіла та м’язів. Сигналізація про тестостерон опосередковується сигнальним шляхом AR [14, 15], і, отже, необхідне дослідження впливу дефіциту тестостерону на сигналізацію AR.
Харчування HFD гризунами змінює їх обмін ліпідів та глюкози [16, 17] і часто використовується для вивчення такого метаболічного синдрому, як вісцеральне ожиріння, гіперліпідемія та резистентність до інсуліну [18]. Таким чином, слід пояснити ефект поєднання дефіциту тестостерону та СНЧ. Ми висунули гіпотезу, що дефіцит тестостерону диференційовано дерегулює експресію генів, пов’язаних з метаболізмом ліпідів та поглинанням глюкози, специфічно для тканин, схильно до метаболічного синдрому. Ми також висунули гіпотезу, що HFD посилює зміни обміну ліпідів та глюкози, спричинені дефіцитом тестостерону. Щоб перевірити ці гіпотези, ми дослідили вплив кастрації на ріст, ожиріння, масу скелетних м’язів, параметри крові та рівні експресії генів, пов’язаних з метаболізмом ліпідів та поглинанням глюкози в печінці, м’язах та депозитах жиру та підшкірного та жирового клітин у чоловіків. щурів, яких годували нормальним харчуванням (НД) або ВЧС протягом 9 тижнів.
Матеріали і методи
Тварини, кастрація та дієти
Усі експериментальні процедури із залученням тварин були затверджені Інституційним комітетом з використання та догляду за тваринами Національного університету Чоннам (CNU) (номер дозволу CNU IACUC-YB-R-2010-13). Усі процедури управління тваринами дотримувались стандартних робочих протоколів CNU. Самців щурів Спраг-Доулі купували у компанії Orient Bio (Кьонгі-До, Республіка Корея) і підтримували в контрольованій температурі (22 ± 1 ° C) та вологості (45–65%) кімнаті протягом 12/12 год. світлий/темний цикл з вільним доступом до їжі та води.
Щурів кастрували у віці 6 тижнів, тоді їх середня маса тіла становила 213 г. Всі хірургічні інструменти попередньо стерилізували прийнятними методами, включаючи парову стерилізацію. Самців щурів знеболювали шляхом внутрішньом’язової ін’єкції Zoletil ™ 50 (5 мг/кг маси тіла, Вірбак, Франція) і поміщали на грілку. Мошонку щурів голили та очищали за допомогою 70% етанолу. Через шкіру мошонки був зроблений невеликий розріз по середній лінії (1 см), яєчка були розташовані, обережно видавлені та видалені. Потім сім’явивідні протоки, жир і кровоносні судини були відновлені у вихідному положенні в мошонковому мішку, а сім’явивідної протоки та кровоносні судини перев’язані шовковими швами (Ейлі, Сеул, Корея). М'язовий шар і шкіру закривали швами, після чого щурів повертали в клітини і контролювали їх відновлення. На контрольних щурах, що здійснювали фіктивну хірургію, проводили ідентичну процедуру, як на кастрованих щурах, за винятком видалення яєчок.
Після акліматизації протягом 1 тижня після кастрації з годуванням ND щурів поділяли на наступні чотири групи (по 8 на групу): контрольовані щури, що годувались ND або HFD, і кастровані щури, які годували ND або HFD. Звичайна дієта AIN93-G (D10012G) та HFD (D12451) були придбані у Research Diets, Inc. (Нью-Брансвік, Нью-Джерсі, США); їх композиції показані в допоміжних таблицях S1-S3. Коротше кажучи, у HFD проти ND, 45% проти 16% енергії було отримано з жиру, 35% проти 64% від вуглеводів та 20% проти 20% від білка відповідно. Споживання їжі щурами реєстрували щодня в той самий час доби, а масу їх тіла вимірювали щотижня.
Збір крові та тканин
Наприкінці 9-тижневого періоду годування щури (віком 16 тижнів) голодували протягом 8 год. Щурів знеболювали СО2, а зразки крові відбирали через серцеву пункцію, переносили в ЕТ-пробірку без антикоагулянта і зберігали при 4 ° С. Зразки крові центрифугували при 2000 ×g протягом 20 хв при 4 ° C для збору сироватки, яку зберігали при - 80 ° C до аналізу. Після знеболення СО2 щурів евтаназували декапітацією, а печінку, жирові тканини (ab і sc) та тканини скелетних м’язів (longissimus dorsi, gastrocnemius та soleus) негайно видаляли та зважували. Тканини заморожували в рідкому азоті та зберігали при - 80 ° C для подальшого визначення загального рівня ліпідів, мРНК та білка.
Аналізи сироватки та тканин
Параметри сироватки крові аналізували, як повідомлялося раніше [19, 20]. Коротко, рівень глюкози в сироватці крові аналізували за допомогою гексокіназних реагентів (Green Cross Reference Laboratory, Сеул, Корея). Рівень тригліцеридів у сироватці крові аналізували за допомогою ферментативного спектрофотометричного аналізу (Green Cross Reference Laboratory). Рівні тестостерону та інсуліну в сироватці крові аналізували за допомогою імуноферментного аналізу. Рівень вільних ФА в сироватці крові аналізували методом ацил-коферменту А (КоА) -синтази – ацил-КоА-оксидази. Рівні загального холестерину, ліпопротеїдів високої щільності (ЛПВЩ) та ліпопротеїдів низької щільності (ЛПНЩ) аналізували за допомогою ферментативних колориметричних аналізів.
М'язові тканини розтинали і поміщали в рідкий азот. Загальний обсяг ліпідів витягували із приблизно 50 мг м’язової тканини методом Фолча [21].
Гістологія
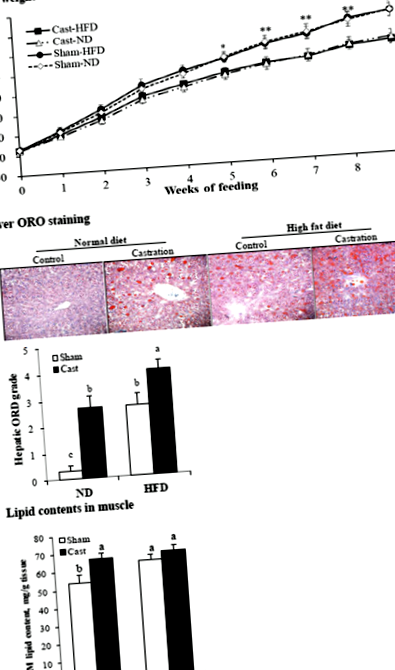
Для гістологічного аналізу печінку розсікали і звільняли від будь-якого видимого жиру та крові. Гістологічний аналіз та фарбування тканин червоним O (ORO) тканинами проводили, як повідомлялося раніше [20]. Коротко, зразки печінки фіксували у 10% формаліні, врівноважували у 20% сахарозі, вкладали в суміш оптимальної температури різання та розрізали на ділянки товщиною 7 мкм за допомогою кріостата при - 20 ° C. Для оцінки відкладення жиру заморожені зрізи фіксували у 10% формаліні, фарбували 0,5% ORO та досліджували під мікроскопом. Ступінь фарбування ORO печінки визначали і оцінювали від 0 до 5 (від найнижчого до найвищого).
Ланцюгова реакція полімерази в режимі реального часу
Загальну РНК виділяли за допомогою реагенту TRIzol (Центр молекулярних досліджень, Цинциннаті, штат Огайо, США) відповідно до інструкцій виробника. Загальну РНК визначали кількісно, вимірюючи поглинання при 260 нм, і її цілісність оцінювали за допомогою електрофорезу в агарозному гелі та фарбування бромідом етидію смуг 28S та 18S РНК. Синтез кДНК та аналіз ланцюгової реакції полімерази в режимі реального часу проводили, як описано раніше [19]. Праймери були розроблені з використанням інтегрованої технології ДНК (Coralville, IA, США) та програмного забезпечення Primer 3 на основі послідовностей у GenBank і були синтезовані Bioneer (Daejeon, Корея). Інформація про праймери наведена в допоміжній таблиці S4. Метод 2 ΔΔCT був використаний для визначення відносних кратних змін рівнів експресії генів, нормалізованих до відповідного гена ведення домашнього господарства (гліцеральдегід-3-фосфатдегідрогеназа для печінки, β-актин для м’язів та кислий рибосомний фосфопротеїн P0 для жирової тканини).
Вестерн-блот
Статистичний аналіз
Дані представлені як середнє значення ± стандартна помилка (SE). Дані аналізували за допомогою загальної процедури лінійної моделі в SAS (SAS Institute Inc., Cary, NC, USA). Модель включала ефекти кастрації, дієти (ND або HFD) та взаємодії кастрації × дієти. Коли взаємодії були значними, варіант PDIFF LSMEANS в SAS використовувався для індивідуального порівняння засобів. Відмінності вважалися значними, коли P значення було менше 0,05.
Результати
Кастрація зменшила вагу тіла та м’язів, але збільшила ожиріння тіла
Кастровані щури в групах ND та HFD мали нижчий (P Рис. 1
Кастрація збільшена (P Таблиця 2 Сироваткові параметри підроблених (контрольних) та кастрованих самців щурів, яких годували нормальним раціоном або дієтою з високим вмістом жиру при 8-годинному голодуванні
Кастрація та HFD модулюють експресію генів, пов'язаних з метаболізмом ліпідів та поглинанням глюкози
Кастрація модулювала експресію генів, пов’язаних з метаболізмом ліпідів, тканинним способом. Кастрація надрегульована (P Рис.2
Кастрація не вплинула Вираз GLUT2 в печінці або КЛЮЧ4 вираження в м’язах в обох групах дієти (рис. 2в). На відміну від цього, кастрація знижена (P
Обговорення
Дефіцит тестостерону збільшує ожиріння в організмі та дерегулює експресію генів, пов’язаних з метаболізмом ліпідів та засвоєнням глюкози, тканин-специфічними та залежними від дієти манерами
У цьому дослідженні ми виявили, що індукований кастрацією дефіцит тестостерону збільшує ожиріння в печінці, м’язах та жирах sc та ab і у щурів, яких годували НД, а також підвищує ожиріння в печінці та SC та ab жирі, але не в м’язах. щури годували HFD. Відповідно до наших результатів, низький рівень тестостерону або дефіцит тестостерону, як повідомляється, збільшує ожиріння в печінці та кількох периферичних тканинах [2, 3, 5], а HFD - ожиріння тканин [4, 5, 18].
Ми вивчили рівні експресії генів, що беруть участь у поглинанні та синтезі ФА, щоб оцінити молекулярні механізми, що лежать в основі впливу дефіциту тестостерону та типу дієти на ожиріння. Кастрація посилила вираження CD36 в печінці та sc та ab жир у групі HFD, але не в групі ND, а в м’язах у групі ND, але не в групі HFD. Активація CD36 бере участь у індукованому дієтою стеатозі печінки [23, 24] і пов’язана з неалкогольною жировою хворобою печінки у людей [25]. Однак активація CD36 експресія в жирових жирових клітинах незрозуміла. Отримані нами дані вказують на індуковану HFD регуляцію CD36 експресія пов'язана зі збільшенням SC та ожиріння на додаток до стеатозу печінки. Кастрація посилила вираження ACC і FASN у печінці у групі ND, але в м’язах у групі HFD. У sc та ab жирі кастрація посилювала експресію ACC та/або FASN в обох групах дієти; збільшений FASN експресія в sc жиру відповідає попередньому дослідженню на мишах [5].
Кастрація також модулювала експресію генів, пов’язаних із засвоєнням глюкози. У шрамовому жирі кастрація помітно знизила експресію КЛЮЧ4 у групах ND та HFD. На відміну від цього, кастрація не впливала на експресію генів, пов’язаних із засвоєнням глюкози в печінці чи м’язах у групі ND або HFD. У жирі абстракція кастрація посилювала експресію КЛЮЧ4 в HFD, але не в ND, групі. Подібним чином Kelley et al. [2] повідомив, що КЛЮЧ4 експресія зменшилась у sc жиру, але не в ab жиру у фемінізованих яєчок порівняно з нормальними мишами. У цьому дослідженні концентрація циркулюючої глюкози була збільшена у кастрованих щурів, які отримували НД, але не у тих, хто годувався ВЧ. Підвищена концентрація глюкози може бути зумовлена комбінованими ефектами зниження експресії гена GLUT4 у sc жирі та зменшення м'язової маси, що спостерігається у кастрованих тварин.
Наші результати також свідчать про те, що низький рівень тестостерону асоціюється з підвищеним ризиком розвитку діабету типу 2, оскільки кастровані щури демонструють знижену експресію генів, пов’язану з поглинанням глюкози в жирі, а також підвищену концентрацію циркулюючої глюкози. Після кастрації ми виявили підвищений рівень холестерину в крові, що може бути спричинено зменшенням споживання холестерину в печінці та м’язах, як вираз LDLr в печінці та м’язах зменшилася внаслідок кастрації щурів.
Дефіцит тестостерону зменшує вагу тіла та м’язів і знижує рівень андрогенної сигналізації
Ми виявили, що кастрація зменшила вагу тіла щурів, довгу спину та шлунково-кишкову масу. Також зменшилась кастрація STAT5a і AR експресія в лонгісимусі спинного м’яза, і AR експресія додатково зменшувалася за допомогою HFD. Таким чином, індукований кастрацією дефіцит тестостерону дерегулює AR-сигналізацію, і для сигналізації AR необхідний нормальний рівень тестостерону. Крім того, HFD збільшив індуковане кастрацією зменшення м'язової маси та AR вираз. Тому правильне харчування важливо для підтримання м’язової маси за наявності низького рівня тестостерону, оскільки низький рівень тестостерону може погіршити зменшення м’язової маси, спричинене HFD. Зниження м’язової маси може зменшити використання глюкози м’язами, що призводить до гіперглікемії та дерегуляції гомеостазу глюкози. Це може частково пояснити підвищене ожиріння при дефіциті тестостерону в групах ND та HFD.
Зіркін і Теновер [27] повідомили, що рівень тестостерону в крові, як правило, знижується з віком. Дійсно, лікування літніх чоловіків гормоном росту та тестостероном покращувало їхню худорляву масу [28]. Дефіцит тестостерону, який може бути спричинений гіпогонадизмом, центральним ожирінням або андрогенною депривацією у хворих на рак передміхурової залози, пов’язаний із метаболічними синдромами, включаючи інсулінорезистентність та діабет типу 2 [29]. У тварин HFD по-різному впливає на метаболізм організму та метаболічні захворювання з віком. Харчування HFD призвело до більшого збільшення маси тіла та рівня загального холестерину та глюкози в сироватці крові у старших мишей порівняно з молодими мишами [30]. Наше дослідження припускає, що споживання HFD людьми похилого віку, які зазвичай мають низький рівень тестостерону, може сприяти розвитку метаболічного синдрому.
У цьому дослідженні щурів кастрували у віці 6 тижнів, коли вони були незрілими. Отже, кастрація, можливо, вплинула на загальний розвиток тварин і сприяла фізіологічним відмінностям щодо некастрированих тварин. У чоловіків рівень тестостерону зазвичай знижується в літньому віці. Отже, можуть існувати обмеження для прямого впливу наших висновків на чоловіків, оскільки щурів кастрували в незрілому віці.
Дослідження добавок тестостерону для кастрованих щурів може підтвердити модель дефіциту тестостерону методом кастрації, хоча експеримент ми не проводили.
Висновки
- Вплив віку та дієти на клітинний синтез білка печінки мишей-самців SpringerLink
- Що спортсмени повинні знати про м’язи, що руйнують дефіцит заліза
- Вплив гуарани (Paullinia cupana) на метаболічні та запальні показники у дорослого чоловіка
- Таблиця 2 Ожиріння на початку захворювання, спричинене моногенними розладами SpringerLink
- Дослідження, проведене Вандербільтом, показує, що дієта з високим вмістом солі зменшує спрагу, підвищує почуття голоду VUMC Reporter