Центральний вплив гормонів щитовидної залози на апетит
Анджалі Амін
Секція слідчої медицини, Медичний факультет, Імперський коледж Лондона, 6-й поверх, Будинок Співдружності, лікарня Хаммерсміт, Ду-Кейн-роуд, Лондон W12 0NN, Великобританія
Валджит С. Ділло
Секція слідчої медицини, Медичний факультет, Імперський коледж Лондона, 6-й поверх, Будинок Співдружності, лікарня Хаммерсміт, Ду-Кейн-роуд, Лондон W12 0NN, Великобританія
Кевін Г. Мерфі
Секція слідчої медицини, Медичний факультет, Імперський коледж Лондона, 6-й поверх, Будинок Співдружності, лікарня Хаммерсміт, Ду-Кейн-роуд, Лондон W12 0NN, Великобританія
Анотація
Ожиріння є головною проблемою охорони здоров'я у всьому світі. Сучасні фармакологічні методи лікування в основному невдалі. Визначення складних шляхів, що регулюють споживання їжі, може сприяти розробці нових методів лікування. Вісь гіпоталамус-гіпофіз-щитовидна залоза (ВГТ) має загальновідомий вплив на витрату енергії, але її роль у регулюванні споживання їжі характеризується менш добре. Факти свідчать, що вісь HPT може безпосередньо впливати на споживання їжі. Порушення функції щитовидної залози може мати клінічно значущі наслідки для апетиту та маси тіла. Класично вважалося, що ці ефекти опосередковуються периферичними ефектами гормону щитовидної залози. Однак нещодавно місцева регуляція тиреоїдного гормону в центральній нервовій системі (ЦНС) відіграє важливу роль у фізіологічній регуляції апетиту. Ця стаття зосереджується на ролі HPT та гормону щитовидної залози в апетиті та пропонує докази можливих нових цілей для агентів проти ожиріння.
1. Вступ
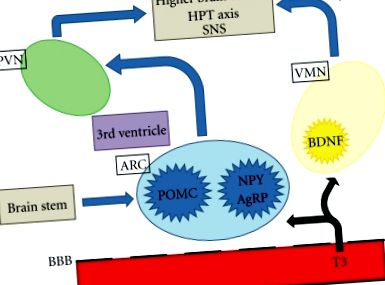
Ожиріння, його ускладнення та пов'язана із цим смертність є основними проблемами охорони здоров'я у всьому світі. Основними напрямками центральної нервової системи (ЦНС), важливими для регуляції апетиту, є гіпоталамус і стовбур мозку. Гіпоталамус інтерпретує та інтегрує аферентні сигнали з периферії та стовбура мозку для модуляції еферентних сигналів, які регулюють споживання їжі та витрати енергії. Нейронні та гормонально-периферичні сигнали передають інформацію, включаючи гострі харчові стани та запаси енергії. Гіпоталамус підрозділяється на ряд взаємопов'язаних ядер, включаючи паравентрикулярне ядро (PVN), ядро вентромедіалу (VMN) та дугоподібне ядро (ARC), які особливо важливі для регулювання енергетичного гомеостазу. ARC розташований поблизу серединної висоти, де гематоенцефалічний бар’єр неповний, і, отже, добре розташований для реагування на циркулюючі фактори, пов’язані з апетитом та споживанням їжі [1]. Останні дані свідчать про те, що гормони щитовидної залози можуть отримувати доступ до ARC та інших областей гіпоталамуса для регулювання апетиту (рис. 1).
Принципова схема центральної регуляції апетиту. Т3 може отримати доступ до гіпоталамуса і стовбура мозку через неповний гематоенцефалічний бар’єр. ПВН: паравентрикулярне ядро; ARC: дугоподібне ядро; ВМН: ядро вентромедіалу; BBB: гематоенцефалічний бар’єр; Т3: трийодтиронін; POMC: про-опіомеланокортин; NPY: нейропептид Y; AgRP: білок, пов’язаний з гуті; BDNF: нейротрофічний фактор, отриманий з мозку; HPT: гіпоталамо-гіпофізарна щитовидна залоза; SNS: симпатична нервова система.
Добре встановлено, що вісь гіпоталамус-гіпофіз-щитовидна залоза (ВГТ) регулює масу тіла. Відомо, що тиреоїдні гормони впливають на швидкість метаболізму. Порушення функції щитовидної залози може мати клінічно значущі наслідки для апетиту та маси тіла. Гіпотиреоз класично спричиняє зменшення базальних витрат енергії [2] із збільшенням ваги [3, 4]. І навпаки, гіпертиреоз збільшує витрати енергії та зменшує масу тіла [5–7]. Традиційно вважається, що саме ця знижена маса тіла є рушієм гіперфагії, що може бути характерною ознакою гіпертиреозу. Однак останні дані свідчать про те, що вісь HPT може відігравати безпосередню роль у регуляції апетиту гіпоталамусом, незалежно від впливу на витрати енергії. Класично, гіпоталамічний тиреотропін-вивільняючий гормон (ТРГ) стимулює вивільнення тиреотропного гормону (ТТГ) з передньої частини гіпофіза, який потім стимулює вивільнення обох гормонів щитовидної залози - трийодтироніну (Т3) і тироксину (Т4). Звіти свідчать, що всі ці сигнальні молекули можуть безпосередньо впливати на споживання їжі [8–11]. Поліпшення розуміння ролі осі HPT та гормону щитовидної залози в апетиті може визначити нові мішені для агентів проти ожиріння.
2. Вплив гормонів щитовидної залози на споживання їжі (Таблиця 1)
Таблиця 1
Вплив TRH, TSH та T3 на споживання їжі. Центральне введення ТРГ і ТТГ у гризунів спричиняє зменшення споживання їжі [8, 12, 13]; подібний вплив на споживання їжі спостерігається після периферичного введення TRH [14]. Центральне та периферичне введення Т3 збільшує споживання їжі [9–11]. TRH: тиреотропін-рилізинг-гормон; ТТГ: тиреотропний гормон; Т3: трийодтиронін.
Існують добре охарактеризовані ефекти голодування на експресію гіпоталамусного ТРГ. В першу чергу вважається, що це регулює вісь HPT у періоди обмеженої доступності їжі, тим самим зменшуючи споживання їжі. Однак, як повідомляється, TRH має прямі аноректичні ефекти, припускаючи, що він може регулювати споживання їжі незалежно від впливу на вісь HPT. У гризунів центральне введення ТРГ зменшує споживання їжі [8, 12, 13]; подібний вплив на споживання їжі спостерігається після периферичного введення [14].
Також було показано, що ТТГ зменшує споживання їжі при центральному введенні щурам [8]. Є дані, що ТТГ із pars tuberalis бере участь у фотоперіодичній реакції у птахів та гризунів, і, отже, можливо, що ТТГ бере участь у сезонних змінах споживання їжі та маси тіла, що трапляються у деяких видів [15–17].
Гіперфагія, пов’язана з гіпертиреозом, може бути результатом дії гормонів щитовидної залози, що діють безпосередньо на ланцюги апетиту ЦНС. Т3 безпосередньо стимулює споживання їжі на рівні гіпоталамуса. У моделях гризунів периферичне та центральне введення гіпоталамусу Т3 збільшує споживання їжі [9–11].
Існує кілька механізмів, що постулюють щодо опосередкування орексигенних ефектів гормонів щитовидної залози. ARC містить дві різні нейронні популяції, що регулюють енергетичний гомеостаз. Одна субпопуляція виражає ген проопіомеланокортину (POMC), який кодує аноректичний нейропептид альфа-меланоцитостимулюючий гормон (α-MSH). Інший виражає орексигенні фактори нейропептид Y (NPY) та пов’язаний з гуті білок (AgRP). Повідомлялося, що периферичне введення Т3 збільшує мРНК гіпоталамусу NPY і що внутрішньоцеребровентрикулярне (ICV) введення антагоніста рецептора NPY Y1 притуплює гіперфагію, спричинену Т3, припускаючи, що Т3 може підвищувати апетит через NPY [10]. Також повідомлялося, що введення Т3 також зменшує експресію POMC гіпоталамусу [10]. Інше дослідження не виявило змін у експресії гіпоталамусового нейропептиду у відповідь на периферичне введення Т3, хоча це може відображати різні дози введеного Т3 [9].
Однак вплив гормонів щитовидної залози на споживання їжі може не опосередковуватися безпосередньо ARC. Безпосереднє введення T3 у VMN, але не ARC, збільшує споживання їжі у щурів [9]. Оскільки відомо, що схеми регулювання апетиту в ARC змінюються внаслідок змін в HPT, може бути непрямий ефект ARC через VMN, що дозволяє внутрішньо-VMN T3 збільшити споживання їжі. Відповідно до цього, є збудливі входи в нейрони POMC, що беруть початок у VMN [18].
Вважається, що фермент 5 ′ аденозинмонофосфат-активована протеїнкіназа (AMPK) діє як датчик, який регулює клітинний енергетичний гомеостаз. AMPK активується фосфорилюванням, а активація AMPK в ARC збільшує споживання їжі [25]. Периферично введений Т3 підвищує фосфорилювання гіпоталамусового AMPK, що, таким чином, може опосередковувати орексигенні ефекти Т3 [11].
Похідні гормонів щитовидної залози також беруть участь у регуляції апетиту. Рецептор 1, пов'язаний з G білками, пов'язаний з амінами (TAAR1), експресується в гіпоталамусі щурів і пов'язаний з регуляцією енергетичного гомеостазу. Похідне гормону щитовидної залози 3-йодтиронамін (T1AM), ендогенний біогенний амін, є потужним агоністом TAAR1. Дослідження на гризунах показують, що T1AM значно збільшує споживання їжі у щурів при внутрішньочеревному введенні, ICV або безпосередньо в ARC [26]. Однак фізіологічна значимість цих ефектів залишається невідомою.
Рецептори гормонів щитовидної залози (TR) або рецептори, що опосередковують вплив гормонів щитовидної залози на апетит, невідомі. Існує два основних типи рецепторів гормонів щитовидної залози - рецептори гормонів щитовидної залози α (THRA) і рецептори гормонів щитовидної залози β (THRB), кожен з яких кодується окремим геном. Ці гени поперемінно зрощуються, щоб утворити три основні високо гомологічні ізоформи ядерних рецепторів (TRα1, TRβ1 та TRβ2) зі специфічним розподілом у тканинах [27]. Три основні ізоформи зв'язують Т3 з високою спорідненістю та регулюють транскрипцію, опосередковану гормонами щитовидної залози. TRα - основна ізоформа, що регулює діяльність Т3 в серці, скелетних м’язах, кістках та мозку; TRβ є основною ізоформою, що регулює активність Т3 в печінці. Жирова тканина експресує як TRα, так і TRβ. TRβ1 експресується в більшості тканин, тоді як TRβ2 експресується виключно в гіпоталамусі, гіпофізі, вушній раковині та сітківці [28, 29]. Всі три ізоформи експресуються в гіпоталамусі людини в ряді ядер, включаючи інфіндубулярне ядро, людський еквівалент ARC та супраоптичні та паравентрикулярні ядра.
Хоча гормони щитовидної залози можуть безпосередньо збільшити споживання їжі в гіпоталамусі, було показано, що вибірково націлене на підтипи TR має сприятливі метаболічні ефекти. Активація рецептора TRβ зменшує масу тіла у щурів із ожирінням [30], що може бути наслідком збільшення швидкості метаболізму. Отже, агоністи TRβ пропонуються як засоби лікування ожиріння. Націлювання на TR за допомогою TRβ-селективного агоніста може визначити, чи впливають ці агенти на метаболічні ефекти гормону щитовидної залози, без впливу на тканини, що експресують TRα, такі як серце [30]. Периферичне введення TRβ-селективного агоніста щурам під час годування з дієтою з високим вмістом жиру запобігає очікуваному збільшенню маси жиру, непереносимості глюкози та гіпертригліцеридемії [31]. Ці ефекти можуть відображати збільшені витрати енергії, що спостерігаються у гризунів, які отримували TRβ-селективний агоніст, а не вплив гормонів щитовидної залози на апетит [32]. Потрібна подальша робота для виявлення рецептора, відповідального за орексигенні ефекти Т3 в гіпоталамусі.
3. Вплив харчового стану на гормони щитовидної залози
Зниження рівня TRH у відповідь на голодування може бути важливим, оскільки, як вбачається, TRH має прямий аноректичний ефект при введенні в гіпоталамус [13]. Можливо, існують різні популяції нейронів TRH, які регулюють вісь HPT та регулюють апетит.
У періоди обмеженої доступності їжі спостерігається центральне регулювання осі HPT. Рівні сироватки Т4 і Т3 падають під час голодування у людей [33] та гризунів [34, 35]. Оскільки більшість Т3 у гризунів надходить із щитовидної залози, вважається, що дефіцит їжі може призвести до падіння викидів Т4 і Т3. Це, ймовірно, є вторинним для зменшення експресії гіпоталамусового TRH, ефекту, який може бути опосередкований жировим гормоном лептином (рис.2).
- ВІДНОСИНИ МІЖ ЩИРОЇДНИМИ ГОРМОНАМИ, АНТИТИРОЇДНИМИ АНТИТЕЛАМИ, АНТИКЛАСНИМИ ТРАНСГЛЮТАМІНАЗАМИ І
- Захворювання щитовидної залози під час вагітності Що потрібно знати - гормони щитовидної залози необхідні для нормального розвитку плода
- Два дослідження підкреслюють вплив дієти та мікробіому на серце та старіння
- Які ефекти швидкого харчування на дитяче ожиріння Бюлетень медичних новин Новини здоров'я та
- Які причини і способи лікування втрати апетиту у немовлят - життя