Центральний та периферійний внесок у гіпертонію, пов’язану з ожирінням: вплив раннього переїдання
Кафедра фармакології Мельбурнського університету, Парквілл, Вікторія 3010, Австралія
Кафедра фармакології Мельбурнського університету, Парквілл, Вікторія 3010, Австралія
Кафедра біохімії та молекулярної біології, Університет Монаш, Клейтон, Вікторія 3800, Австралія
Кафедра фармакології, Університет Мельбурна, Парквілл, Вікторія 3010, Австралія
Кафедра фармакології Мельбурнського університету, Парквілл, Вікторія 3010, Австралія
Кафедра біохімії та молекулярної біології, Університет Монаш, Клейтон, Вікторія 3800, Австралія
Анотація
Серцево-судинний вплив ожиріння
Ожиріння є проблемою охорони здоров'я, що зростає на всіх континентах, і є основною проблемою охорони здоров'я. Хоча багато досліджень вказують на те, що ожиріння є основним фактором ризику серцево-судинної захворюваності та смертності, зв'язок між ожирінням та гіпертонічною хворобою незрозуміла і може відображати генетичні, екологічні, гормональні та гемодинамічні фактори (Redon, 2001).
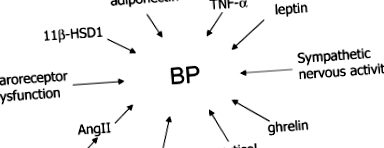
Як показано на рис. 1, інші циркулюючі гормони та медіатори, що виробляються жировою тканиною, можуть регулювати артеріальний тиск за допомогою модуляції судинного тонусу або внутрішньосудинного об'єму (Ліон та ін. 2003; Раджала і Шерер, 2003; Фрубек, 2004). Адипоцитокіни, такі як адипонектин, який знижується при ожирінні людини, інтерлейкін-6 (Il-6) та фактор некрозу пухлини α (TNF-α), що виділяються з жирової тканини, можуть сприяти дисфункції ендотелію, збільшуючи тим самим ризик атеросклерозу (Ліон та ін. 2003). Крім того, фермент 11β-гідроксистероїддегідрогеназа типу 1 (11β-HSD1) та ангіотензиноген експресуються жировою тканиною, і вони можуть відігравати ключову роль у серцево-судинному ризику, пов'язаному з вісцеральним ожирінням. 11β-HSD1 перетворює кортизон в його активну форму - кортизол. Трансгенні миші, які надмірно експресують 11β-HSD1 в жировій тканині, мають гіпертонію, що супроводжується накопиченням вісцерального жиру, а також резистентність до інсуліну та лептину (Масудзакі та ін. 2003).
Ожиріння пов'язане із змінами гормонів та медіаторів, отриманих з жирової тканини, що може впливати на артеріальний тиск (АТ) та судинну функцію Симпатична активація та дисфункція барорецепторів впливають на АТ. Лептин з жирової тканини, інсулін та ангіотензин II (AngII) можуть посилювати симпатичну активність, підвищуючи, таким чином, АТ. Вироблена з жиру 11β-гідроксистероїддегідрогеназа типу 1 (11β-HSD1) сприяє перетворенню кортизону в активний кортизол. Знижений адипонектин, вироблений з жиру, і підвищений інтерлейкін 6 (IL-6) та фактор некрозу пухлини α (TNF-α) сприяють атеросклерозу. Грелін може впливати на регуляцію АТ, оскільки було показано, що він чинить депресорний вплив на ЦНС.
Ожиріння у дорослих
Для того, щоб дослідити зв’язок між ожирінням та гіпертонією, наша лабораторія розробила смачні дієти з високим вмістом жиру для гризунів, які можна застосовувати в молодому віці, дозволяючи вивчити серцево-судинні/метаболічні наслідки добровільного перегодовування (Хансен та ін. 2001, 2004). Групи самців щурів, які відповідають вазі (200 г), отримували стандартну чау (12% калорій як жир) або надзвичайно смачну дієту у стилі кафетерію (що складається з доповненої чау-їжі, м’ясних пирогів, макаронних виробів та тістечок, 30% калорій як жир; Хансен та ін. 2004). За тваринами можна стежити протягом різних періодів дієтичного втручання (Hansen та ін. 2001, 2004). Вимірювання артеріального тиску за допомогою плетизмографії, а також зразки крові на венах хвоста проводяться через рівні проміжки часу. Хоча маса тіла, жирова маса та лептин у плазмі збільшуються незабаром після вживання дієти (Hansen & Morris, 2002), підвищення артеріального тиску стає очевидним лише через 10 тижнів або близько того. Рівні гіпоталамічної NPY знижувались при хронічному годуванні з високим вмістом жиру, і ми спостерігали значні негативні кореляційні зв'язки між загальним NPY гіпоталамусу та лептином у плазмі крові (Hansen & Morris, 2002).
Дитяче ожиріння
Дитяче ожиріння також зростає у всьому світі (Kohn & Booth, 2003; Slyper, 2004), а демографічні дані свідчать про те, що задіяні впливи навколишнього середовища, що діють на ранніх етапах життя. Дитяче ожиріння пов'язане з подальшою гіперліпідемією, непереносимістю глюкози та гіпертонією (Капріо та ін. 1996). Багатьом серцево-судинним наслідкам, що характеризують ожиріння у дорослих, передують відхилення, які починаються в дитинстві. Управління ожирінням серед дітей та його наслідками вимагає розуміння основних патофізіологічних змін ожиріння на ранніх стадіях. У гризунів зменшення розміру посліду після народження збільшує доступність їжі і використовується для вивчення наслідків раннього переїдання (Plagemann та ін. 1999). У наступному розділі ми описуємо дослідження з нашої лабораторії, в яких ми досліджували довгострокові метаболічні та серцево-судинні наслідки переїдання, що на сьогоднішній день мало вивчалося.
На додаток до вивчення хронічного впливу короткого періоду переїдання (за допомогою регулювання підстилки), ми також вивчили вплив постійного переїдання з народження, спричиненого малим розміром посліду, а також дієтою з високим вмістом жиру.
Моделювання ожиріння на початку захворювання
Регулювання посліду
Методи, що використовуються для моделювання раннього переїдання, показані на рис. 2. На 1-й день життя посліди щенят щурів регулювали на 3 (невеликий послід) або 12 чоловічих тварин (нормальний послід) подібної маси тіла, щоб викликати раннє постнатальне перегодовування або нормальне харчування відповідно. Тварини в малих послідах були значно важчими, ніж тварини в звичайних послідах до 14 дня (41,1 ± 0,8 проти 32,9 ± 0,5 г., P
Експериментальний протокол раннього вживання їжі Розміри посліду регулюються до 12 (контрольних) та 3 (недоїджених) цуценят на одну матір. Після відлучення щури мають і те, і інше ad libitum доступ до смачної дієти з високим вмістом жиру (30% калорій як жир) або стандартної дієти чау (12% калорій як жиру). Через регулярні проміжки часу вимірюють масу тіла, споживання їжі та артеріальний тиск, а також аналізують нейропептид Y гіпоталамуса, гормони плазми та медіатори, отримані з жиру.
Концентрація лептину в плазмі при відлученні, віці 8 та 16 тижнів (A) та експресія мРНК 11β ‐ HSD1 у заочеревинній білій жировій тканині (B) у віці 16 тижнів у щурів із нормальної (□) та невеликої посліду (▪), що годували чау Результати виражаються як середнє значення ± s.e.m. відносної експресії 11β-HSD1 до GAPDH. Дані аналізували за допомогою неспарених студентів т тест. *P
Хоча маса тіла не залишалася суттєво підвищеною через 16 тижнів після переїдання як цуценят, ми постійно спостерігали на 5% вищу масу тіла у щурів, вирощених у невеликих послідах; залежно від конкретної когорти спостерігали помірне підвищення артеріального тиску в манжеті близько 10 мм рт. ст. На популяційній основі відносно невеликі зміни, подібні цим, можуть мати значення для серцево-судинних захворювань.
Регулювання посліду, після чого нормальна або жирна дієта
У подальшому дослідженні, при відлученні (день 24), щенят обох розмірів посліду було розділено на групи, які отримували стандартну чау (12% калорій як жир) або дієту з високим вмістом жиру (30% калорій як жир; див. Рис. 2). Тварини, вирощені в невеликих послідах, були значно важчими, ніж тварини в звичайних послідах, незалежно від їх раціону (рис.4A; Велкоска та ін. 2005). Однак з 11-тижневого віку не спостерігалося значного впливу розміру підстилки на масу тіла (рис. 4A). Лептин у плазмі крові був підвищений у тварин у невеликих послідах порівняно з нормальним послідом у віці 8 тижнів, незалежно від їх дієти після відлучення (рис. 4B), вказуючи на те, що раннє переїдання має тривалий вплив на жир у організмі. У віці 16 тижнів ваги органів та жирова маса тварин у невеликих послідах, як правило, були трохи важчими, ніж у звичайних послідів, але ці відмінності не досягли значущості (Велкоска та ін. 2005). Знову ж таки, в обох групах дієт спостерігалося незначне збільшення маси тіла, пов’язане з розміром посліду.
Вага тіла та концентрація лептину в плазмі після відлучення A, вага тіла після відлучення щурів від нормальної посліду, яку годували (NC, n= 11; □), нормальний підстилка з високим вмістом жиру (NF, n= 11; ▪), подача невеликої підстилки (SC, n= 12; ○) та невеликим послідом з високим вмістом жиру (SF n= 10; •). Дані аналізували двосторонній ANOVA з повторними вимірами з наступним post hoc тест на найменшу значущу різницю. B, концентрація лептину у плазмі крові до 16-тижневого віку в NC (відкрита смужка), SC (злегка затінена смужка), NF (більш темна затінена смужка) та SF (заповнена смужка). Дані аналізували за допомогою двосторонньої ANOVA з подальшим post hoc Тест Бонферроні. Результати виражаються як середнє значення ± s.e.m. †P Велкоска та ін. (2005); використовується з дозволу.
Як ми спостерігали при годуванні з високим вмістом жиру у дорослих, маса тіла зростала протягом 2 тижнів після введення дієти з високим вмістом жиру після відлучення (рис. 4A), а маса тіла залишалася більшою у тварин, які отримували дієту з високим вмістом жиру протягом усього дослідження (рис.4A). У віці 16 тижнів щури з високим вмістом жиру з обох груп сміття були на 20% важчі, ніж їх колеги, що годували чау, і споживали вдвічі більше енергії (Велкоска та ін. 2005). Навіть після стандартизації маси тіла у щурів, що годували жиром, було більше жирової тканини (Велкоска та ін. 2005). Подібно до дієтичного ожиріння у дорослих (Hansen та ін. 2004), прийом дієти з високим вмістом жиру після відлучення призвів до більш ніж подвоєння плазмового лептину у віці 8 тижнів (дієта 4–5 тижнів; рис. 4B).
Збільшення систолічного артеріального тиску, пов’язане з дієтою, виявляється уповільненим щодо збільшення маси тіла та лептину в плазмі. Хоча артеріальний тиск був подібним у всіх групах лікування у віці 7 тижнів, підвищення артеріального тиску на 11–20 мм рт. Ст. Було очевидним в обох групах з високим вмістом жиру порівняно з контролем, що годували чау через 13 тижнів (Велкоска та ін. 2005). Коли комбіновані щури з високим вмістом жиру та чау-дієти, артеріальний тиск позитивно корелював з лептином у плазмі та інсуліном у плазмі у віці 13 тижнів у кожній групі посліду (Велкоска та ін. 2005). Значне зниження рівня гіпоталамусу NPY (включаючи PVN) спостерігалось через 16 тижнів у відповідь на дієту з високим вмістом жиру. Крім того, була помітна суттєва негативна кореляція між лептином та загальним NPY гіпоталамусу в обох групах розміру посліду (Велкоска та ін. 2005).
Вплив раннього переїдання
Незважаючи на те, що переїдання у критичні періоди розвитку рекомендується призводити до підвищеного ризику подальшого ожиріння та порушення обміну речовин, взаємозв'язок між термінами початку переїдання та ризиком ожиріння незрозумілий. У наших руках післяпологове переїдання, спричинене малим розміром підстилки, призвело до ранніх змін у масі тіла, найімовірніше, пов'язаних із збільшенням споживання молока. Цей вплив невеликого розміру посліду на збільшення маси тіла зберігався протягом періоду молодості (10 тижнів), відповідно до попередніх досліджень (Фауст та ін. 1980; Плагеман та ін. 1999), який показав збільшення жирової маси та кількості жирових клітин в результаті раннього переїдання. Наша робота демонструє розвиток вираженої гіперлептинемії у тварин у невеликих послідах разом із більшим збільшенням маси тіла. Можливо також, що ранні екологічні наслідки, пов'язані зі зміною розміру підстилки, такі як змінена взаємодія матері-щеня, можуть вплинути на подальшу поведінку та реакцію на стрес. Раніші роботи показали, що поводження з цуценятами призвело до посилення материнської допомоги (облизування та догляд), і що це було пов'язано з пригніченою реакцією гіпоталмо-гіпофіз-наднирники на стрес у дорослих (Лю та ін. 1997).
Ми також вивчили ефект продовження раннього переїдання, піддаючи тварин дієті з високим вмістом жиру після відлучення. Незалежно від розміру посліду, дієта з високим вмістом жиру призвела до значного збільшення маси тіла порівняно з дієтою чау лише через 2 тижні. Ми спостерігали гіперлептинемію та гіперінсулінемію, спричинену дієтою, а також значне збільшення жирової маси. Ці висновки демонструють, що тривале годування дієтою з високим вмістом жиру може перекрити ефекти, спричинені ранньою послідом, що вказує на важливість переїдання в подальшому житті (Велкоска та ін. 2005). Однак тварини, вирощені в невеликих послідах, залишалися помірно важчими, ніж вирощені в звичайних послідах протягом усього дорослого віку, хоча це не могло досягти значення. Це говорить про те, що раннє харчування все ще може відігравати невелику, але важливу роль.
Що пов’язує ожиріння та кров’яний тиск?
Регулювання розміру посліду у щурів, впливаючи тим самим на ранню схему годування, може впливати на кров'яний тиск у дорослих (Майерс та ін. 1996; Плагеман та ін. 1999), як і тип дієти. Ми розглянули це питання двояко. По-перше, вживання дієти з високим вмістом жиру (як у дорослому віці, так і під час відлучення) призвело до раннього і помітного збільшення маси тіла та концентрації лептину; вони були пов’язані із помірним підвищенням систолічного артеріального тиску, яке виявилося через кілька місяців. По-друге, перегодовування щурів протягом обмеженого періоду з самого раннього віку (1–24 день) також призводило до тривалого збільшення маси тіла, і концентрації лептину залишалися підвищеними ще довго після того, як після відлучення було введено нормальну дієту. Вплив короткочасного переїдання, спричиненого зменшенням розміру підстилки, на артеріальний тиск вимагає подальших досліджень у відповідних дослідженнях.
Іншим важливим фактором є розподіл жирової тканини у осіб із ожирінням. Було показано, що центральне ожиріння асоціюється з більшою симпатичною активацією щодо периферичного ожиріння, з еквівалентними порушеннями в контролі барорефлексів (Grassi та ін. 2004). Інший звіт не виявив підвищення активності м'язових симпатичних нервів у чоловіків з підшкірним ожирінням (Альварес та ін. 2004), незважаючи на підвищену концентрацію лептину. Механізм, за допомогою якого регіональне відкладення жиру призводить до різного серцево-судинного ризику, інтригує. У попередньому дослідженні ми спостерігали підвищення рівня мРНК 11β-HSD1 у заочеревинної білої жирової тканини у дорослих щурів, які переїдали молодих щенят (Велкоска та ін. 2005). Існує припущення, що посилене вироблення глюкокортикоїдів в результаті збільшення мРНК 11β ‐ HSD1 в жировій тканині у людей з ожирінням може впливати на накопичення жиру (Rask та ін. 2002).
Діти, які мають більшу масу тіла, частіше стають ожирінням у дорослих і мають більший ризик розвитку серцево-судинних порушень (Ганнелл та ін. 1998; Джеффріс та ін. 2003). У щурів, яких перегодовували з раннього віку, зростала вага тіла, а також змінювалися медіатори, що беруть участь як у регуляції харчування, так і в артеріальному тиску. Потрібні подальші дослідження, щоб глибше зрозуміти механізми, що лежать в основі розвитку підвищеного артеріального тиску при ожирінні.
- Центральне ожиріння пов’язане з інфекцією helicobacter pylori у великому перерізі
- Протизапальна дія мелатоніну при ожирінні та гіпертонії SpringerLink
- Абдомінальне ожиріння, яке визначається як більший, ніж очікувалося, обхват талії асоціюється з расіалетнічним
- Поза центрального ожиріння Жировий прошарок печінки та область вісцерального жиру пов'язані з метаболічним синдромом у
- Чи є розлади або стани, пов’язані з ожирінням; надмірна вага NICHD - Юніс Кеннеді