Фитопатогенна борошниста роса впливає на поведінку у пошуках їжі та виживання Coccinella septempunctata
Анотація
Вступ
Кокцинеллиди - це різнорідна група комах, поділена на три основні категорії відповідно до їх харчових уподобань: зоофаги (хижацтво), фітофаги (поїдання рослин) та мікофаги (поїдання грибів) (Giorgi et al. 2009). Хижі сонечка розвинулись із мікофагних корівок, які спочатку були пристосовані для годування на сажистих цвілях, але потім прийняли комах, які виробляють медовуху, таку як попелиця (Leschen 2000). Більшість хижих сонечок харчуються комахами, що виробляють медовуху, із підпорядку півточі Стерноррінча, який їм необхідний для завершення розвитку. На сьогоднішній день не існує видів кокцинеллідів, для яких цілком відома повна дієта (Weber and Lundgren 2009).
Види ентомофагів кокцинеллідів регулярно вживають не здобич, таку як пилок та нектар (Togni et al. 2016), медовуху та частини рослин (Giorgi et al. 2009), а також фрукти та гриби (Triltsch 1997). Ці типи їжі є важливою складовою дієти для багатьох сонечок як додаткове джерело енергії та часто необхідне для розвитку (Lundgren 2009a). Аналіз вмісту кишечника показав, що спори грибів можуть поглинатися, наприклад., Coccinella septempunctata, і навіть частіше бути присутніми, ніж частини тіла жертви, особливо при низькій чисельності попелиці (Triltsch 1999). Путман (1964) запропонував їсти на спорах грибків C. septempunctata трапляється абсолютно випадково, але за даними Сазерленда та Паррелли (2009), спори грибів можуть бути важливою сезонною їжею для сонечок. Важливість присутності цього виду непродуктивної їжі в раціоні сонечок і вплив на їхню поведінку у пошуках кормів недостатньо зрозумілі.
Ентомофагові кокцинеллиди активно використовують нюхові сигнали, пов'язані із запахом здобичі (Francis et al. 2004), уражені рослинами попелиці (Ninkovic et al. 2001; Togni et al. 2016), або їх поєднання (Jamal and Brown 2001). Сонечка-корівки мікофаги виявляли сильну перевагу характерним запахам, які виділяють рослини кабачків, заражені борошнистою росою, показуючи, що такі сигнали можуть відігравати важливу роль у поведінці кормів для сонечок (Tabata et al. 2011). Непродуктивні джерела їжі, такі як гриби, є компонентами ентомофагових дієт кокцинеллідів, але все ж ми майже нічого не знаємо про те, як вони знаходять заражені рослини. Виявлення та розташування несуттєвих продуктів харчування, таких як гриби, можуть бути випадковими або опосередкованими запахами, пов’язаними з зараженими грибами рослинами.
Досліджувати C. septempunctata видобуваючи борошнисту росу, ми перевірили їх реакцію на запахи заражених та неінфікованих рослин ячменю за допомогою дворукого ольфактометра. Ми також дослідили, чи може борошниста роса становити відповідну дієту для сонечок і чи їдять вони її як окрему їжу або в поєднанні з Rhopalosiphum padi.
Матеріали і методи
Борошниста роса
Ізолят борошнистої роси, Blumeria graminis f. sp. hordei (Bgh), було отримано від Lantmännen SW Seed AB, Svalöv, Швеція. Для розмноження борошнистої роси використовували високочутливий сорт ячменю (cv.) Steffi. Рослини вирощували в теплиці та підтримували при 18–22 ° C при світловому режимі L16: D8. Десять рослин на горщик (Ø 12 см, висота 9 см) вирощували в грунті (спеціальний сад Hasselfors, Hasselfors, Швеція). Рослини ячменю, заражені 7 днями раніше B. graminis використовувались для щеплення 10-денних рослин (другий лист починає розвиватися) с B. graminis струшуючи заражені рослини над здоровими рослинами. Заражені рослини покривали циліндрами з оргскла (Ø 10 см, висотою 32,8 см, товщиною 2 мм), закритими зверху квадратом з фетру та гумкою. Рослини інкубували в кліматичній камері при 18–22 ° C при світловому режимі L16: D8 та відносній вологості повітря 70% протягом 5–7 днів, доки на листках не утворилися нові спороносні ураження борошнистої роси.
Комахи
Семиточка сонечко, Coccinella septempunctata, дорослих людей збирали з природних середовищ існування поблизу Упсали, Швеція (59 ° 47′00.0 ″ пн.ш., 17 ° 39′00.0 ″ сх.д.) та вирощували принаймні п’ять поколінь, перш ніж їх використовувати в експериментах. Вирощували сонечка в клітках (40 × 40 × 80 см). Вони харчувалися змішаним харчуванням, що складається з вишнево-вівсяної попелиці (Rhopalosiphum padi), зелена персикова попелиця (Myzus persicae), горохова попелиця (Acyrthosiphon pisum), а також пилок квітучої білої гірчиці (Sinapis alba). Тлю вирощували на певних рослинах-хазяїнах; Р. паді на ячмені (Hordeum vulgare), M. persicae на насінні ріпаку (Brassica napus), і A. pisum на квасолі (Vicia faba). Вирощували сонечка в тих же умовах, що і дослідні рослини. Дорослим в експериментах було 3-4 тижні. Rhopalosiphum padi використані в експериментах були вирощені на вівсяному вівсяному горщику cv. Белінда в тих же умовах вирощування, що і заражені рослини, але в окремій камері.
Рослини, заражені попелиць та заражені борошнистою росою
Ячмінь cv. В експериментах використовували Аннабелл, оскільки спостерігалося високе поширення сонечок при зараженні борошнистою росою в полі. Десять рослин у горщику на двостулковій стадії були заражені Р. паді (20 попелиць на рослину). Через сім днів після зараження, коли кількість попелиці на рослину становило близько 100, рослини використовували для біопроб.
Рослини, заражені борошнистою росою, отримували шляхом зараження рослин ячменю на двостулковій стадії струшуванням заражених рослин над здоровими рослинами. Через сім днів після щеплення, коли були помітні ураження, рослини експлуатували для експериментів.
Рослини, оброблені попелиць і борошнистою росою, отримували шляхом випуску по 20 попелиць на рослину на рослини, заражені борошнистою росою напередодні. Через сім днів рослини використовували в біопробах. Кожен горщик з десятьма рослинами (обробленими або контрольними) поміщали в циліндр з оргскла (Ø 6,8 см, висоту 32,8 см, товщину 2 мм), а верх циліндра закривали квадратом тканини, захищеної від борошнистої роси, і стягували гумова пов'язка.
Біопроба на ольфактометрі
Нюхові реакції дорослих сонечок вимірювали за допомогою двостороннього ольфактометра повітряного потоку, що складається з двох стимулюючих зон (рук), прямо протилежних одна одній, із центральною нейтральною зоною, що розділяє їх (Ninkovic et al. 2001). Повітря забиралося з центру ольфактометра за допомогою вакуумного насоса, встановлюючи дискретні потоки повітря в бічних плечах. Потік повітря в ольфактометрі встановлювали на 180 мл/хв, вимірюючи витратоміром на вході в плечі. Кожна рука ольфактометра була з'єднана з кліткою, в якій знаходились рослини. Було створено три різні схеми (1) ячмінь, заражений Р. паді в одній клітці проти здорових рослин ячменю в іншій клітині (2) ячмінь, заражений борошнистою росою, проти здорових рослин ячменю, та (3) ячмінь, заражений борошнистою росою, проти ячменю, зараженого Р. паді. Одину сонечко, вибрану випадковим чином без визначення статі, ввели в ольфактометр і після періоду адаптації 10 хв її положення реєстрували кожні 2 хв протягом 20-хвилинного періоду. Кількість випробовуваних особин в одній комбінації варіювало від 21 до 23. Божі корівки, які залишалися нерухомими довше 10 хв, викидали. Кожну сонечко тестували лише один раз. Після кожної випробуваної особини ольфактометр очищали, використовуючи 70% етанол.
Тест на виживання сонечка
Вплив дієт на виживання сонечок вивчали в чотирьох різних обробках: (1) рослини, заражені борошнистою росою, (2) рослини, заражені Р. паді, (3) рослини, заражені борошнистою росою та заражені Р. паді, та (4) боротьба з рослинами без попелиці або борошнистої роси. Через 7 днів лікування в кожен циліндр вводили по одній сонечці. Сонечка мали доступ до води через ватну пробку, підключену до води, у невеликому контейнері, розміщеному біля заводу. Кожного третього дня ми реєстрували живих або мертвих сонечок протягом експериментального періоду 15 днів. Мертві сонечка збирали при кожному спостереженні і ставили - 20 ° C. Божі корівки, ще живі на 15 день, також були введені - 20 ° C. Всі сонечка трималися там до аналізу ДНК вмісту кишечника.
Екстракція ДНК та ПЛР
Ізольовані кишки поміщали в пробірки Еппендорфа, швидко заморожували рідким азотом і гомогенізували стерильним товкачем. Загальну ДНК витягували за допомогою автоматизованого екстракційного робота Qiacube (Qiagen), використовуючи міні-комплект ДНК QIAamp (Qiagen). ПЛР у реакціях 25 мкл проводили за допомогою готових до використання ПЛР бісером Illustra PuReTaq (GE Healthcare, Уппсала, Швеція) за даними Chen et al. (2015) з використанням праймерів для B. graminis BF-F1 (5′-AAGCTATGCGGAACTTCGTTT-3 ′) і BF-R (5′-TTAGGAGTTTTGGCAAGTCCC-3 ′). Програма ПЛР була такою: 94 ° С протягом 5 хв, після чого 35 циклів [94 ° С протягом 50 с, 68 ° С протягом 50 с, 72 ° С протягом 50 с] з подальшим завершальним етапом розширення при 72 ° С протягом 10 хв. Продукти ампліфікації були послідовно розподілені в Macrogen (Південна Корея). Ізольовані кишки 17 сонечків окремо екстрагували ДНК та аналізували за допомогою ПЛР на наявність B. graminis.
Статистичний аналіз
Кількість відвідувань того чи іншого плеча ольфактометра порівнювали за допомогою тестів відповідних пар Wilcoxon у статистичному пакеті SAS Dell Statistica software (2015). Дані про виживання аналізували за допомогою непараметричного підходу до аналізу виживання, запропонованого Капланом та Мейєром (1958). Була використана процедура тестування життя пакета SAS (2014). Висновки базувались на тесті Log-rank. Порівняння в парах були скориговані на множинність методом Бонферроні. Тести, що порівнювали виживаність у кожну точку часу, проводили як точні тести на хі-квадрат, тобто тести на хі-квадрат, де значення р обчислювали за допомогою підходу рандомізаційного тесту, подібного до точного тесту Фішера.
Результати
Нюхові реакції сонечка
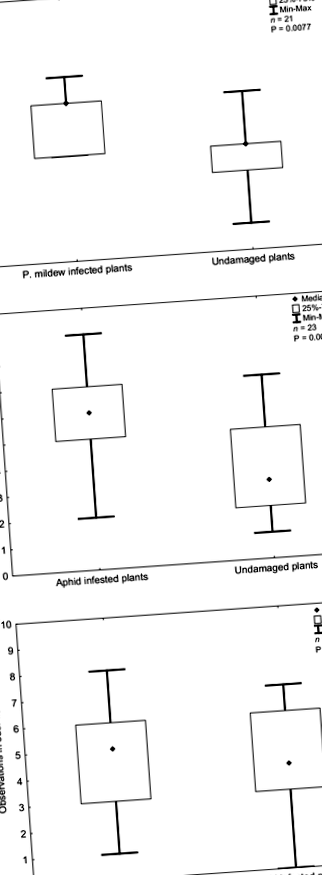
Запахи, які виділяються із стресових рослин (уражені борошнистою росою або уражені попелиць), впливали на нюхові реакції C. septempunctata (Рис. 1). Запахи рослин, заражених борошнистою росою, викликали позитивні реакції поведінки сонечок у порівнянні із запахом неінфікованих контрольних груп (тест Вількоксона: Z = 2,663, P = 0,0077, n = 21; Рис. 1а). Запах Р. паді заражені рослини також викликали позитивну поведінкову реакцію сонечок у порівнянні із запахами, що виділяються з незаражених рослин (тест Вілкоксона: Z = 2,84, P = 0,0045, n = 23; 1б). Не було різниці в нюхових реакціях сонечок, коли вони мали вибір між запахом борошнистої роси та ураженими попелиць рослинами ячменю (тест Вількоксона: Z = 0,243, P = 0,807, n = 22; Рис. 1в).
Нюхові реакції сонечок, Coccinella septempunctata, до різних джерел запаху: a заражені борошнистою росою рослини та непошкоджені рослини як контроль, b заражені попелиць рослини та неушкоджені рослини як контроль, та c заражені борошнистою росою рослини та рослини, уражені попелиць. Ділянки коробки та вуса представляють сукупну кількість відвідувань в зоні озброєння після десяти спостережень. Кожне поле містить середні 50% даних; крапковий символ позначає медіанне значення. Вуса (вертикальні лінії) вказують на мінімальну або максимальну кількість відвідувань випробуваної комахи; n кількість перевірених комах, P ймовірність, розрахована за допомогою тесту відповідних пар Вількоксона
Виживання сонечка
Виявлення борошнистої роси в кишках сонечка
ПЛР використовували для виявлення борошнистої роси в кишках сонечка після різних дієт. Усі сонечка, що харчуються виключно борошнистою росою, мали продукти ПЛР відповідного розміру B. graminis. Крім того, один із п’яти контрольних пунктів голодування вказував на наявність борошнистої роси. Всі ці продукти ПЛР відправляли на секвенування, підтверджуючи, що вони належать до борошнистої роси. На відміну від них, не отримували продуктів ПЛР для сонечок, які годувались виключно попелиць, тоді як лише один слабкий продукт ПЛР спостерігався у сонечка, який мав доступ як до борошнистої роси, так і до попелиці (Таблиця 1).
Обговорення
Дані цього дослідження та спостереження, проведені на місцях, у сукупності показують, що запахи, що виділяються із стресових рослин, можуть залучати сонечка до місць існування при наявності як несуттєвої, так і необхідної їжі. Така поведінка пошуку їжі свідчить про те, що сонечка вибирають місце годівлі з різноманітною їжею, яка може збільшити рівень виживання завдяки збалансованому харчуванню.
Список літератури
Chen S, Cao YY, Li TY, Wu XX (2015) Одночасне виявлення трьох патогенних видів пшениці грибів методом мультиплексної ПЛР. Phytoparasitica 43: 449–460. https://doi.org/10.1007/s12600-014-0442-1
de Vos M, Jander G (2010) Летюча комунікація при взаємодії рослин і попелиць. Curr Opin Plant Biol 13: 366–371. https://doi.org/10.1016/j.pbi.2010.05.001
Dell Inc (2015) Dell Statistica, версія 13.dell.com
Dicke M, Baldwin IT (2010) Еволюційний контекст для рослинних фітонцидів, спричинених рослиноїдними тваринами: поза "криком про допомогу". Тенденції Plant Sci 15: 167–175. https://doi.org/10.1016/j.tplants.2009.12.002
Francis F, Lognay G, Haubruge E (2004) Нюхові реакції на леткі викиди попелиць і рослин-господарів: (E) -β-Farnesene - ефективний кайромон для хижака Адалія біпунктата. J Chem Ecol 30: 741–755. https://doi.org/10.1023/B:JOEC.0000028429.13413.a2
Gencer NS, Kumral NA, Seidi M, Pehlevan B (2017) Відгуки привабливості жука-сонечка Hippodamia variegata (Goeze, 1777) (Coleoptera: Coccinellidae) до одиничної та бінарної суміші синтетичних рослинних фітонцидів, спричинених рослиноїдними тваринами, під час лабораторних досліджень Тюрк Дж. Ентомол 41: 17–26. https://doi.org/10.16970/ted.05956
Giorgi JA, Vanderberg NV, McHugh JV, Forrester JA, Slipinski SA, Miller KB, Shapiro LR, Whiting MF (2009) Еволюція харчових уподобань у Coccinellidae. Biol Control 52: 215–231. https://doi.org/10.1016/j.biocontrol.2009.05.019
Jamal E, Brown GC (2001) Орієнтація на Гіпподамія збіжна (Coleoptera: Coccinellidae) личинки до летких хімічних речовин, пов’язаних з Myzus nicotianae (Homoptera: Aphidiidae). Навколишнє середовище Entomol 30: 1012–1016. https://doi.org/10.1603/0046-225X-30.6.1012
Каплан Е.Л., Мейєр Р (1958) Непараметрична оцінка за неповними спостереженнями. J Am Stat Assoc 53: 457–481. https://doi.org/10.2307/2281868
Leschen RAB (2000) Жуки, що харчуються клопами (Coleoptera, Hemiptera). Неодноразові зміни від предків-мікофагів. Таксон Invertebr 14: 917–929. https://doi.org/10.1071/IT00025
Li YY, Zhou XR, Pang BP, Han HB, Yan F (2013) Поведінкові відповіді Hippodamia variegata (Coleoptera: Coccinellidae) до фітонцидів рослин, заражених Aphis gossypii (Hemiptera: Aphidae) та аналіз летких компонентів. Acta Entomol Sin 56: 153–160
Lundgren JG (2009a) Харчові аспекти харчових продуктів, що не належать до здобичі, в історії життя передплідних Coccinellidae. Biol Control 51: 294–305. https://doi.org/10.1016/j.biocontrol.2009.05.016
Лундгрен Й.Г. (2009b) Взаємозв'язок природних ворогів та непродуктивної їжі. Спрінгер, Дордрехт. https://doi.org/10.1007/978-1-4020-9235-0
Нінковіч V, Аль Абасі S, Петтерссон Дж (2001) Вплив летких речовин рослини, спричинених попелицею, на поведінку жука-сонечка. Biol Control 21: 191–195. https://doi.org/10.1006/bcon.2001.0935
Ninkovic V, Al Abassi S, Ahmed E, Glinwood R, Pettersson J (2011) Вплив змішування генотипу видів рослин на перевагу середовища існування багатофазного хижака комах. Oecologia 166: 391–400. https://doi.org/10.1007/s00442-010-1839-2
Нінковіч V, Далін I, Вучетік А, Петрович-Обрадович О, Глінвуд Р, Вебстер Б (2013) Летючий обмін між неушкодженими рослинами - новий механізм, що впливає на орієнтацію комах при посівах. PLOS ONE 8: e69431. https://doi.org/10.1371/journal.pone.0069431
Путман В.Л. (1964) Поява та харчування деяких кокцинелідів (Coleoptera) у персикових садах Онтаріо. Кан Ентомол 96: 1149–1155. https://doi.org/10.4039/Ent961149-9
Пакет SAS (2014) SAS Institute Inc. Посібник користувача SAS/Stat. Версія 9.4. SAS Institute Inc, Кері
Sherratt TN, Speed MP, Ruxton GD (2004) Природний відбір неприємних видів, що накладається залежно від статистики. Дж. Теор Біол 228: 217–226. https://doi.org/10.1016/j.jtbi.2003.12.009
Сазерленд А.М., Паррелла М.П. (2009) Мікофагія у Coccinellidae: огляд та синтез. Biol Control 51: 284–293. https://doi.org/10.1016/j.biocontrol.2009.05.012
Tabata J, De Moraes CM, Mescher MC (2011) Нюхові сигнали рослин, заражених борошнистою росою, що видобуває корм жуком-мікофагом-сонечком. PLOS ONE 6: e23799. https://doi.org/10.1371/journal.pone.0023799
Togni PHB, Venzon M, Muniz CA, Martins EF, Pallini A, Sujii ER (2016) Механізми, що лежать в основі вродженого залучення афідофагового кокцинеліда до рослин коріандру: наслідки для збереження біологічного контролю. Biol Control 92: 77–84. https://doi.org/10.1016/j.biocontrol.2015.10.002
Triltsch H (1997) Вміст кишечника у польових зразках дорослих людей Coccinella septempunctata (Кол. Coccinellidae). Ентомофага 42: 125–131. https://doi.org/10.1007/BF02769889
Triltsch H (1999) Їжа залишається в кишечнику Coccinella septempunctata (Coleoptera: Coccinellidae) дорослі особини та личинки. Eur J Entomol 96: 355–364
Вальдбауер Г.П., Фрідман С. (1991) Самовибір оптимальних раціонів харчування комахами. Annu Rev Entomol 36: 43–63
Вебер, округ Колумбія, Лундгрен Дж. Г. (2009) Оцінка трофічної екології Coccinellidae: їх роль хижаків та здобичі. Biol Control 51: 199–214. https://doi.org/10.1016/j.biocontrol.2009.05.013
Подяки
Це дослідження присвячене покійному професору Яну Петтерссону за його доброту, нескінченну наукову підтримку та його безкорисливість, які назавжди запам’ятаються. Дослідження було фінансово підтримане Шведською дослідницькою радою з навколишнього середовища (FORMAS) (номер проекту 2014-225) та Міністерством освіти, науки та технологічного розвитку Республіки Сербія (проект № III 46008) та Carl Tryggers Stiftelse för Vetenskaplig Forskning (проект № 12: 333). Ми вдячні професору Ульфу Ольссону за статистичну підтримку та доктору Димитрію Марковичу за цінні коментарі.
Інформація про автора
Приналежності
Сільськогосподарський факультет Белградського університету, Земун-Белград, Сербія
Кафедра клітинної та молекулярної біології Університету Уппсали, Уппсала, Швеція
Департамент екології, Шведський університет сільськогосподарських наук, Box 7044, 750 07, Упсала, Швеція
Анджа Радоніч, Олле Тереніус та Велемір Нінкович
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Внески
AR та VN задумали та спроектували дослідження; AR проводив експерименти; VN проводив статистичний аналіз даних; А.Р. і В.Н. склали рукопис; ОТ проводив аналізи ДНК; VN та OT допрацювали рукопис. Усі автори прочитали та схвалили роботу.
- Вплив сніданку на поведінку та успішність дітей та підлітків
- Виживання "Врятуй дітей"
- Ресурси виживання; Гриби не для виживання
- Що ви думаєте про поведінку цієї їжі для собак; Здоров'я
- Це те, як стрес впливає на розацеа; Ріверсол