Похідні флуоресцеїну як антибактеріальні засоби, що діють через мембранну деполяризацію
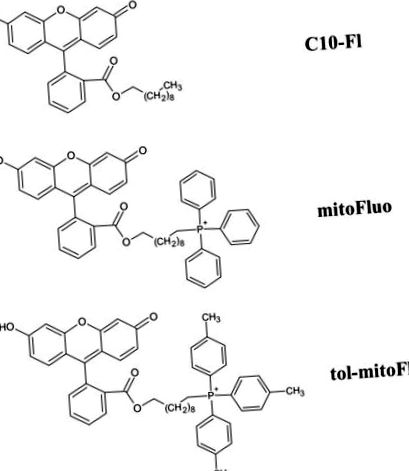
Хімічні структури тол-mitoFluo (флуоресцеїндецил (три-п-толіл) фосфонієвий ефір), mitoFluo (флуоресцеїн децил (трифеніл) фосфонієвий ефір) і C10-FL (флуоресцеїндециловий ефір).
(А) Дозова залежність стимуляції дихання мітохондрій печінки щурів тол-мітоФлюо (чорна крива), мітоФлюо (червона крива) та С10-FL (зелена крива) із сукцинатом як субстратом. (B) Вплив тол-mitoFluo, mitoFluo та C10-FL (концентрація, 1 мкМ) на мембранний потенціал RLM, оцінений за змінами поглинання потенційно чутливого барвника сафраніну O (15 мкМ). Вимірювання мембранного потенціалу та дихання проводили в інкубаційному середовищі (див. Експериментальний розділ) з 5 мМ сукцинату та 2 мкМ ротенону. Дані є середнім значенням ± SD принаймні трьох вимірювань.
(A - C) Дозозалежний ефект (A) tol-mitoFluo, (B) mitoFluo або (C) C10-FL на ріст клітин Bacillus subtilis. Зростання B. subtilis оцінювали за поглинанням при 620 нм при 37 ° C за допомогою 96-лункового зчитувача мікропланшетів Multiskan FC. (D) Вимірювання OD620 клітин B. subtilis через 20 год після обробки різними концентраціями тол-мітоФлюо, мітоФлюо, C10-FL, FCCP, CCCP та DNP. Сіра пунктирна лінія показує рівень росту клітин у контролі. Точки даних представляють середнє значення ± SD щонайменше трьох експериментів.
Вплив тол-mitoFluo, mitoFluo та C10-FL на мембранний потенціал у B. subtilis. Зміни мембранного потенціалу контролювали шляхом вимірювання флуоресценції DiS-C3- (5) (10 мкМ) у буфері PBS. Концентрація граміцидину А, 0,5 нг/мл.
Вплив тол-mitoFluo, mitoFluo та C10-FL (0,5 та 1,5 мкМ кожен) на проникнення мембрани у B. subtilis. Зміни в проникності мембрани контролювали шляхом вимірювання флуоресценції TO-PRO-3 (1 мкМ) у буфері PBS. Формувач каналу аламетицин додавали в кінці кожного запису як позитивний контроль (концентрація, 10 мкг/мл).
Флуоресценція клітин B. subtilis, забарвлених тол-mitoFluo (верхній ряд), mitoFluo (середній ряд) та C10-FL (нижній ряд), та відповідні світлопрозорі зображення. Клітини інкубували з 5 мкМ барвників протягом 5 хв, промивали LB та візуалізували.
Вплив CCCP (10 мкМ) на накопичення mitoFluo клітинами B. subtilis, що контролюється FCS. (A) Сліди інтенсивності флуоресценції mitoFluo (100 нМ), зареєстровані при встановленні FCS у присутності або відсутності бактеріальних клітин (10 6 на мл PBS). (B) Відповідні залежності кількості піків з інтенсивністю флуоресценції F, що перевищує поріг F0, n (F> F0), від значення F0.
Життєздатність клітин Rko у присутності mitoFluo. Клітини Rko інкубували з mitoFluo протягом 17 годин. Життєздатність клітин визначали за допомогою реагенту Cell Titer-Blue (Promega). Дані є середнім значенням ± SD для щонайменше трьох вимірювань.
Анотація
Хімічні структури тол-mitoFluo (флуоресцеїндецил (три-п-толіл) фосфонієвий ефір), mitoFluo (флуоресцеїн децил (трифеніл) фосфонієвий ефір) і C10-FL (флуоресцеїндециловий ефір).
(А) Дозова залежність стимуляції дихання мітохондрій печінки щурів тол-мітоФлюо (чорна крива), мітоФлюо (червона крива) та С10-FL (зелена крива) із сукцинатом як субстратом. (B) Вплив тол-mitoFluo, mitoFluo та C10-FL (концентрація, 1 мкМ) на мембранний потенціал RLM, оцінений за змінами поглинання потенційно чутливого барвника сафраніну O (15 мкМ). Вимірювання мембранного потенціалу та дихання проводили в інкубаційному середовищі (див. Експериментальний розділ) з 5 мМ сукцинату та 2 мкМ ротенону. Дані є середнім значенням ± SD принаймні трьох вимірювань.
(A - C) Дозозалежний ефект (A) tol-mitoFluo, (B) mitoFluo або (C) C10-FL на ріст клітин Bacillus subtilis. Зростання B. subtilis оцінювали за поглинанням при 620 нм при 37 ° C за допомогою 96-лункового зчитувача мікропланшетів Multiskan FC. (D) Вимірювання OD620 клітин B. subtilis через 20 год після обробки різними концентраціями тол-мітоФлюо, мітоФлюо, C10-FL, FCCP, CCCP та DNP. Сіра пунктирна лінія показує рівень росту клітин у контролі. Точки даних представляють середнє значення ± SD щонайменше трьох експериментів.
Вплив тол-mitoFluo, mitoFluo та C10-FL на мембранний потенціал у B. subtilis. Зміни мембранного потенціалу контролювали шляхом вимірювання флуоресценції DiS-C3- (5) (10 мкМ) у буфері PBS. Концентрація граміцидину А, 0,5 нг/мл.
Вплив тол-mitoFluo, mitoFluo та C10-FL (0,5 та 1,5 мкМ кожен) на проникнення мембрани у B. subtilis. Зміни в проникності мембрани контролювали шляхом вимірювання флуоресценції TO-PRO-3 (1 мкМ) у буфері PBS. Формувач каналу аламетицин додавали в кінці кожного запису як позитивний контроль (концентрація, 10 мкг/мл).
Флуоресценція клітин B. subtilis, забарвлених тол-mitoFluo (верхній ряд), mitoFluo (середній ряд) та C10-FL (нижній ряд), та відповідні світлопрозорі зображення. Клітини інкубували з 5 мкМ барвників протягом 5 хв, промивали LB та візуалізували.
Вплив CCCP (10 мкМ) на накопичення mitoFluo клітинами B. subtilis, що контролюється FCS. (A) Сліди інтенсивності флуоресценції mitoFluo (100 нМ), зареєстровані при встановленні FCS у присутності або відсутності бактеріальних клітин (10 6 на мл PBS). (B) Відповідні залежності кількості піків з інтенсивністю флуоресценції F, що перевищує поріг F0, n (F> F0), від значення F0.
Життєздатність клітин Rko у присутності mitoFluo. Клітини Rko інкубували з mitoFluo протягом 17 годин. Життєздатність клітин визначали за допомогою реагенту Cell Titer-Blue (Promega). Дані є середнім значенням ± SD для щонайменше трьох вимірювань.
- Біомолекули Безкоштовні повнотекстові довголанцюгові поліненасичені жирні кислоти Омега-3 у природних екосистемах
- Безкоштовні повнотекстові кардіопротекторні ефекти біологічних молекул харчового лляного насіння після інфаркту
- Ракові безкоштовні повнотекстові кон'юговані аптамери-суперпарамагнітні наночастинки ферроарабіногалактану для
- Безкоштовні повнотекстові фактори, що впливають на собаче ожиріння, звірів, здається, не залежать від економіки
- Повнотекстові просторово-часові варіації моделей обрізання в атмосфері, що стосуються клімату