Безалкогольна жирова хвороба підшлункової залози 1
Абхішек Матур
Кафедра хірургії, Медична школа Університету Індіани, штат Індіанаполіс, США, США
Меган Марін
Кафедра хірургії, Медична школа Університету Індіани, штат Індіанаполіс, США, США
Дебао Лу
Кафедра хірургії, Медична школа Університету Індіани, штат Індіанаполіс, США, США
Дебора А. Сварц-Базиле
Кафедра хірургії, Медична школа Університету Індіани, штат Індіанаполіс, США, США
Роміль Саксена
Кафедра хірургії, Медична школа Університету Індіани, штат Індіанаполіс, США, США
Микола Ж. Жиромський
Кафедра хірургії, Медична школа Університету Індіани, штат Індіанаполіс, США, США
Генрі А. Пітт
Кафедра хірургії, Медична школа Університету Індіани, штат Індіанаполіс, США, США
Анотація
Передумови. Ожиріння призводить до інфільтрації жиру багатьох органів, включаючи серце, нирки та печінку. В умовах окисного стресу цитокіни, що походять з жиру, виділяються локально і призводять до запального процесу та порушення функції органів. У печінці інфільтрацію жиру називають неалкогольною жировою хворобою печінки, яка може призвести до неалкогольного стеатогепатиту. Немає даних, однак, про вплив ожиріння на жир підшлункової залози та цитокіни, а неалкогольна хвороба жирової підшлункової залози (NAFPD) не описана. Тому ми розробили дослідження, щоб визначити, чи пов’язане ожиріння зі збільшенням жиру в підшлунковій залозі та цитокінів. Матеріали і методи. Тридцять нежирних засобів контролю C57BL/6J і 30 самок мишей із ожирінням, що страждають від лептину, годували 15% жирною дієтою протягом 4 тижнів. У віці 12 тижнів усім тваринам була проведена тотальна панкреатектомія. Панкреати з кожного штаму об'єднали для вимірювання а) вологої та сухої ваги, б) гістологічної присутності жиру, в) тригліцеридів, вільних жирних кислот (ВЖК), холестерину, фосфоліпідів та загального жиру та г) інтерлейкіну (ІЛ) - 1β та фактор некрозу пухлини-альфа (TNF-α). Дані аналізували за допомогою критерію t Стьюдента та точного критерію Фішера. Результати. Підшлункова залоза від ожирілих мишей була важчою (p Ключові слова: Цитокіни, жир, ожиріння, підшлункова залоза
Вступ
Ожиріння стало епідемією в Сполучених Штатах, де понад 50 000 000 американців мають індекс маси тіла (ІМТ)> 30 1. Ожиріння призводить до множинних супутніх захворювань, включаючи діабет, гіпертонію та гіперліпідемію (метаболічний синдром). Крім того, ожиріння спричиняє інфільтрацію жиру кількох органів, включаючи серце, нирки та печінку. В умовах окисного стресу цитокіни, що походять з жиру, виділяються локально і призводять до запального процесу та порушення функції органів. У печінці інфільтрацію жиру називають неалкогольною жировою хворобою печінки (НАЖХП), що може призвести до неалкогольного стеатогепатиту (НАСГ) 2, 3. Крім того, жирова тканина характеризується як ендокринний орган із збільшеною продукцією адипокінів, включаючи лептин і адипонектин, і цитокінів, таких як фактор некрозу пухлини альфа (TNF-α), інтерлейкін-6 (IL-6) та хемотаксичний білок моноцитів -1 (MCP-1) 4. Макрофаги, в свою чергу, виробляють IL-1β та мієлопероксидазу (MPO), які ще більше посилюють запальний процес 4, 5 .
У 1920 р. Шефер повідомив про кореляцію між вагою підшлункової залози дорослої людини та вагою тіла 6. У 1933 р. Огілві виявив 9% жиру підшлункової залози в нежирних трупах порівняно з 17% жиру підшлункової залози в ожирілих трупах 7. У 1960-х та 1970-х роках жир у підшлунковій залозі (панкреатичний ліпоматоз) корелював з віком, ожирінням та діабетом 2, 8, 9 типу. Недавні дослідження комп’ютерної томографії (КТ) та магнітно-резонансної томографії (МРТ) також корелювали жир підшлункової залози із ожирінням 10, 11, 12. Далі спостереження людини припускають, що тяжкість панкреатиту збільшується у пацієнтів із ожирінням 13, 14. Незважаючи на ці спостереження, неалкогольна жирова хвороба підшлункової залози (NAFPD) та неалкогольний стеатопанкреатит (NASP) не описані.
Матеріали і методи
Тварини та дієти
Тридцять худих контрольних (C57BL/6J) і 30 самок мишей з дефіцитом лептину із ожирінням (Lep ob) були отримані з лабораторії Джексона (Bar Harbor, ME, США). Відомо, що миші Lep ob мають гіперплазію острівцевих клітин, діабет II типу та підвищений рівень глюкози та інсуліну в сироватці крові, що свідчить про ендокринну недостатність підшлункової залози 15, 16. Мишей утримували по п’ятьох клітках у світлі (з 6 ранку до 6 вечора) та кімнаті з контролем температури (22 ° С). Протягом 1 тижня екологічної адаптації мишей годували стандартною дієтою чау з низьким вмістом жиру (Ralston Purina, Сент-Луїс, Міссурі, США). У 8-тижневому віці всіх худих C57BL/6J та самок мишей, що страждають ожирінням лептину (Lep ob), годували нежирною дієтою (15% жиру, 45% вуглеводів та 40% білка) (Dyets Inc., Bethlehem, Пенсільванія, США) протягом 4 тижнів. Салом був безводний молочний жир; вуглеводи складали 35% сахарози та 10% кукурудзяного крохмалю; і білок був казеїном. Як тварин, так і їжу зважували щотижня, щоб визначити ріст та споживання їжі. Усі протоколи цих досліджень на тваринах були схвалені Інституційним комітетом з догляду та використання тварин Університету Індіани.
Збір сироватки та тканин
У віці 12 тижнів, після нічного голодування з дозволеною водою, мишей заспокоювали змоченою ізофлураном марлею, поміщеною у скляну банку на 2000 см. Потім їх знеболювали внутрішньоочеревинною ін’єкцією ксилазину (15 мг/кг) та кетаміну (50 мг/кг). Тваринам зважували, а потім проводили лапаротомію та тотальну панкреатектомію. Зріз тканини з восьми спинних підшлункових залоз від кожного штаму поміщали у формалін для вимірювання гістологічної присутності жиру, запалення та фіброзу. Сім підшлункових залоз від кожного штаму використовували для вимірювання вологої та сухої ваги. Шістнадцять спинних підшлункових залоз від кожного штаму об'єднували по два на групу і заморожували до температури -80 ° C для вимірювання тригліцеридів, вільних жирних кислот (FFA), холестерину, фосфоліпідів та загального жиру. Сім дорсальних підшлункових залоз від кожного штаму швидко заморозили до -80 ° C для вимірювання цитокінів IL-1β та TNF-α. Цілу кров відсмоктували із серця і центрифугували для виділення сироватки.
Гістологічний аналіз
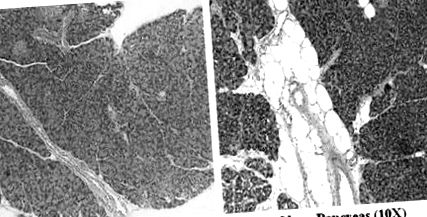
Зразки підшлункової залози, зафіксовані у формаліні, були забарвлені гематоксиліном та еозином та оглянуті спостерігачем, який був засліплений щодо груп. Кожен зразок оцінювали за п’ятьма сильними полями від 0 до 4+ щодо між- та внутрішньодольового жиру, запалення та фіброзу. Загальний показник жиру підшлункової залози обчислювався як сума між- та внутрішньодольового жиру. На рис. 1 A, B показана типова підшлункова залоза у худої та ожирілої миші відповідно.
(A) Типова гістологія підшлункової залози (A) худої миші та (B) ожирілої миші (початкове збільшення × 10).
Аналіз сироватки
Цільну кров обертали при 15000 об/хв протягом 5 хв для виділення сироватки. Сироватку об'єднували для отримання шести пулів для нежирних мишей, а п'ять пулів отримували для ожирілих мишей. Холестерин і тригліцериди в сироватці крові визначали за допомогою ферментативного колориметричного методу для їх кількісного визначення. Набори для цих вимірювань були отримані від Wako Chemicals USA, Inc., Richmond, VA, USA та Stanbio Labs, Boerne, TX, USA.
Аналіз ліпідів жовчного міхура
Ліпіди жовчного міхура з восьми басейнів худорлявих і ожирілих мишей пройшли аналіз ліпідів у Центрі метаболічного фенотипування мишей Медичного центру Університету Вандербільта, як описано раніше Goldblatt et al. 17. Коротко кажучи, ліпіди екстрагували методом Folch-Lees 18. Окремі класи ліпідів розділяли тонкошаровою хроматографією з використанням пластин на силікагелі 60 А та візуалізували за допомогою родаміну 6G. Крім того, загальний холестерин аналізували методом Rudel et al. 19. Аліквоту екстракту Фольха омилювали 1 N KOH у 90% метанолі. Неомилюваний стерол екстрагували за допомогою гексану, а загальний холестерин визначали за допомогою газової хроматографії.
Аналіз цитокінів
Цитокіни IL-1β і TNF-α вимірювали в семи підшлункових залозах від кожного штаму, використовуючи кількісну методику імуноферментного аналізу на сендвіч-ферменти. Набір ІФА для цієї мети було отримано від R&D Systems, Inc. (Міннеаполіс, Міннесота, США).
Статистичний аналіз
Значення - це середнє значення ± SEM.
* p † p Рисунок 6. Обидва цитокіни були значно підвищеними у людей із ожирінням порівняно з нежирними мишами (p ob). Самки мишей годувались дієтою з низьким (15%) жиром протягом 4 тижнів. Підшлункова залоза ожирених мишей була важчою, ніж у їх худих колег. Під час гістологічного дослідження внутрішньодольковий та загальний жир підшлункової залози значно збільшився у мишей із ожирінням. У мишей із ожирінням підвищений рівень холестерину в сироватці крові, але не тригліцеридів. Аналіз ліпідів підшлункової залози виявив помітно підвищений загальний вміст жиру, тригліцеридів та жирних кислот, а також значно підвищений рівень холестерину у мишей із ожирінням. Не було виявлено різниці штамів у рівнях фосфоліпідів підшлункової залози. Насичені ланцюги жирних кислот 14:00 та 16:00 були збільшені в п’ять разів у мишей із ожирінням; 18:00 був збільшений у 2,5 рази у ожирілих мишей. Ненасичені жирні кислоти, які були збільшені більше ніж у чотири рази у повних мишей, включали 16:01, 18:01, 18:02 та 18: 3w3. Цитокіни IL-1β і TNF-α також були значно підвищені в підшлунковій залозі ожиріних мишей.
Оскільки Ogilvie 7 вперше постулював сутність інфільтрації жиру підшлункової залози, більш складні радіологічні методи підтвердили цю вимогу 10, 11, 12. Цікаво, що жир у підшлунковій залозі не розподіляється однорідно по всій залозі 10. Мацумото та ін. запропонував класифікацію інфільтрації жиру підшлункової залози, засновану на щаді жиру в задньому відділі головки підшлункової залози, нецинату та області навколо загальної жовчної протоки. В якості причини запропоновано відмінності в ембріологічному розвитку брушних та спинних бруньок підшлункової залози 10. Подальші вдосконалення процесу кількісного визначення жиру відбулися за допомогою МРТ. Використовуючи 3-точкову техніку Діксона, Kovanlikaya et al. підтвердили кореляцію ІМТ та жиру підшлункової залози 12 .
Підвищена інфільтрація жиру в підшлунковій залозі асоціюється з ожирінням, збільшенням віку, синдромом Кушинга, муковісцидозом та ліпоматозною псевдогіпертрофією 7, 8, 20. Дрейлінг та ін. постулював, що інфільтрація жиру підшлункової залози є оборотним процесом 21. Крім того, Nghiem та співавт. показали, що жирова підшлункова залоза, яка спостерігається при ожирінні, може бути «знежиреною» і успішно використана для трансплантації підшлункової залози 22. Однак надзвичайне жирове заміщення екзокринної підшлункової залози, ймовірно, буде пов'язане зі зниженням функції підшлункової залози. Масивне заміщення жиру було описано в групі ліпоматозної псевдогіпертрофії підшлункової залози 9, 20. Цікаво, що клітини острівців підшлункової залози стійкі до жирової інфільтрації 9, 20 .
Ожиріння призводить до НАЖХП, який може прогресувати до НАСГ, цирозу і, зрештою, гепатоцелюлярного раку 2, 3. Ожиріння, і, що особливо важливо центральне ожиріння, також було пов'язане зі значно підвищеним ризиком раку підшлункової залози 42. Підвищений жир підшлункової залози і, зокрема, жирні кислоти, можуть відігравати роль у прогресуванні NASP до раку. Підтверджуючи цю гіпотезу, показано, що дієта з високим вмістом жиру підвищує ризик раку підшлункової залози як у людей, так і у тваринних моделей 43, 44. Гадріан та ін. та Stolzenberg та ін. також повідомляли, що збільшення споживання дієти насичених жирів збільшує ризик раку підшлункової залози 45, 46. Крім того, Fisher et al. показали, що підвищення рівня FFA у сироватці крові корелює як із зростанням пухлини in vivo, так і in vitro 47. Крім того, вони показали, що лінолева та олеїнова кислоти викликають дозозалежне збільшення росту клітин підшлункової залози. Обидва ці жирні кислоти були підвищені в підшлунковій залозі ожиріних мишей у нашому дослідженні. Однак будуть потрібні подальші дослідження, щоб визначити, чи вроджені миші з ожирінням із підвищеним жиром підшлункової залози схильні до раку підшлункової залози.
У цьому дослідженні зафіксовано, що у мишей, що страждають ожирінням, важча підшлункова залоза та більше жиру підшлункової залози, особливо тригліцеридів та жирних кислот, а також підвищений вміст цитокінів. Ми робимо висновок, що ожиріння призводить до інфільтрації жиру підшлункової залози, яку можна назвати неалкогольною жировою хворобою підшлункової залози. Це спостереження може мати наслідки щодо тяжкості панкреатиту у пацієнтів із ожирінням, а також асоціації ожиріння з раком підшлункової залози. Таким чином, накопичення токсичних жирів та прозапальних цитокінів у підшлунковій залозі, стеатопанкреатит, може бути ключовим для патогенезу як панкреатиту, так і раку підшлункової залози.
Подяки та розголошення
Це дослідження було підтримане грантом NIH R-01 DK44279.
- Натуральна сполука в овочах допомагає боротися з жировою хворобою печінки EurekAlert! Новини науки
- Визначено можливий сигнальний шлях у боротьбі із ожирінням, пов’язаним із жировою хворобою печінки
- Вчені ближче до розгадки таємниці, чому худі люди хворіють на жирову хворобу печінки
- Ожиріння та хвороби нирок приховані наслідки епідемії Future Science OA
- Нове дослідження; П’ять здорових звичок; Для дієти, фізичних вправ, ІМТ, куріння; Алкоголь; Нижня хронічна хвороба,