Бета-лактоглобулін
Бета-лактоглобулін містить 22 лей, 10 іль та 9 валів (10 у варіанті А) у молекулі, що робить його одним із найбагатших відомих джерел їжі цих амінокислот та надає йому деяких сильно гідрофобних областей.
Пов’язані терміни:
- Пептид
- Казеїн
- Альфа-лактальбумін
- Ферменти
- Білки
- Сироватковий білок
- Сироватка
- Молочні білки
- Каппа-Казеїн
- Бичачий сироватковий альбумін
Завантажити у форматі PDF
Про цю сторінку
Будова та стійкість сироваткових білків
Патрік Дж. Б. Едвардс, Джеффрі Б. Джеймсон, в Молочні білки (друге видання), 2014
Бичачий β-лактоглобулін 203
Молекулярна структура β-лактоглобуліну великої рогатої худоби 203
Будова β-лактоглобуліну великої рогатої худоби у водному розчині 205
Мономер-Дімер рівновага β-лактоглобуліну великої рогатої худоби у водному розчині 206
Дослідження β-лактоглобуліну великої рогатої худоби методом ЯМР при нейтральному рН 207
Динаміка β-лактоглобуліну великої рогатої худоби 208
Структури β-лактоглобулінів інших видів 209
Зв’язування ліганду з β-лактоглобуліном 210
Вплив температури на бичачий β-лактоглобулін 213
Вплив тиску на бичачий β-лактоглобулін 216
Вплив хімічних денатурантів на бичачий β-лактоглобулін 218
Фібрилярна формація з бичачого β-лактоглобуліну 219
Молоко | Рідке молоко
β-Лактоглобулін
β-Lg є основним сироватковим білком в молоці більшості ссавців, але його немає в молоці людей, лагоморфів, гризунів та верблюдів. Виділено дві різні форми β-Lg коней, позначені β-Lg I та II, які містять 162 та 163 амінокислоти відповідно. Асинінове молоко також має дві форми β-Lg, β-Lg I та II, хоча недавнє дослідження на сицилійському ослиному молоці показало, що> 23% тварин не мали β-Lg II. Визначено два генетичні варіанти асиніну β-Lg I, A та B та три генетичні варіанти асиніну β-Lg II, A, B та C. Конячий β-Lg I має молекулярну масу 18 500 Да та ізоелектричний рН 4,85, тоді як конячий β-Lg II має молекулярну масу 18 262 Да, незважаючи на наявність додаткової амінокислоти та ізоелектричний рН 4,7. На відміну від β-Lg великої рогатої худоби, β-Lg коней не містить вільної сульфгідрильної групи. У жуйному молоці β-Lg існує як димер при природному рН, тоді як у конячому молоці β-Lg зустрічається у мономерній формі.
Аналітичні методи | Біосенсори
Молочні алергени
β-лактоглобулін (β-LG) є основним сироватковим білком і є відомим алергеном. У ряді країн виробники харчових продуктів згідно із законодавством зобов'язані надавати інформацію про маркування щодо наявності або відсутності β-LG. Біосенсор з ефектом посиленого резонансу (REA) був використаний в імунологічному сендвіч-аналізі, використовуючи антитіла, мічені монодисперсними колоїдними кластерами золота для β-LG. Ця система змогла виявити β-LG при 100 нг мл -1. SPR-біосенсор з сендвіч-аналізом дозволив виявити рівень алергену до 1-12,5 мкг г -1 .
Білки сироватки в дитячих сумішах
Марк А. Фенелон,. Eoin G. Murphy, у Whey Proteins, 2019
12.2.2.2 β-Лактоглобулін
Власний β-Lg стійкий до шлункового травлення in vivo, але засвоюється кишковими ферментами. Однак деякі інтактні β-Lg можна виявити аж до клубової кишки (Sanchón et al., 2018). Оскільки β-Lg не є компонентом жіночого молока, інтактний білок є алергеном для більшості немовлят (Chatterton, Nguyen, Bering, & Sangild, 2013), і його видалення може стати основою гіпоалергенного ІФ. Прийом інтактного β-Lg стимулює вироблення клітин Treg, специфічних для β-Lg, у клітинах клітин мишачого Пейєра (Adel-Patient et al., 2011). β-Lg розщеплюється в кишечнику, і порівняно з інтактним β-Lg, гідролізований β-Lg викликає лише місцеву стимуляцію Treg і відсутність стимуляції алергічної відповіді у мишей (Adel-Patient et al., 2011).
Цікаво, що β-Lg має високу (83%) амінокислотну гомологію з людським глікоделіном А, білком, який бере участь у підтримці імунної системи фето-матері (Van Cong et al., 1991). Глікоделін А пригнічує всі основні імунні клітини, включаючи відповіді Th1 і Th2 (Ogge et al., 2011; Scholz et al., 2008). Більше того, моноклональні антитіла, виділені проти β-Lg, перехресно реагують з глікоделіном А (Dutta, Mukhopadhyay, Roy, Das, & Karande, 1998). Невідомо, чи природні антитіла до β-Lg перехресно реагують з глікоделіном А, чи β-Lg пов’язаний із подібними діями, що й глікоделін А (Chatterton et al., 2013).
Том 2
Лей-Вень Сян,. Айвенго К.Х. Leung, в Encyclopedia of Food Chemistry, 2019
Вступ
β-Лактоглобулін - це глобулярний білок, який присутній у молоці багатьох видів ссавців, включаючи жуйних, таких як корови та вівці, та деяких не жуйних, таких як свині та коні (Kontopidis et al., 2004; Sawyer and Kontopidis, 2000 ). β-лактоглобулін є основним білком сироватки в молоці. Наприклад, на нього припадає близько 10% від загальної кількості білків молока в коров’ячому молоці. Дивно, але β-лактоглобуліну немає в молоці людей та інших видів, включаючи деяких гризунів, кроликів, верблюдів та лам.
Незважаючи на те, що β-лактоглобулін був відкритий та виділений понад 80 років тому, на сьогоднішній день жодним функціям остаточно не приписується білок (Kontopidis et al., 2002; Pérez and Calvo, 1995). Вважається, що β-лактоглобулін є транспортним білком для різних малих молекул. До них належать, але не обмежуються цим, жирні кислоти, поліфеноли та ретиноли. Метою цього огляду є узагальнення недавніх досліджень щодо зв'язування між β-лактоглобуліном та запропонованими лігандами. Огляд зосереджений на взаємодіях зв’язування з β-лактоглобуліном у його нативній структурі при фізіологічно значущих температурах. Теплоіндуковані агрегати або аддукти між β-лактоглобуліном і малими молекулами виходять за межі огляду.
Молоко | Молоко приматів
β-Лактоглобулін
β-Lg, основний WP у молоці більшості видів, але який відсутній у молоці людей, морських свинок, гризунів та кроликів, є дуже добре охарактеризованим білком (див. МОЛОЧНІ БІЛКИ | β-Лактоглобулін). β-Lg ідентифіковано в молоці бабуїна, циномольгуса, резуса та верветової мавпи. Послідовність 26 N-кінцевих залишків β-Lg мавпи циномольгуса на 54% гомологічна β-Lg великої рогатої худоби. Павіан β-Lg зустрічається у трьох генетичних варіантах, A, B та C, з pI 5,25, 5,45 та 5,75 відповідно. Він містить 168 амінокислотних залишків порівняно з 162 для бичачого бика; різниця обумовлена вставкою восьми амінокислот між залишками 61 і 62 (нумерація великої рогатої худоби) та видаленням залишків 109 і 112. Має видиму масу (за SDS-PAGE) 20 750 Да (приблизно такий же МВт, як і Резус β-Lg), порівняно з 18 281 Да для бичачого β-Lg. Бабуїн β-Lg більше схожий на людський білок глікоделіну (глікозильований гомолог β-Lg, знайдений в матці людини та бабуїна і вважається, що виконує захисну роль, оскільки ембріон вбудований), ніж на бичачий β-LgA.
β-Lg деяких видів має вільну групу –SH, тоді як у інших - ні; деякі існують як димери при нейтральному рН, інші ні (ці характеристики не пов’язані) (див. ПРОТЕІНИ МОЛОКА | β-лактоглобулін). Про ці властивості не повідомлялося для β-Lg приматів.
Гомологія (%) бабуїна β-Lg з відповідним білком інших видів - овець, 51,3; північний олень, 51,8; свиня, 48,7; кінь, 55,6; кішка, 56,8; та дельфінів, 54,9 (див. БІЛКИ МОЛОКА | β-Лактоглобулін).
Нам не відомі повідомлення про наявність β-Lg у молоці Великих мавп. Враховуючи відсутність цього білка в жіночому молоці, передбачається, що він також відсутній у молоці нелюдських мавп. Розширення кола приматів, яким відомий статус β-Lg, бажано.
Нанофібрили бета-лактоглобуліну для інкапсуляції харчових інгредієнтів
Анотація
β-лактоглобулін (β-LG) становить приблизно 10% усіх молочних білків, стаючи головним білком сироватки. Нанофібрили β-LG (β-LG-N) були підготовлені на основі різних фізико-хімічних або ферментативних процесів. Особливо за останні два десятиліття їх виробництво β-LG-N було широко досліджено. Вплив термічної обробки та експериментальних параметрів, таких як ферменти, солі та рН, на сьогодні добре охарактеризовані. Завдяки взаємодії між залишками білків та різними харчовими інгредієнтами, β-LG-N служив корисним інструментом для інкапсуляції та стабілізації харчових інгредієнтів. Використання β-LG-N у виробництві харчових продуктів може мати багато функціональних можливостей, оскільки вони є їстівними, диспергованими у воді з хорошими емульгуючими властивостями та потенційно доставляють біоактивні речовини. Різні фактори, такі як довжина фібрили, концентрація, гнучкість та значення рН, впливають на їх емульгуючі властивості. Тут буде розглянуто інкапсуляцію активних сполук у системах β-LG-N, тестування їх стійкості до травлення та зберігання, а також характеристик вивільнення.
Структурна основа поліморфізму амілоїдоподібних фібрил β-лактоглобуліну
Corianne C. van den Akker,. Гійсє Х. Кендерінк, у Біо-нановізуалізації, 2014
Чому β-Лактоглобулін?
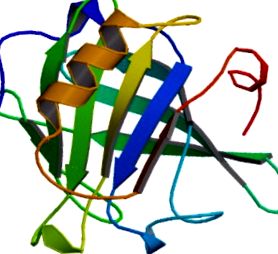
β-лактоглобулін (β-lg) є основним білком сироватки і становить 0,2–0,4% (мас./об.) знежиреного молока [1]. У самородному стані β-lg має переважно β-листову структуру (рис. 31.1) [2]. Нагріваючись, він здатний самостійно складатися в різноманітні надмолекулярні структури. Волокна в тонкосвітлих гелях, що утворюються при інкубації нижче ізоелектричної точки (рН 5,1) [3], були визначені як амілоїдні фібрили [4]. β-lg має велике значення для молочної промисловості, як і інші сироваткові білки, і особливо корисний для контролю текстури різноманітних продуктів харчування [5–7]. У той же час його регульована структурна здатність робить β-lg цікавою мішенню для матеріалознавства [8]. Крім того, β-lg став основною модельним білком для дослідження механізму самозбірки амілоїдних фібрил [2,3,9]. Незважаючи на те, що кінетика утворення та морфологія β-lg амілоїдних фібрил були широко вивчені, вторинна структура фібрил досі ще не з’ясована до кінця. Тут ми розглядаємо накопичені дотепер знання про взаємозв’язок між морфологією фібрили та базовою молекулярною структурою амілоїдів β-lg за допомогою різноманітних експериментальних методів.
РИСУНОК 31.1. Структура бичачого β-лактоглобуліну з гетероядерної ЯМР-спектроскопії. Мономерна структура самородного стану містить восьмиланцюговий безперервний антипаралельний β-ствол і одну основну α-спіраль.
Передруковано з дозволу Kuwata et al (Protein Science 1999) [10] .
Молоко: огляд
β-Лактоглобулін
β-лактоглобулін (β-Lg) представляє bo50% білків сироватки, ∼12% від загальної кількості білків у бичачому молоці. Це типовий глобулярний білок, який характеризується дуже добре. Велику літературу серед іншого переглянули Сойєр (2003; 2013) та Крімер та ін. (2011) .
β-Lg є основним сироватковим білком у молоці великої рогатої худоби, буйволів, овець та коз, хоча існують незначні міжвидові відмінності. Спочатку вважалося, що β-Lg зустрічається лише в молоці жуйних тварин, але зараз відомо, що подібний білок зустрічається в молоці багатьох інших видів, включаючи свиноматку, кобилу, кенгуру, дельфіна та ламантина. Однак β-Lg не зустрічається в молоці людини, щурів, мишей, морської свинки, верблюда, лами або альпаки, в яких α-La є основним білком сироватки.
Бичачий β-Lg складається з 162 амінокислотних залишків на мономер з МВт ~ 18 кДа; встановлено його послідовність амінокислот та послідовність деяких інших видів. Його ізоелектрична точка становить ∼pH 5,2. Він містить два внутрішньомолекулярні дисульфідні зв’язки та один моль цистеїну на мономер. Цистеїн особливо важливий, оскільки він вступає в реакцію після термічної денатурації з міжмолекулярним дисульфідом κ-казеїну та суттєво впливає на коагуляцію сичугу та термостійкість молока. Він також відповідає за приготовлений аромат підігрітого молока. Деякі β-Lgs (наприклад, свинячий) не мають сульфідрильної групи. Визначено дванадцять генетичних варіантів бичачого L-Lg великої рогатої худоби, найпоширеніший - А і В. Генетичний поліморфізм також зустрічається у β-Lg інших видів.
β-Lg є високоструктурованим білком: у діапазоні pH 2–6 10–15% молекули існує у вигляді α-спіралей, 43% у вигляді β-листів та 47% у вигляді невпорядкованих структур, включаючи β-витки; β-аркуші трапляються в чашечці β-бочки. Молекула має дуже компактну кулясту структуру. Кожен мономер існує майже як куля, має діаметр близько 3,6 нм, і існує як димер, МВт ~ 36 кДа, в діапазоні рН 5,5–7,5, як мономер
рН 7,5 та у вигляді тетрамеру (МВт, ~ 144 кДа) у діапазоні рН 3,5–5,5. Свині та інші β-Lgs, яким бракує вільного тіолу, не утворюють димерів, властивість, яка, ймовірно, не обумовлена відсутністю тіолової групи.
β-Lg дуже стійкий до протеолізу у своєму рідному стані; ця особливість свідчить про те, що її основна функція не є харчовою. Він може виконувати одну або обидві з двох біологічних ролей:
Він зв’язує ретинол (вітамін А) у гідрофобній кишені, захищає його від окислення та транспортує через шлунок до тонкої кишки, де ретинол переноситься на білок, що зв’язує ретинол, який має подібну структуру з β-Lg. Незрозуміло, як ретинол переноситься з ядра жирових кульок, де він зустрічається в молоці, до β-Lg і чому деяким видам не вистачає цього білка. β-Lg може зв'язувати багато гідрофобних молекул, а отже, його здатність зв'язувати ретинол може бути випадковою. β-Lg є членом сімейства ліпокалінів, які мають властивості зв'язування (Akerstrom et al., 2000).
Завдяки своїй здатності зв’язувати жирні кислоти, β-Lg стимулює активність ліпази, що може бути найважливішою її фізіологічною функцією.
β-Lg є найбільш алергенним білком у бичачому молоці для немовлят, і існує інтерес до виробництва сироваткових білкових продуктів без β-Lg для використання у дитячих сумішах. β-Lg має дуже хороші термогелюючі властивості і визначає гелеутворення концентратів сироваткового білка (WPC).
- Агент проти ожиріння - огляд тем ScienceDirect
- Aconitum - огляд тем ScienceDirect
- Хвороба жовчних шляхів - огляд тем ScienceDirect
- Апітерапія - огляд тем ScienceDirect
- Харчування люцерни - огляд тем ScienceDirect