Атипова мікроРНК2911, кодована жимолостями, безпосередньо націлена на віруси грипу А
Предмети
Анотація
Вступ
Віруси грипу А (ВГА) становлять значну загрозу здоров’ю населення у всьому світі. У минулому столітті було три великі пандемії грипу, які спричинили високий рівень смертності, включаючи найсерйознішу пандемію в історії, зафіксовану іспанським грипом 1918 року, яка спричинила понад 50 мільйонів смертей людей 1,2. Високопатогенний підтип H5N1 та нещодавно зареєстрований підтип H7N9 показали потенціал викликати нові пандемії грипу людини 3,4,5. Висока мінливість патогенних ІАВ дозволяє їм стати стійкими до різних профілактичних методів лікування, включаючи вакцини та антитіла 6. Опеньки (HS, Lonicera japonica), добре відома китайська трава, вже тисячі років використовується для ефективного лікування грипозної інфекції. Кілька звітів показали, що відвар ГС може придушити реплікацію вірусу грипу 7,8. Однак активні сполуки у відварі ГС та механізм блокування вірусної реплікації залишаються незрозумілими.
З іншого боку, наше попереднє дослідження показало, що MIR168a, отриманий з харчових рослин, може проходити через шлунково-кишковий тракт (ШКТ) і потрапляти в кровообіг та різні органи мишей. У печінці миші рослина MIR168a націлена на білок 1-адаптера до рецепторів ліпопротеїнів низької щільності (LDL) (LDLRAP1), що призводить до підвищення рівня холестерину LDL у плазмі 9. Це дослідження відкрило шлях для вивчення фізіологічної функції екзогенних рослинних мікроРНК (miРНК) у людини та тварин. Однак наслідки екзогенної регуляції крос-королівства, опосередкованої мікроРНК рослин, і механізми, відповідальні за поглинання та перенесення рослинних мікроРНК, залишаються в основному невідомими, що підкреслює необхідність подальших досліджень. Враховуючи, що пацієнтам з грипозною інфекцією традиційно вводили відвар ГС, ми припускаємо, що рослинна міРНК у відварі ГС здатна потрапляти в організм людини через шлунково-кишковий тракт для здійснення терапевтичного ефекту. У цьому дослідженні ми показали, що рослинна мікроРНК, збагачена відваром HS, під назвою MIR2911, безпосередньо націлена на різні підтипи грипу А, як в пробірці і в природних умовах.
Результати
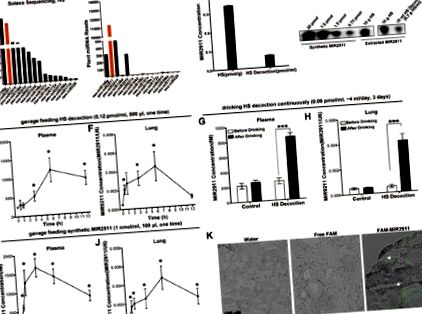
Рослина MIR2911 всмоктується і доставляється в легені мишам після введення відвару HS або синтетичного MIR2911
Поглинання оцінювали у мишей, яким вводили 500 мкл відвару HS (концентрація MIR2911: ∼ 0,12 пмоль/мл) шляхом одноразового годування. Базальна концентрація MIR2911 у плазмі миші становила 242,0 ± 23,8 фМ; концентрація MIR2911 у плазмі збільшилася до 517,1 ± 133,6 фМ через 3 год, досягла піку 1189,2 ± 323,1 фМ через 6 год і знизилася до 923,0 ± 189,3 фМ через 12 год після введення відвару ГС (рис. 1Е). Фігура 1F показала, що рівень MIR2911 у легенях миші постійно підвищувався, досягав пікового рівня через 6 годин і знижувався до базального рівня через 12 годин після введення. Більша частина MIR2911 у периферичній крові миші була виявлена у фракції, що містить мікровезикули, отримані з клітин (додаткові відомості, малюнок S3A), маючи на увазі, що MIR2911 у відварі HS може спочатку бути перенесений із шлунково-кишкового тракту, перефасований у MV клітини епітелію кишечника і, нарешті, секретуються в кровообіг. Дані імунопреципітації показали, що більшість MIR2911 у MV, отриманих з периферичної крові миші, були пов’язані з комплексом Argonaute 2 (AGO2) (Додаткова інформація, Рисунок S3B).
Рослина MIR2911 безпосередньо зв’язується з деякими типами ІАВ та інгібує кодовану вірусом H1N1 експресію білка PB2 та NS1, а також реплікацію вірусу H1N1 в пробірці
Рослина MIR2911 рятує індуковану вірусом втрату ваги та інгібує реплікацію вірусу у мишей, щеплених H1N1
Противірусний ефект відвару HS та MIR2911 був додатково випробуваний на мишах, інфікованих H1N1. У цьому експерименті 6-тижневим самкам мишей BALB/c вводили синтетичний MIR2911 (0,1 нмоль на день) шляхом елюювання або дозволяли пити відвар HS за один день до того, як їх щепили 10 6 вірусом EID50 H1N1. Після інокуляції вірусу мишей постійно обробляли відваром MIR2911 або HS протягом 7 днів. Як показано на малюнку 3А, миші, інфіковані H1N1 самостійно або одночасно оброблені H1N1 і ncRNA, швидко втратили ∼ 20% своєї ваги на 7-й день. На відміну від цього, як введення синтетичного MIR2911, так і постійне пиття відвару HS ефективно запобігали втраті ваги (6 EID50), в якому сайти, що зв'язують MIR2911 в гені PB2 та NS1, мутували без зміни амінокислотних послідовностей (Додаткова інформація, Малюнок S6), використовували для зараження мишей. Як показано на малюнку 3D та 3E, мутант H1N1 також спричиняв втрату ваги та мав високий вірусний титр, подібний до типу дикого типу H1N1. На відміну від цього, ні синтетичний MIR2911, ні відвар HS не впливали на втрату ваги та титр вірусу у мишей, інфікованих мутантом H1N1 (Рисунок 3D-3F).
Рослина MIR2911 інгібує вірусну реплікацію H5N1 та H7N9 в пробірці і в природних умовах і рятує смертність, спричинену щепленням H5N1
Також було перевірено інгібуючу дію синтетичного відвару MIR2911 та HS на нещодавно повідомлений вірус грипу H7N9. A/Anhui/1/2013 (H7N9), раніше виділений від пацієнта в Китаї 5, був використаний у наступних експериментах. Як показано на малюнках 4G та 4H, реплікація вірусу H7N9 в інфікованих клітинах MDCK була сильно пригнічена синтетичним MIR2911 або загальною РНК, вилученою з відвару HS (log log TCID50/ml для синтетичного MIR2911 було зменшено з 3,86 ± 0,16 до 2,80 ± 0,25 через 12 год та з 6,02 ± 0,17 до 5,13 ± 0,16 через 24 год після трансфекції; значення log TCID50/мл для загальної РНК, витягнутої з відвару ГС, було зменшено з 4,17 ± 0,08 до 2,99 ± 0,38 через 12 год та з 6,24 ± Від 0,04 до 5,49 ± 0,15 через 24 год після трансфекції). Інгібуючу дію загальної РНК відвару HS знову було скасовано шляхом спільної трансфекції з антагоміром проти MIR2911 (Малюнок 4Н). Також оцінювали вплив синтетичного відвару MIR2911 або HS на втрату ваги у мишей, інфікованих H7N9. Як показано на малюнку 4I, миші, які отримували лише вірус або H7N9 плюс ncRNA, демонстрували майже 30% або 20% втрати ваги відповідно на 8 день після зараження. Синтетичний MIR2911 частково запобігав втраті ваги, спричиненій H7N9 (
Обговорення
У традиційній китайській медицині трави зазвичай варять протягом декількох годин, щоб приготувати відвар. Прийнято вважати, що РНК буде знищена під час цього процесу. Дійсно, наші дані показали, що більшість мікроРНК (наприклад, MIR166g та MIR2914), збагачені HS, деградували під час процесу кипіння. Однак спеціальна мікроРНК, MIR2911, виявилася значною мірою інтактною в остаточному відварі HS. MIR2911, раніше повідомлялося як рослинна міРНК в Росії Populus euphratica, Нікотіана табакум і Helianthus annuus 15,16,17, є нетиповою мікроРНК, оскільки вона отримана з рибосомної РНК (рРНК) і не відповідає класичному біоРегенезу мікроРНК 18,19,20. Хоча механізм, що лежить в основі високої стабільності MIR2911 під час процесу кипіння, залишається невідомим, наші дані вказують на те, що унікальна послідовність та високий вміст ГХ можуть сприяти його стабільності. Стійкість MIR2911 до процесу кипіння або навіть обробки РНКазою була скасована після зміни послідовності та зменшення вмісту ГХ. Результати показують, що міРНК може бути важливим, потенційно ефективним, але раніше невизнаним компонентом китайських трав.
Одним із знаків питання про потенційну біологічну функцію рослинної міРНК у клітинах ссавців є рівень цієї екзогенної мікроРНК. Оскільки зустріч з ціллю відбувається масовою дією, і низько виражені міРНК мають меншу ймовірність зустріти мішені, що містять транскрипти 21, міРНК, виражена під пороговою концентрацією (22, середнє число копій MIR2911 у кожній клітині легені миші досягає 300-400, що значно перевищує мінімальний рівень, необхідний для виконання міРНК своєї функції. Відповідно до цього ми показали, що концентрація MIR2911 у легенях миші майже дорівнює концентрації ендогенного miR-25. Таким чином, MIR2911 виконує вимогу щодо порогової концентрації міРНК На підтвердження цього, в природних умовах Дослідження показало, що MIR2911 може інгібувати реплікацію вірусів H1N1, H5N1 та H7N9 на моделі миші, запобігати втраті ваги, спричиненої вірусною інфекцією, і навіть зменшувати смертність, спричинену інфекцією.
На закінчення, у цьому дослідженні наведено перші докази того, що високостійка рослина MIR2911 може безпосередньо націлюватись на множинні вірусні гени різних ІАВ і, таким чином, придушувати вірусні інфекції. Завдяки своїй антивірусної активності широкого спектру дії проти ІАВ, відвар HS, що містить MIR2911 та MIR2911, може представляти нову ефективну терапевтичну стратегію, яка може бути використана для подолання смертельних інфекцій ІАВ. Важливо зазначити, що з тих пір, як Флемінг майже століття тому відкрив пеніцилін, антибіотики були розроблені для боротьби з різними бактеріальними інфекціями та врятували життя мільйонам людей. На жаль, досі не виявлено жодного природного продукту, ефективного проти вірусної інфекції. Ми припускаємо, що як перший природний продукт, безпосередньо націлений на ІАВ, MIR2911 є "вірусологічним пеніциліном", який служить новим терапевтичним та профілактичним засобом проти не тільки грипу А, але й потенційно інших типів вірусів.
Матеріал та методи
Заява про біобезпеку
Усі експерименти з живими вірусами H5N1 та H7N9 проводилися в рамках посиленого рівня біобезпеки тварин 3 (ABSL3 +) в HVRI CAAS, який був схвалений для такого використання Міністерством сільського господарства Китаю та Китайською національною службою акредитації з оцінки відповідності. Всі дослідження на тваринах були схвалені Радою з огляду HVRI, CAAS.
Віруси
Вірус H1N1 A/Sichuan/1/2009 (SC/09) був виділений з першого випадку захворювання людини пандемією грипу 2009 року в Китаї 11. Вірус H5N1 A/Anhui/2/2005 (AH/05) був виділений з респіраторних зразків пацієнта зі смертельним наслідком з провінції Аньхой у Китаї в 2005 році 14. Вірус H7N9 A/Anhui/1/2013 (AH/13) був виділений з респіраторних зразків пацієнта зі смертельним наслідком з провінції Аньхой у Китаї в 2013 році 5. Мутант SC/09 був створений шляхом зворотної генетики. Всі врятовані віруси були послідовно розподілені для виключення небажаних мутацій. Запас вірусу розмножували у специфічних курячих яйцях, що не містять патогенів.
Опеньки
HS було придбано в китайському магазині фітотерапії. Відвар ГС готували кип’ятінням 10 г ГС у 100 мл води протягом 30 хв, в результаті чого отримували deco 50 мл відвару.
Глибоке секвенування ілюмінації
Невеликі РНК виділяли з 1 г HS або 5 мл відвару HS, використовуючи універсальний набір MicroRNA Kit (Bioteke, Пекін, Китай) відповідно до інструкцій виробника. Секвенування зразків РНК ілюмінацією проводили BGI (Шеньчжень, Китай). Після видалення послідовностей адаптерів із вихідних даних, чисті показники порівнювали з відомими попередниками miRNA та зрілими miRNA з бази даних miRBase 14.0 для ідентифікації збережених рослинних miRNA на основі алгоритму Сміта-Вотермана. Всі дані були завантажені в базу даних GEO (номер приєднання GEO: GSE55268).
Виділення РНК та RT-qPCR зрілих мікроРНК
Невеликі РНК (метод ΔΔCt. Для розрахунку рівнів абсолютної експресії цільових міРНК ряди синтетичних олігонуклеотидів miRNA у відомих концентраціях були зворотно транскрибовані та ампліфіковані. Потім обчислювали абсолютну кількість кожної miRNA відповідно до стандартної кривої. Кількісна ПЛР проводили за допомогою апарата для ПЛР ABI-7900.
Аналіз Норт-блоттингу
Олігонуклеотидні зонди, комплементарні зрілим мікроРНК, були кінцево мічені γ- 32 P-ATP з використанням полінуклеотидної кінази Т4 (Takara, Далянь, Китай), а мічені зонди очищали за допомогою спінової колонки Sephadex G25 (Roche, Indianapolis, IN, USA). Невелику РНК екстрагували з 10 г HS або 10 мл відвару HS. Зразки РНК фракціонували за допомогою PAGE із використанням 15% денатураційного поліакриламідного гелю. Потім РНК переносили на нейлонову мембрану (Hybond N +, Amersham Biosciences, Piscataway, штат Нью-Джерсі, США) за допомогою електроблотингу при 400 мА в буфері 0,5 × TBE протягом 1,5 год. Мембрана була зшита і висушена. Проводили стадію попередньої гібридизації шляхом інкубації мембрани 10 мл розчину ULTRAhyb-Oligo (Ambion, Остін, Техас, США) при 37 ° C протягом 1 години. Радіомаркований зонд додавали безпосередньо до розчину ULTRAhyb-Oligo, і мембрану інкубували протягом ночі при 37 ° C з обертанням у гібридизаційній печі. Після гібридизації мембрану двічі промивали при низькій жорсткості в 2 × SSC, 0,1% SDS при 42 ° C протягом 10 хв. Мембрану обмотували поліетиленовою плівкою і піддавали дії рентгенівської плівки при -80 ° C.
Ізоляція МВ
MV були виділені з плазми шляхом диференціального центрифугування згідно з попередніми публікаціями 23. Коротко кажучи, після видалення клітин та іншого сміття центрифугуванням при 300 × g, 1200 × g і 10 000 × g, супернатант центрифугували при 110 000 × g протягом 2 год (всі етапи проводили при 4 ° С). МВ збирали з гранул і ресуспендували в середовищі, що не містить FBS.
Імунопреципітація
MV ресуспендували у відповідному обсязі повного буфера лізису імунопреципітації (20 мМ Tris-HCl, рН 7,5, 150 мМ NaCl, 0,5% NP-40, 2 мМ EDTA, 0,5 мМ дитиотрейтолу (DTT), 1 мМ NaF, 1 × протеаза інгібітор і 1 × PMSF) протягом 30 хв на льоду. Лізати імунопреципітували мишачим моноклональним антитілом проти AGO2 або мишачим нормальним IgG, а потім білком G-агарози. Після очищення иммунопреципитированную РНК екстрагували за допомогою miRNeasy Mini Kit (Qiagen) та аналізували за допомогою RT-qPCR з використанням зондів TaQMan miRNA (Applied Biosystems).
Біоінформатичний аналіз
Геноми вірусу грипу були зібрані з ресурсів вірусу грипу на NCBI 24. RNAhybrid 10 використовували для сканування потенційних мішеней MIR2911 у послідовності вірусів, дотримуючись двох правил. По-перше, мінімальна енергія згортання була нижче -20 ккал/моль. По-друге, гібридна область між областю насіння miRNA та вірусною послідовністю не містила невідповідностей. Необов’язкове правило для прогнозування цілей вимагало збереження передбачуваних місць зв’язування серед тих самих підтипів грипу А.
Аналіз плазмідної провідності та люциферази
Послідовності зв'язування мішеней MIR2911 та мутантів (Invitrogen) були синтетично поміщені в область 3'UTR плазміди звіту pMIR (Ambion), і ефективне введення було підтверджено секвенуванням. Для аналізів репортерів люциферази 0,2 мкг репортерної плазміди люциферази світлячка, 0,2 г вектора експресії β-галактозидази (Ambion) та однакові кількості (20 пмоль) зрілого MIR2911 або ncRNA трансфікували в клітини в планшетах з 24 лунками. Вектор β-галактозидази використовували як контроль трансфекції. Через 24 години після трансфекції клітини аналізували за допомогою набору для аналізу люциферази (Promega, Madison, WI, USA).
Вестерн-блот-аналіз
PB2 або NS1 плазміди ко-трансфікували синтетичним MIR2911 або нкРНК у клітини HEK293T з використанням ліпофектаміну 2000 (Invitrogen) відповідно до інструкцій виробника. Зразки культивованих клітин лізували в буфері RIPA (0,5% NP-40, 0,1% дезоксихолату натрію, 150 мМ NaCl, 50 мМ трис-HCl, рН 7,5); лізати розчиняли за допомогою 10% SDS-PAGE, переносили на мембрану PVDF (Millipore, Bedford, MA, USA) і зондували антитілами проти PB2, anti-NS1 або anti-GAPDH (Santa Cruz Biotechnology, Santa Cruze, CA, США).
В пробірці вивчення
MIR2911 або ncRNA трансфікували в клітини MDCK, використовуючи Lipofectamine 2000 (Invitrogen) відповідно до інструкцій виробника. Потім оброблені клітини MDCK заражали вірусом при кратності зараження 0,1 при 37 ° С. Через 1 год інкубації клітини промивали теплим PBS та інкубували в середовищі DMEM, доповненому 100 ОД/мл пеніциліну, 100 мкг/мл стрептоміцину, 2 мкг/мл обробленого ТРСК трипсину та 0,2% фракції бичачого сироваткового альбуміну V. Супернатанти збирали через 12 або 24 год і зберігали при -70 ° C для аналізу TCID50. В окремому експерименті клітини MDCK трансфікували загальною РНК, екстрагованою з HS або з HS плюс антагомір проти MIR2911. Лікування проводили, як описано вище.
Миша дослідження
Для вивчення кінетики MIR2911 у мишей мишей годували з відваром HS (концентрація MIR2911: 0,12 нМ) або 0,1 нмоль синтетичного MIR2911. Для відвару HS отримували зразки плазми п'яти груп мишей (6 мишей на групу) до лікування в якості контролю. Потім мишей годували відваром HS. У кожному інтервалі часу (0,5, 1, 3, 6 або 12 год) мишей забивали, відбирали зразки плазми та виділяли загальну РНК. Для збору зразків тканин шість груп мишей (по 5 мишей на групу), включаючи контрольну групу, забивали у встановлений інтервал часу. Для синтетичного MIR2911 п’ять груп мишей (по 5 мишей на групу) отримували 100 штук пмоль синтетичного MIR2911. Через фіксований інтервал часу (0,5, 1, 3, 6 або 12 год) мишей забивали, відбирали зразки плазми та тканини. Зразки плазми та тканини також відбирали у мишей без обробки, щоб служити контролем.
В окремому експерименті дві групи мишей годували відваром HS (концентрація MIR2911: 0,06 нМ) або стерильною водою протягом 3 днів з подальшим забором плазми та тканин. З цих зразків виділяли загальну РНК. Для виявлення рівня MIR2911 у цих зразках було проведено RT-qPCR.
- Методи максимізації утримання при дослідженнях схуднення - Greenway - 1999 - Дослідження ожиріння - Wiley
- Періодичне голодування для схуднення Що говорять дослідження; Кіон
- Взаємодія між атиповими антипсихотиками та мікробіомом кишечника в когорті біполярних хвороб -
- Низький циркулюючий рівень CD4 CD25 Foxp3 T Нормативний рівень клітин передбачає ризик викидня у новонароджених
- Міжнародний журнал сучасних досліджень та оглядів (IJCRR)