Аоп: 144
Це застаріле зображення цього AOP. Подивіться поточну версію тут:
Назва AOP
Автори
° F3 Відділ хімічної безпеки та альтернативних методів, що включає EURL ECVAM
Директорат F - Охорона здоров'я, споживачі та довідкові матеріали
Спільний дослідницький центр, Європейська комісія
- L’Oreal Research & Innovation, Франція
Статус
Будь ласка, перейдіть за посиланням на сторінку знімків, щоб переглянути та створити знімки цього AOP.
У стадії розробки: Не поширюйте та не цитуйте.
Цю сторінку AOP востаннє було змінено 12/11/2016.
Клацніть тут, щоб показати/приховати дати перегляду відповідних сторінок
Анотація
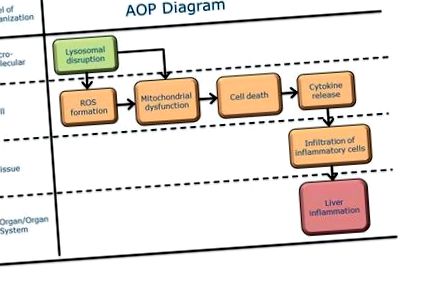
Відомо, що гепатотоксичність є важливою кінцевою точкою регуляторних проблем; особливо у розробці ліків, це була одна з найчастіших причин складання звітів про безпеку фармаконагляду та виведення ліків з ринку. Запалення печінки може бути як самою відповідною кінцевою точкою, так і виникати під час розвитку фіброзу печінки, наприклад, при повторному впливі. Сучасна AOP пов'язує порушення лізосом із запаленням печінки. Лізосомні пошкодження можуть бути спричинені декількома ініціаторами: приклади - миючий засіб O-метил-серину додециламіду гідрохлорид (MSDH), альфа-токоферил сукцинат, нафтазарин [1] [2], 3-амінопропанал [2], антималярійний засіб артесунат (ART) ) [3], а також наноматеріали (НМ) [4]. Лізосомний розрив НМ був описаний як одна з основних причин їх потенціалу викликати пошкодження клітин, що згодом пов'язано зі збільшенням активних форм кисню (АФК), пошкодженням мітохондрій та індукцією запального каскаду. Тому запалення печінки є місцевим результатом після транслокації НМ у печінку. Поглинання та руйнування лізосоми не є класичним МІЕ, оскільки не задіяні "молекулярні", а швидше механічні процеси. Однак це початкова подія для описаного AOP.
Фон (необов’язково)
Запалення печінки супроводжує більшість гострих та хронічних розладів печінки, оскільки може стимулювати розвиток фіброзних або циротичних реакцій, якщо воно залишається невирішеним (Brenner et al., 2013). Збільшується використання та можливі сфери застосування НМ, наприклад, у харчових продуктах, харчових продуктах чи косметиці. Отже, повинна бути забезпечена безпека НМ, які систематично потрапляють в організм. Через швидко зростаючу кількість нещодавно розроблених НМ неможливо буде в майбутньому перевірити їх токсичність у кожному конкретному випадку, як це часто роблять сьогодні. Деякі з основних факторів, що сприяють регулярному (нано) впливу частинок, - це погано розчинні частинки оксиду металу, такі як TiO2 або аморфний SiO2, які зазвичай використовуються в косметиці, фармацевтичних продуктах або продуктах харчування [5] [6] .
Відомо, що печінка є одним з основних органів-мішеней для проковтування НМ, але вдихаються частинки також можуть потрапляти в печінку після очищення від легенів [7] [8] [9]. Експерименти in vivo на ін’єкціях або ін’єкціях (внутрішньочеревно або внутрішньовенно) TiO2 свідчать про широкий спектр несприятливих наслідків для печінки: збільшення загальних маркерів сироватки для пошкодження печінки, таких як аланін-амінотрансфераза або аспартат-амінотрансфераза [10] [11], збільшення запальні маркери, такі як прозапальні цитокіни та/або інфільтрація запальних клітин [8] [12] [13], збільшення маркерів для окисного стресу [14] [15], апоптозу, некрозу, а також фіброзу [16] [17] ]. Також повідомляється про пошкодження печінки та запалення інших частинок оксиду металу, таких як SiO2 [18] [19], за допомогою різних шляхів застосування, таких як внутрішньочеревна ін'єкція або пероральне введення. Пероральне введення НМ, як видається, спричиняє загальні більш м’які побічні ефекти, ніж системне введення, швидше за все, через типово обмежене всмоктування НМ у шлунково-кишковому тракті. Таким чином, важливо мати на увазі, що шлях впливу, але також розмір НМ, відіграє важливу роль, чи досягають вони печінки, і якою мірою вони накопичені [20]. .
Недавні дослідження підтвердили важливість поглинання лізосомного НМ щодо механізму токсичності, викликаного НМ. Як тільки NM поглинається клітиною, його транспорт у кисле середовище лізосоми може підвищити розчинність NM, або матеріал залишається у вихідній нано формі. Обидві ситуації можуть спричинити токсичність, спричиняючи набряк лізосом, з подальшим пошкодженням лізосом та вивільненням проапоптотичних білків, що спричиняє запалення [21] [22] [23]. Відомо, що частинки з низькою розчинністю та токсичністю, такі як TiO2, можуть викликати запалення пропорційно своїй питомій площі поверхні [24] [25] та, як нещодавно описано, їх дзета-потенціалу [23], що описує електричний потенціал між поверхнею ЯМ (або пов'язаних з ним груп) та суспензійним середовищем. Порушення лізосоми може викликати каскад запалення в органі-мішені. Запальна реакція, спричинена частинками, пов’язана з пошкодженням тканин, ремоделюванням та мутагенезом і називається вторинною токсичністю частинок після вичерпання можливостей відновлення пошкоджень антиоксидантів та ДНК [26] [27] [28] .
Але не тільки NM викликають пошкодження лізосом: хімічні речовини та білки, такі як певні ксенобіотики, LLOMe (L-Leucyl-L-лейцин-метиловий ефір) або глутамат - відомі індуктори розриву лізосом, а реактивні види кисню (АФК), такі як H2O2, можуть посилити цей ефект. [29]. Кількість лізосомних ферментів, що виділяються в цитозоль, регулює шлях загибелі клітин, який ініціюється пошкодженням лізосом: він відіграє важливу роль в індукції апоптозу, тоді як масивний розрив лізосом призводить до некрозу [30]. Відомо, що лізосоми викликають опосередкований мітохондріями апоптоз шляхом вивільнення катепсинів у цитозоль [29]. Однак у той же час самі лізосоми є джерелом АФК, що може призвести до пошкодження мембрани мітохондрій [21] [31]. Чжу та його колеги виявили, що TiO2 індукував загибель клітин незалежно від Bak/Bax, проте діючи через лізосоми [32], підтверджуючи важливість врахування шляху, що включає АФК, в той час як мітохондрії виявились необхідними для клітин смерть, започаткована дезобілізацією лізосом [33] .
Загалом, зв’язок між пошкодженням лізосом та мітохондрій із запаленням, а точніше із запаленням печінки, добре відомий, незалежно від того, чи викликаний хімікатами, білками або НМ (оглянуто в [34] [35]), і він безпосередньо пов’язаний з багатьма іншими несприятливими такі наслідки, як фіброз. Тому через його високу важливість він широко описаний у поточному АОП.
Короткий зміст AOP
Будь ласка, перейдіть за посиланням на сторінку віджета, щоб редагувати цей розділ.
Якщо ви вручну введете текст у цей розділ, він буде автоматично змінений або видалений у наступних редагуваннях за допомогою віджетів.
Молекулярна ініціативна подія
| Лізосома, порушення | Сильна |
Ключові події
Несприятливий результат
Зв'язок між ключовими подіями та несприятливим результатом
| Окислювальний стрес, посилення | Безпосередньо веде до | Мітохондріальна дисфункція, не застосовується | Сильна | Слабкий |
| Мітохондріальна дисфункція, не застосовується | Безпосередньо веде до | Травма/смерть клітини, не застосовується | Сильна | Слабкий |
| Травма/смерть клітини, не застосовується | Безпосередньо веде до | Цитокін, вивільнення | Сильна | Слабкий |
| Лізосома, порушення | Безпосередньо веде до | Окислювальний стрес, посилення | Помірний | Слабкий |
| Лізосома, порушення | Безпосередньо веде до | Мітохондріальна дисфункція, не застосовується | Сильна | Слабкий |
| Цитокін, вивільнення | Безпосередньо веде до | Запальні клітини, інфільтрація | Сильна | Помірний |
| Запальні клітини, інфільтрація | Безпосередньо веде до | Печінка, запалення | Сильна |
Перегляд мережі
Клацніть на вузлах або краях.
Застосовність життєвого етапу
Таксономічна застосовність
| людини | Homo sapiens | Сильна | NCBI |
| миша | Mus musculus | Сильна | NCBI |
| щур | Rattus norvegicus | Слабкий | NCBI |
Секс застосовність
Графічне представлення
Загальна оцінка AOP
Домен застосовності
Описаний АОП є загальним механізмом, який, крім того, можна вважати таким, що не обмежується лише печінкою як органом-мішенню. Пошкодження лізосом може відбуватися майже у всіх типах клітин та у всіх органах. Це показано кількома механістичними дослідженнями, в яких використовували імунні або клітини мозку [36] [21] [37] [38], таким чином підкреслюючи широку придатність МІЕ/раннього КЕ. Отже, на сьогоднішні знання цей АОП не обмежується конкретним життєвим етапом.
Більшість робіт, що виконувались для опрацювання частин цього АОП, виконувались з використанням мишачих або людських клітин і клітинних ліній, зразків крові чи тканин людини або моделей мишей, де можна було виконати певний нокдаун. Приклади включають
Лише деякі дослідження аналізували конкретні аспекти AOP у моделях щурів, наприклад [42] [43]
Як описано вище, АОП є широко застосовуваним, тому на даний момент не відомо жодної конкретної застосовності до статі.
Основність ключових подій
Підсумок події, що ініціює молекулярну діяльність, Підсумок ключових подій
Надайте загальну оцінку сутності ключових подій в АОП. Виклики підтримки для окремих ключових подій можуть бути включені в таблиці молекулярних ініціатив, ключових подій та несприятливих наслідків вище.
Залежно від розглянутого пускового механізму, лізосомальне порушення може бути або МІЕ, або вже раннім КЕ. У цьому AOP це було визначено як відповідне (M) IE, оскільки поглинання лізосом НМ може призвести до простого зберігання матеріалу або пошкодження лізосомальної мембрани, що є MIE описаного AOP. Це залежить від властивостей ЯМ, як було описано вище. Коротко кажучи, кисле середовище в лізосомі може ще більше підвищити розчинність (розчинної) NM, або вона залишається у вихідній нано формі. Обидві ситуації можуть викликати токсичність, спричиняючи лізосомне набрякання з подальшим порушенням лізосом та вивільненням проапоптотичних білків [21] [23]. Частинки з низькою розчинністю та токсичністю, такі як TiO2, можуть викликати запалення пропорційно своїй питомій площі поверхні [44] [45] та їх дзета-потенціалу [23] .
Отже, загибель клітин описується як подальший КЕ до дисфункції мітохондрій, що може призвести до індукції апоптотичного шляху. Апоптоз - це складний процес, який регулює, чи призводить загибель клітин до розвитку запалення або тихого видалення пошкодженої клітини, наприклад під час розвитку або нормального обміну тканин. Це, швидше за все, залежить від тяжкості ефекту [48]. Вмираючі гепатоцити можуть вивільняти внутрішньоклітинні молекули, відомі як молекулярні структури, пов’язані з пошкодженням (DAMP), які, якщо вони стійкі, можуть викликати так зване стерильне запалення. Це відбувається за відсутності патогенів і є ключовим фактором для розвитку запалення (печінки) [49] [50]. Мітохондріальна ДНК (mtDNA) та формільні пептиди, що походять від мітохондрій, є прикладами DAMP, що походять від мітохондрій, які зв’язуються з рецепторами розпізнавання образів (PPR), такими як митохондріальні рецептори (TLR). TLR виявляються експресованими в більшості клітин печінки, включаючи гепатоцити, клітини Купфера (KC) або зоряні клітини печінки (HPC) [49] .
Активація апоптозу призводить до індукції різноманітних цитокінів, таких як запальний білок макрофагів-2 (MIP-2)/IL-8, KC, IL-6, MCP-1/CCL2 та sICAM-1, що описується як наступний KE. Коли апоптоз блокувався інгібуванням каспази-3, індукція хемокінів була значно зменшена. [51] [52] .
Збільшення вивільнення цитокінів неминуче пов'язане з подальшою інфільтрацією запальних клітин, КЕ № 5. Зокрема, нейтрофіли (ПМН) набираються у напрямку до хемотаксичного градієнта. Це навіть можна кількісно визначити за допомогою аналізів хемотаксису, які дозволяють визначати відповідні концентрації хемокінів з метою ініціювання міграції нейтрофілів [53]. Нейтрофільний цитозоль містить гранули, наповнені різноманітними білками, такими як дефензини, білок, що підвищує бактерицидну проникність, протеази (наприклад, еластаза, катепсини) та мієлопероксидаза (MPO), яка споживає пероксид водню (H2O2) і утворює хлоридну кислоту ( HOCl), найбільш бактерицидний окислювач, який виробляється PMN [54] [55]. Активація ПМН призводить до продукування різноманітних прозапальних цитокінів, наприклад IL-1ß, IL-6, IL-12 та IL-23, які можуть ще більше посилити виникле запалення [56] .
Результат інфільтрації нейтрофілів та інших імунних клітин призводить до розвитку та встановлення запалення. Можна показати, що виснаження нейтрофілів за допомогою нейтрофільних антитіл NIMP-R14 безпосередньо призводило до різкого зменшення наслідку запалення печінки [57]. Загальним підтвердженням важливості інфільтрованих нейтрофілів є той факт, що запалення печінки зазвичай клінічно підтверджується аналізом гістологічних особливостей, позначених припливом нейтрофілів (які можна забарвити за допомогою гематоксиліну та еозину) [58] .
Підсумок ваги доказів
Зведена таблиця
Надайте загальний підсумок вагомості доказів на основі оцінок окремих зв’язків на сторінках взаємозв’язку ключових подій.
Кількісні міркування
Зведена таблиця
Надайте загальне обговорення кількісної інформації, доступної для цього AOP. Виклики підтримки для окремих відносин можуть бути включені у таблицю Відносин ключових подій вище.
Загалом, кількісне розуміння окремих КЕР є низьким. Багато що ґрунтується на відомих знаннях, особливо пізніх КЕР, які описують посилення цитокінів та інфільтрацію імунних клітин під час запалення. Здебільшого ці знання підтверджуються експериментами з використанням інгібіторів, специфічних активаторів або нейтралізуючих речовин (таких як антитіла).
КЕР від MIE до KE1 (Окислювальний стрес) ґрунтується на результатах, коли лізосомальна реакція була загальмована або знижена; подальша індукція АФК може бути зменшена, а подальші результати (наприклад, вплив на мітохондрію) затримані. Було описано тимчасове узгодження (LMP супроводжувалося виробництвом ROS, за яким відбувалися зміни MMP); проте кількісне розуміння все ще низьке.
Це добре встановлено Окислювальний стрес веде до Мітохондріальна дисфункція, хоча і для цього КЕР кількісне розуміння низьке. Інгібування джерела АФК може затримати пошкодження мітохондрій, а лікування антиоксидантом може частково пригнітити вплив на мітохондрію. Прямий вплив окисного стресу на розкриття перехідної пори мітохондріальної проникності виявлено вже в 1997 році, що, як було описано, призводить до збільшення потенціалу мембрани мітохондрій.
КЕР від MIE до Мітохондріальна дисфункція базується на результатах експериментів з дозволеним часом та використанні специфічних інгібіторів, які підтвердили цей КЕР. Визначна роль катепсинів, які виділяються із скомпрометованої лізосоми, неодноразово була підкріплена. Також тут кількісне розуміння все ще низьке.
Мітохондріальна дисфункція веде до Клітинна загибель наприклад, індукцією апоптозу. Стабілізація MMP до застосування апоптотичного тригера може запобігти появі апоптозу. ММП індукується в нижчих концентраціях до загибелі клітин. Однак кількісне розуміння низьке.
Дослідження ролі Клітинна загибель спонукання до Вивільнення цитокінів виявили, що похідні мітохондрій DAMP зв'язуються з рецепторами розпізнавання образів, такими як митоподібні рецептори, які безпосередньо підвищують регуляцію цитокінів, як і індукція апоптотичного шляху. Інгібування апоптозу запобігало підвищенню регуляції цитокінів.
КЕР від Вивільнення цитокінів до Інфільтрація запальних клітин можна описати кількісно, оскільки доступні корисні аналізи хемотаксису, які використовують ізольовані клітини імунітету ex vivo. Ці результати дають вказівку на концентрації, необхідні для міграції клітин, але їх слід ретельно продумати щодо прямої переносимості в ситуацію in vivo. Більше того, не тільки ІЛ-8 відповідає за рекрутинг нейтрофілів, але й інші хемокіни можуть сприяти залученню запальних клітин. Однак додатковим доказом цього КЕР є нейтралізація хемокінів, яка запобігла подальшому початку запалення.
Загальний доказ важливості Інфільтрація запальних клітин у розвитку Запалення печінки виявляється тим, що запалення печінки зазвичай клінічно підтверджується аналізом гістологічних особливостей, що відзначаються припливом нейтрофілів. Інгібування месенджерів інфільтрації запальних клітин призводить до їх сильного зменшення. Крім того, безпосереднє пригнічення нейтрофілів запобігає появі запалення печінки.
- 011 Джейсон Вробель - Висока сировина, веганське життя для високої енергії
- C; R Market - Fulton Health; Оздоровчі статті 5 Порад щодо підтримання здорової ваги
- Новачок; s Керівництво з харчування; MariEasyFitness
- 5 продуктів, що підвищують енергію та можуть замінити добавки перед тренуванням
- 5 продуктів, наповнених лікопіном