Антидіабетичний ефект екстрактів граната у довготривалих щурів, що харчуються високим вмістом фруктози
Анотація
Передумови
Дієти з високим вмістом цукру та/або жиру є основним фактором ризику ожиріння. Однак збільшення споживання фруктів та овочів останнім часом пов’язане з профілактикою ожиріння. Метою цього дослідження було дослідити профілактичну дію екстрактів листя граната (PL), соку (PJ) та шкірки (PP) на резистентність до інсуліну та окислювальний стрес у пацюків із ожирінням з високим вмістом жиру та високим вмістом фруктози.
Методи
Ожиріння у щурів було спричинене споживанням дієти з високим вмістом насичених жирів та фруктози (HFD) протягом тривалого періоду (12 тижнів).
Результати
Порівняно з контрольною групою (CG), яка годувала чау, група з високим вмістом жиру та високим вмістом фруктози (HFD) продемонструвала значне збільшення рівнів глюкози (29,8%), інсуліну (45%), амілази (70%) у плазмі натще. та ліпаза (54%). Більше того, годування HFD збільшує перекисне окислення ліпідів та карбонілювання білків та знижує рівень антиоксидантних ферментів. Однак лікування PL, PJ та PP помітно запобігає непереносимості глюкози, інсулінорезистентності та окислювальному стресу та знижує рівень амілази та ліпази.
Висновок
Ці висновки підкреслюють, що тривалий прийом екстрактів граната може бути потенційною альтернативною стратегією для профілактики індукованої HFD резистентності до інсуліну та окисного стресу.
Передумови
В даний час зростає популярність засобів лікування травами порівняно із звичайними препаратами, 40% сполук, що використовуються у фармацевтичній промисловості, отримують з лікарських рослин [13]. Більше того, Всесвітня організація охорони здоров’я (ВООЗ) оголосила, що 80% людей у країнах, що розвиваються, часто використовують лікарські рослини для своєї первинної медико-санітарної допомоги при різних захворюваннях. Встановлено, що широкий спектр лікарських рослин має оздоровчий ефект при лікуванні та профілактиці метаболічних синдромів, таких як діабет та ожиріння [14,15,16]. У цьому контексті набагато більше уваги було зосереджено особливо на споживанні фруктів та овочів, що, як правило, було пов'язано з меншою поширеністю метаболічного синдрому, як виноград [9], зелений чай [17] та олія авокадо [18].
Матеріали і методи
Рослинний матеріал
Збирали листя та плоди граната Тунсі дерева в регіоні Махдія, Туніс. Автентичність Тунсі сорт був ідентифікований доктором Фатеном Зауаєм, систематиком Вищого агрономічного інституту (Університет Суса, Туніс), а зразок ваучера був зданий у гербарій на фармацевтичному факультеті (Університет Монастіра, Туніс). Гранатовий сік та метанольні екстракти листя та шкірки граната готували, як описано в нашому попередньому дослідженні [22].
Екстракція ліпідів та аналіз метилових ефірів жирних кислот (FAMEs)
Протоколи екстракції ліпідів та аналіз FAME проводились згідно з протоколом, як описано раніше нашою командою [23].
Експериментальний дизайн
Самець Вістар щурів (200–250 г) отримували з центральної аптеки Тунісу. Щодо умов акліматизації та вимог до утримання щурів, стандартної дієти та композицій HFD, покажіть дані у нашому попередньому дослідженні [22]. Було розділено п'ять груп (по 6 тварин у кожній групі). Одну групу годували лише стандартною дієтою (контрольна група КГ). Одну групу годували лише HFD (контрольна група з ожирінням HFD). Три групи, що залишилися, годували HFD і отримували щодня за один сорт один із трьох екстрактів граната в дозі 250 мг/кг BW, гранатовий сік (Група HFD + PJ) гранатова шкірка (група HFD + PP) і листя граната (група HFD + PL ). Протягом усього дослідження вага тіла та споживання їжі контролювались відповідно двічі на тиждень та щодня. В кінці експерименту і після нічного голодування щурів забивали декапітацією, а кров відбирали для біохімічного аналізу.
Тест на толерантність до інсуліну (ITT) та пероральний тест на толерантність до глюкози (OGTT)
ITT та OGTT проводились відповідно на 10-му та 11-му тижнях лікування екстрактами граната. Для ІТТ щури, що голодували протягом ночі, отримували 0,75 МО/кг розчину інсуліну шляхом внутрішньочеревної ін’єкції, а глюкозу крові вимірювали через 0, 30, 60 та 90 хв після ін’єкції.
Для OGTT 2,5 г/10 мл/кг глюкози, розчиненої у воді, завантажували на ніч натще щурів перорально, а зразки крові відбирали розрізом з хвоста для вимірювання глюкози за 0 хв до і 30, 60, 90 і через 120 хв після навантаження глюкозою. Глюкозу визначали негайно за допомогою портативного глюкометра.
Біохімічний аналіз
Рівні глюкози в плазмі крові вимірювали за допомогою набору глюкозооксидази-PAP (Biomaghreb, Туніс, Туніс). Рівні інсуліну в плазмі крові вимірювали за допомогою набору ELISA для мишачого інсуліну RayBio (RayBiotech. Каталожний номер: ELM-інсулін). Активність α-амілази оцінювали за кінетичним методом, використовуючи комерційний набір (BIOLABO, посилання 80,023, Maizy, Франція). Активність ліпази також оцінювали за кінетичним методом з використанням комерційного набору (BIOLABO ref. 99, 891, Maizy, Франція).
Печінкові маркери окисного стресу
Малоендіальдегід печінки (MDA) як маркер перекисного окислення ліпідів вимірювали згідно з посиланням [24]. Карбонілювання білка (ПК) як маркер окисного пошкодження білка було визначено кількісно згідно з посиланням [25]. Активність супероксиддисмутази (СОД) проводили за методом, наведеним у посиланні [26]. Активність глутатіонпероксидази (GPx) оцінювали, як описано в посиланні [27].
Статистичний аналіз
Статистичний аналіз проводили за допомогою SPSS версії 21. Для аналізу даних використовували тест Данкана, критерієм статистичної значущості був стор
Результати
Склад жирнокислого
Вплив на гомеостаз глюкози та чутливість до інсуліну
У порівнянні з груповою дієтою, що годувалась, рівні глюкози та інсуліну в плазмі крові збільшувались відповідно на 30% та 44% у групі із СНВ після 12 тижнів дієтичного харчування з високим вмістом жиру та високим вмістом фруктози (табл.2). Обробка листям і шкіркою гранатового соку призвела до значного зниження рівня глюкози та інсуліну в плазмі натще. Отже, гомеостатичний індекс резистентності до інсуліну (HOMA-IR), який використовується для кількісної оцінки резистентності до інсуліну [33, 34], відповідно зменшився наполовину для екстрактів соку та листя та на 39,1% для екстракту шкірки, що свідчить про значне поліпшення чутливості до інсуліну трьома екстрактами граната.
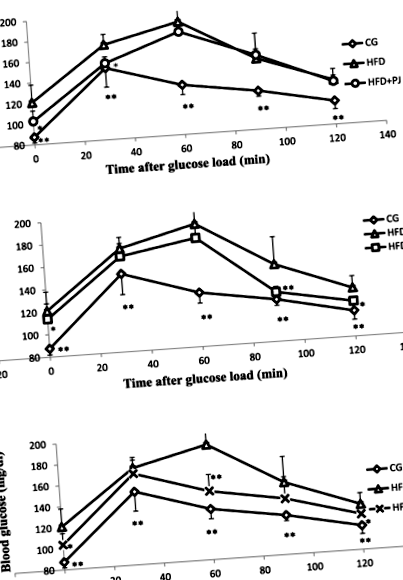
Для подальшої оцінки впливу екстрактів граната на метаболізм глюкози та чутливість до інсуліну ми провели пероральні тести на толерантність до глюкози та інсуліну. Обидва тести призвели до поступових змін рівня глюкози в плазмі тварин.
Після того як тварини отримували розчин глюкози, приріст глюкози в плазмі досягав максимуму через 60 хв. Результати, проілюстровані на фіг.1; показують, що годування HFD порушує толерантність до глюкози у щурів. Насправді група HFD мала вищий рівень глюкози в крові, ніж контрольна група, через 30, 60, 90 та 120 хв після перорального введення глюкози (рис. 1). Щури HFD, оброблені листям граната, мали значно нижчий рівень глюкози в плазмі, ніж група HFD, через 60 хвилин після перорального навантаження глюкозоюстор Рис. 1
Під час тесту на толерантність до інсуліну результати показують, що годування HFD погіршує чутливість до інсуліну у щурів (рис. 2). Насправді, концентрація глюкози в плазмі крові значно знижувалася через 30 та 60 хв для всіх груп, що годували HFD, а потім дещо відновлювалася через 90 хв (стор Рис.2
Вплив на рівні амілази та ліпази в плазмі крові
Вплив обробки екстрактами граната на активність α-амілази та ліпази повідомляється відповідно на рис. 3а та b. Годування з високим вмістом жиру та фруктози викликало значне збільшення активності α-амілази в сироватці на 70% порівняно з контрольними щурами (стор Рис.3
Порівняно з контрольною групою, яку годували чау-дієтою, годування HFD викликало потужне збільшення (стор Таблиця 3 Вплив застосування HFD та екстрактів граната на печінкові окислювальні маркери
Обговорення
Фруктоза, дієтичний моносахарид, відома як фактор, що сприяє майже всім класичним проявам метаболічного синдрому, включаючи інсулінорезистентність, гіперінсулінемію, гіпертонію та дисліпідемію [35]. Для цього декілька попередніх досліджень використовували дієтичні добавки з високим вмістом фруктози як чудову тваринну модель для вивчення метаболічного синдрому, запалення та інсулінорезистентності, спричиненого ожирінням, а також для вивчення модулюючого впливу дієтичних компонентів на прогресування цих захворювань [ 36,37,38]. У рамках цього ми використовували цю модель для дослідження потенційних корисних ефектів тривалого лікування з екстрактами листя граната, соку та шкірки. Наші результати показують, що споживання HFD протягом 12 тижнів помітно індукує збільшення маси тіла (Показати наші раніше опубліковані результати), глікемію, пов’язану з інсулінемією, і, отже, резистентність до інсуліну. Ці висновки узгоджуються з попередніми дослідженнями [36].
Зниження маси тіла, показане у щурів із ВЧД, можна пояснити споживанням енергійної їжі, багатої насиченими жирами (салом) та вуглеводами (фруктозою), яка стимулює апетит, підвищуючи рівень греліну [39] та блокуючи насичення, знижуючи рівень лептину [40]. Під час ОГТТ та ІТТ додаткові концентрації глюкози та інсуліну в плазмі крові суттєво збільшувались у групах із ВЧД, що вказує на те, що годування ВЧД помітно погіршує споживання стимульованого інсуліном глюкози в периферичних тканинах. Механізм дії фруктозо-жирового живлення на резистентність до інсуліну залишається незрозумілим, проте були проаналізовані деякі пояснення, включаючи зміну сигналу про інсулін [17], ферментативну активність метаболізму вуглеводів [12] та надмірне утворення активних форм кисню (АФК). У цьому дослідженні ми можемо пояснити індуковану фруктозою гіперглікемію підвищенням АФК та зменшенням антиоксидантної системи захисту в різних тканинах, таких як печінка. Фактично, наші висновки показують, що надмірне споживання фруктози спричинює перекисне окислення ліпідів та білків, а отже, і пригнічення печінкового антиоксидантного ферменту, такого як SOD та GPx. Інші попередні дослідження повідомляли про подібні результати тієї ж моделі щурів [41, 42].
Результати показують, що добавки листя граната, шкірки або соку запобігають збільшенню маси тіла (Показати наші раніше опубліковані результати [22]), гіперглікемії та гіперінсулінемії. Крім того, вони надзвичайно пом'якшують порушення утилізації стимульованого інсуліном глюкози у щурів, стійких до інсуліну [9]. Крім того, екстракти граната захищають печінкові антиоксидантні ферменти та зменшують перекисне окислення ліпідів та білків. Профілактичний ефект екстрактів граната може бути пов’язаний з антиоксидантними властивостями їх активних компонентів, таких як поліфеноли, флавоноїди та антоціани [21, 43].
Пригнічення активності амілази екстрактами граната (про що також повідомляли інші автори [44, 45]) призвело до зменшення всмоктування вуглеводів у кишечнику шляхом придушення їхнього гальмування [46]. Це зменшення всмоктування вуглеводів у кишечнику може пояснити знижуючий ефект екстрактів граната в плазмі глюкози натще. Більше того, зменшення всмоктування вуглеводів у кишечнику сприяє зменшенню споживання енергії, що призводить до втрати ваги, що спостерігається у щурів HFD, оброблених екстрактами граната (Показати наші раніше опубліковані результати [22]).
Поліпшення чутливості до інсуліну, яке спостерігається у тварин, оброблених гранатом, може бути пов’язане з протизапальними властивостями фруктових екстрактів, описаними Harzallah et al. [7]. Дійсно, зменшення прозапальних цитокінів, таких як TNF-α або IL-6, може мати сприятливий ефект, покращуючи засвоєння глюкози в тканинах-мішенях, таких як скелетні м'язи та/або жирова тканина.
Більше того, відновлення профілю ліпідів у плазмі крові (Показати наші раніше опубліковані результати [22]) за допомогою добавок екстрактів граната може бути пов’язано із зменшенням всмоктування жиру та холестерину в результаті пригнічення ліпази, ключового ферменту в ліпідному обміні. Екстракти граната можуть містити активні сполуки, які розглядаються як інгібітори панкреатичної ліпази [47]. Наші висновки відповідають попередньому звіту. Фактично, скринінг інгібування пригнічення ліпази підшлункової залози екстрактами фруктів, овочів, бобових та злакових культур, що містять високий рівень антоціаніну, показав, що гранатовий сік мав найвищий рівень антоціаніну та був найкращим інгібітором панкреатичної ліпази [48].
Висновок
Наше дослідження вказує на те, що тривале лікування щурів з високим вмістом жиру та фруктози з екстрактами листя граната, шкірки або соків, покращує толерантність до глюкози, запобігає резистентності до інсуліну та зменшує всмоктування вуглеводів та ліпідів шляхом зменшення активності α-амілази та ліпази.
- Вплив проти ожиріння двох лактобактерій та двох біфідобактерій на мишей ICR, що харчуються дієтою з високим вмістом жиру -
- Протигрибковий ефект різних рослинних екстрактів та їх основних компонентів у вибраних видах алое
- Поліпшуючий ефект екстрактів кропу та кмину на якість сперми та сперматогенні клітини
- На здоров’я! Червоне вино може компенсувати вплив дієти з високим вмістом жиру
- Антидіабетична дія природних антиоксидантів із фруктів, Тенденції в харчовій науці; Технологія - X-MOL