Активність Елафіну проти ВІЛ-1 залежить від його ядерної локалізації та зміненої вродженої імунної активації в епітеліальних клітинах жіночих статевих органів
Анна Григорівна Дранник
1 Кафедра патології та молекулярної медицини, Центр імунології Макмастера, Інститут досліджень інфекційних хвороб імені Майкла Г. ДеГрута, Університет Макмастера, Гамільтон, Онтаріо, Канада,
Какон Наг
1 Кафедра патології та молекулярної медицини, Центр імунології Макмастера, Інститут досліджень інфекційних хвороб імені Майкла Г. ДеГрута, Університет Макмастера, Гамільтон, Онтаріо, Канада,
Сяо-Дан Яо
1 Кафедра патології та молекулярної медицини, Іммунологічний науковий центр Макмастера, Інститут досліджень інфекційних хвороб імені Майкла Г. ДеГрута, Університет Макмастера, Гамільтон, Онтаріо, Канада,
Бетані М. Генрік
1 Кафедра патології та молекулярної медицини, Іммунологічний науковий центр Макмастера, Інститут досліджень інфекційних хвороб імені Майкла Г. ДеГрута, Університет Макмастера, Гамільтон, Онтаріо, Канада,
Т. Блейк Болл
2 Кафедра медичної мікробіології, Університет Манітоби та Агентство охорони здоров'я Канади, Вінніпег, Манітоба, Канада,
Френсіс А. Пламмер
2 Кафедра медичної мікробіології, Університет Манітоби та Агентство охорони здоров'я Канади, Вінніпег, Манітоба, Канада,
Чарльз Вачіхі
3 Кафедра медичної мікробіології Університету Найробі, Найробі, Кенія,
Джошуа Кімані
3 Кафедра медичної мікробіології Університету Найробі, Найробі, Кенія,
Кеннет Л. Розенталь
1 Кафедра патології та молекулярної медицини, Іммунологічний науковий центр Макмастера, Інститут досліджень інфекційних хвороб імені Майкла Г. ДеГрута, Університет Макмастера, Гамільтон, Онтаріо, Канада,
Задумав і спроектував експерименти: AGD KN KLR. Виконував експерименти: AGD. Проаналізовано дані: AGD KN X-DY. Внесені реагенти/матеріали/інструменти для аналізу: KN X-DY BMH TBB FP CW JK. Написав папір: AGD KN KLR.
Анотація
Вступ
Tr і E (Tr/E) є тривожними антипротеазами та регуляторами слизової оболонки імунітету з добре задокументованими антимікробними, імуномодулюючими та тканинними відновлювальними властивостями [23], [24]. Tr/E є членами сімейства сироваткових білків (WAP), які містять характерне та еволюційно збережене чотиридисульфідне ядро (FDC) або домен WAP, що бере участь у інгібуванні протеази [25], [26]. Tr (9,9 кДа) - це молекула-попередник, що секретується, яка має два домени. Tr у своєму N-кінцевому домені містить трансглутаміназний субстрат-зв’язуючий домен (TSBD), що дозволяє зв’язувати Tr з білками позаклітинного матриксу [27]. Протеолітичне розщеплення N-кінця Tr утворює елафін (Е) (5,9 кДа), що містить інгібуючий домен WAP [28] і один TSBD [29].
Як і їх структурний гомолог, секреторний інгібітор лейкоцитарної протеази (SLPI) [26], Tr/E володіє антимікробною активністю щодо бактерій, грибків та вірусів, включаючи ВІЛ-1 [11], [23], [30], [31] . Запропоновано декілька механізмів антимікробної активності Tr/E, включаючи їх безпосередню взаємодію з клітинною мембраною клітин через катіонну природу цих молекул [31], бактеріальну опсонізацію [32] та зв'язування з ДНК бактерій [33]. Також було показано, що Tr/E мають імуномодулюючі властивості [24]. Було показано, що Е інгібує LPS-ініційоване вивільнення MCP-1 у моноцитах [34], тоді як Tr/E зменшує секрецію IL-8 і TNFα у відповідь на людську еластазу, LPS та окислений LDL в ендотеліальних клітинах та макрофагах TNF [35]., [36]. Ця імуномодуляція пояснюється зв'язуванням з LPS [35] або пригніченням активації шляхів NF-κB та AP-1 [34],. Ці висновки демонструють плейотропну природу Tr/E та їхній внесок у захист господаря на диференціальних рівнях: націлювання як на патогени, так і на імуно-запальні реакції господаря.
Tr/E також пов'язані із запальними розладами легенів [37], [38], кишечника [39] та шкіри [25]. Tr/E конститутивно експресуються у слизовій секреції [9], [11] і можуть бути індуковані у відповідь на IL-1β, TNFα та polyI: C [3], [11], [40]. Tr/E виробляються різними типами клітин, включаючи ГК статевих органів [3], [11], [40], і їх було виявлено в рідині цервікально-піхвового промивання (CVL) [22], [30]. Вважається, що Tr/E разом із SLPI та безліччю інших ефекторних молекул, а саме дефензинами, серпінами, цистатинами, лізоцимом та лактоферином, відіграють значну роль у захисті FGT від ІПСШ, включаючи ВІЛ-1 [9], [11] ], [12], [30], [41], [42].
Матеріали і методи
Реактиви та клітинні лінії
Поліінозинову/поліцитидилову кислоту (polyI: C) (Sigma-Aldrich, Oakville, ON, Канада) відновлювали в PBS при зазначеній концентрації. Карцинома ендометрія людини (HEC-1A, ATCC # HTB-112 ™, депонована доктором Х. Курамото) і TZM-bl (JC53-BL) (ATCC # PTA-5659, номер патенту США 6 797 462, внесений доктором Джоном Каппесом і Xiaoyun Wu) клітини були отримані з American Type Culture Collection (ATCC) (Rockville, MD, USA) та підтримувались у середовищі McAy's 5A Medium Modified (Invitrogen Life Technologies, Берлінгтон, Онтаріо, Канада) та DMEM, відповідно, доповнених 10% плодом бичача сироватка, 1% HEPES (Invitrogen Life Technologies), 1% l-глутаміну (Invitrogen Life Technologies) та 1% пеніцилін-стрептоміцину (Sigma-Aldrich, Oakville, Онтаріо, Канада) при 37 ° C при 5% CO2.
Аналіз інгібування протеази
Інгібуючу еластазу активність вимірювали, як описано раніше [30], [43]. Коротко кажучи, білок Tr/E (кінцевий об'єм 10 мкл/лунка), або лише розчинник, поєднували в 96-лунковому планшеті з 50 нг в 10 мкл/лунку очищеної нейтрофільної еластази людини (HNE) (Sigma-Aldrich) або розчинника окремо (негативний контроль) та інкубують протягом 30 хв при 37 ° С. Згодом 50 мкл субстрату HNE, N-метоксисукциніл-Ала-Ала-Про-Вал п-нітроанілід (Sigma-Aldrich), розведений до 50 мкг/мл в буфері (50 мМ Трис, 0,1% Тритон, 0,5 М хлорид натрію, рН 8). Гідроліз вимірювали, контролюючи поглинання при 405 нм протягом 15 хв, використовуючи зчитувач ELISA Tecan Safire (MTX Labs Systems).
Учасники дослідження
Учасники дослідження були більш детально описані в іншому місці [30]. Коротко кажучи, жінки, які перебувають у когорті ЖКС Пумвані з Найробі, Кенія, були зараховані під час планових дворічних опитувань у дві дослідницькі групи: ВІЛ-Р, ВІЛ-С. Це постійна відкрита когорта з учасниками, записаними між 1989 і 2009 роками. У цій когорті жінки, які залишались ВІЛ-негативними протягом 7 років спостереження, як оцінювали як серологія, так і RT-PCR, і які були клінічно здоровими та вільними супутніх інфекцій, що передаються статевим шляхом (ІПСШ), а також залишалися активними у секс-роботі вважалися відносно ВІЛ-резистентними ВІЛ-R [44] _. Учасники, які були ВІЛ-неінфікованими ЖКС, але за якими спостерігали менше 7 років, були визначені як ВІЛ-S. Усі учасники когорти мали подібний соціально-економічний та генетичний фон. Жодні ЖКС, які брали участь у цьому дослідженні, не мали спільних ІПСШ. Протоколи дослідження були схвалені комісіями з розгляду етики в університетах Найробі, Манітоби та Макмастера. Усі учасники надали підписану, інформовану згоду.
Виділення зразків слизової
Зразки ЕК шийки матки збирали за допомогою скребка та ендоцервікальної цитощітки згідно стандартного протоколу. Клітини ЕС очищали від зішкрібних матеріалів за допомогою стандартного гравітаційного протоколу Фіколя, які розчиняли в 0,8 мл TRIzol і зберігали при -70 ° C. ЕК шийки матки були доступні для кожної з груп наступним чином: (ВІЛ-S, N = 10 та ВІЛ-R, N = 10).
Білки Trappin-2 (Tr) та елафін (E) для експериментів in vitro
Підготовка до ВІЛ-1 та відповідні аналізи
Лабораторно адаптований штам ВІЛ-1IIIB (X4-тропік) готували в РВМС, а вірус ВІЛ-1АДА (R5-тропік) готували у приєднаних макрофагах, очищених від РВМС людини, як це було описано в інших роботах [45]. Дозу 10 нг р24 використовували для експериментів з транцитозу та імунофлуоресценції. Середню дозу інфекційної культури тканин (TCID50) для кожного кінцевого запасу визначали методом Ріда-Муенча в клітинах TZM-bl (5,00 × 10 3/мл для X4-HIV-1IIIB та 2,77 × 10 4/мл для R5-HIV -1ADA запас); 100 TCID50 з кожного запасу ВІЛ-1 були використані в аналізах прихильності до ВІЛ-1, які представляли 860 пг для X4-ВІЛ-1IIIB та 504 пг для запасу R5-ВІЛ-1ADA.
Приєднання/потрапляння ВІЛ-1 та трансцитоз у клітинах HEC-1A
Аналізи приєднання/вступу та транцитозу ВІЛ-1 проводили, як описано раніше у посиланнях [30], [46], [47], з невеликими змінами. Для аналізу прикріплення/введення 100 TCID50 клітин R5-HIV-1ADA, X4-HIV-1IIIB або HEC-1A, вирощені в 96-лунковому планшеті до повного злиття, інкубували окремо з середовищем або тестували білки Tr/E при 1 мкг/мл протягом 1 год при 37 ° C, щоб побачити окремий ефект проти ВІЛ-1, опосередкований вірусом і клітинами. Після інкубації клітини неодноразово промивали PBS. Згодом клітини, не попередньо оброблені білками, отримували або середовище (-), необроблений ВІЛ-1 (V), або ВІЛ-1, попередньо інкубований Tr або E (V + p) ще 1,5 години при 37 ° С. Клітини, спочатку оброблені білками (с + р), отримували лише необроблений ВІЛ-1. Після 1,5 год інкубації вірусний посівний матеріал видаляли, клітини неодноразово промивали (4 ×) та лізували (1% Triton X-100 протягом 45 хв при 37 ° C). Клітинні лізати збирали і центрифугували при 11000 × g протягом 5 хв. Кількість асоційованого з клітинами лізату р24 визначали методом ІФА і виражали як пг/мл.
Потім клітини тричі промивали PBS і інкубували протягом 50–60 хв при 37 ° C в 300 мкл розчину 4 мМ ферроціаніду калію, 4 мМ фериціаніду калію, 2 мМ MgCl2 і 0,4 мг X-Gal на мл . Реакцію зупиняли видаленням фарбувального розчину та промиванням клітин двічі PBS, і сині клітини підраховували під мікроскопом. Дані виражаються у відсотках відновлених інфекційних частинок у присутності Tr або E порівняно з відсотком відновлення вірусу лише у вірусному контролі, прийнятим за 100%. Концентрації Tr та E, використані в цих експериментах, базувались на дозозалежній анти-ВІЛ-1 активності білків, про яку повідомлялося раніше [30].
Аналіз життєздатності МТТ
МТТ-аналіз (Biotium Inc., Hayward, CA, USA) був використаний відповідно до інструкцій виробника для визначення життєздатності клітин HEC-1A та був описаний в іншому місці [5], [30] _.
Аналізи ІФА
CVL та безклітинні супернатанти клітин HEC-1A зберігали при -70 ° C до аналізу на Tr/E, IL-8 та TNF-α людини за допомогою набору ELISA Duoset (R&D Systems) згідно з протоколом постачальника. Обмежена межа для Tr/E та IL-8 становила 31,25 пг/мл; TNF-α 15,6 пг/мл. p24 був виявлений методом ІФА для виявлення ВІЛ-p24 згідно з протоколом постачальника (Аналіз захоплення антигену ВІЛ-1 p24, Advanced BioScience Laboratories, Inc., Кенсінгтон, штат Меріленд, США) з обмеженою межею 3,1 пг/мл. Кількісну оцінку аналітів проводили на основі стандартних кривих, отриманих за допомогою зчитувача ELISA Tecan Safire ELISA (MTX Labs Systems Inc.).
Імунофлуоресцентне фарбування
Імунофлуоресцентне фарбування проводили, як описано в інших роботах [3], [5] _, але з незначними модифікаціями. Клітини HEC-1A, вирощені на 8-лункових предметних стеклах культури BD Falcon (BD Biosciences), попередньо обробляли різними білковими препаратами Tr та E протягом 1 год або поліI: C (25 мкг/мл на лунку) або 10 нг ВІЛ- 1 р24 протягом 4 год. Після вищезазначених процедур клітини фіксували та блокували, як описано раніше. _NF-κB p65 sc-372 (SantaCruz Biotechnologies, Санта-Крус, Каліфорнія, США) (1 500) були використані для виявлення ядерної транслокації NF-κB p65. Негативний контроль фракції кролячого імуноглобуліну (DakoCytomation, Glostrup, Данія) використовували як контроль ізотипу. Для виявлення Tr/E використовували первинні антитіла TRAB2O (HM2062, Hycult Biotech, Уден, Нідерланди). Мітки HAT та 6 × His були виявлені за допомогою антитіл проти HAT (LS-> C51508, LifeSpan Biosciences, Inc., Сіетл, Вашингтон, США) та анти-His (# 2365, Cell Signaling, Denvers, MA, USA) антитіла, відповідно. Відповідні кон'юговані IgG IgG Alexa Fluor 488 (Molecular Probes, Eugene, OR, USA) використовували як вторинне антитіло. Ядра візуалізували фарбуванням йодидом пропідію. Зображення отримували за допомогою інвертованого конфокального мікроскопа, що сканує лазер (LSM 510, Zeiss, Оберкохен, Німеччина).
Екстракція РНК та кількісний аналіз ПЛР у реальному часі (RT-qPCR)
Статистичний аналіз
Дані були виражені як середнє значення ± стандартне відхилення (SD). Статистичний аналіз проводили або з неспареним t-критерієм Стьюдента, або з одностороннім дисперсійним аналізом (ANOVA), використовуючи Sigma Stat 2.0.
Результати
N-кінець елафіну є критичним для анти-ВІЛ-1, але не інгібуючої активності протеази
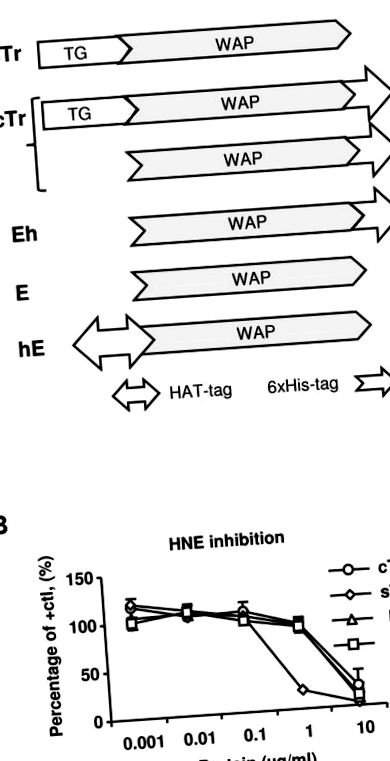
(А) Принципові схеми випробуваних білкових препаратів людського траппіну-2 (Tr) та елафіну (E) (Tr/E). sTr, Tr, що виділяється людиною (без мітки); TG, домен трансглутамінази; WAP, домен кислотного білка сироватки; cTr, комерційний рекомбінант людини 6 × His-траппін-2, суміш як Tr, так і E (із С-кінцевим His-міткою); Eh, людський рекомбінант E, очищений від cTr (з кінцевим C-міткою His-міткою); Е, комерційний рекомбінантний елафін людини (без мітки); hE, внутрішній рекомбінантний людський HAT-E (з N-кінцевою HAT-міткою). (B) Інгібуючу активність протеази різних білків Tr/E тестували, комбінуючи нейтрофільну еластазу людини (HNE) з різними концентраціями Tr або E та вимірюючи залишкову активність HNE, додаючи хромогенний еластазний субстрат N-метоксисукциніл-Ala-Ala Про-Вал-п-нітроанілід та моніторинг зміни поглинання при 405 нм протягом 15 хв. Результати виражаються щодо активності NHE позитивного контролю (HNE в одному розчиннику); cTr (○); sTr, (◊); E, (▵); hE, (□).
Імунофлуоресцентне фарбування клітинного розподілу 1 мкг/мл людських білків Tr або E (зелений), виявлене за допомогою TRAB2O (A, B, C), His-tag- (D, E, F) та специфічних до HAT-міток антитіл (G, H). Ядра візуалізували за допомогою йодиду пропідуму (PI) у вигляді червоного кольору. Репрезентативне фарбування трьох різних експериментів показано для білків Tr або E через 1 год після експозиції, а об’єднане зображення показує Tr або E людини, що візуалізується у вигляді жовтих у композитних панелях. Вага, 20 мм.
Елафін пригнічує секрецію IL-8 у відповідь на R5-HIV-1ADA у клітинах HEC-1A
Взаємодія ВІЛ-1 із генітальними ЕК викликає вивільнення прозапальних факторів, включаючи IL-8 та TNFα [48], [49]. Враховуючи, що попередні дослідження продемонстрували імуномодулюючі властивості Tr/E щодо бактеріальних [34] та вірусних лігандів [3], ми припустили, що E може впливати на індуковану ВІЛ-1 секрецію IL-8 та TNFα з клітин HEC-1A, причетних до ІПСШ/Поширення та патогенез ВІЛ-1 [49]. Клітини HEC-1A попередньо обробляли лише середовищем або 1 мкг/мл білків cTr, E або hE протягом 1 год при 37 ° С, а потім додатково стимулювали 10 нг ВІЛ-1 р24 протягом 8 год при 37 ° С, умови, що сприяють прикріпленню/вступу до ВІЛ-1 та трансцитозу. Вимірювання методом ІФА продемонстрували значно нижчий рівень IL-8 у базолатеральному відділі клітин HEC-1A після попередньої обробки E або cTr, але не hE (дані не показані), після R5-HIV-1ADA (рис. 4А), але не Експозиція X4-HIV-1IIIB (рис. 4B). Однак рівні TNFα були незначними і становили приблизно рівень виявлення в групах як для зразків, оброблених вірусом R5-, так і X4-HIV-1 (дані не наведені). Ці результати свідчать про те, що лікування Е змінює індуковану ВІЛ-1 запальну реакцію клітин HEC-1A.
Рівні білка IL-8 визначали в базолатеральному компартменті методом ІФА і показували як середнє значення ± SD у пг/мл. Статистичний аналіз проводили за допомогою ANOVA, при цьому значення p вказували на графіку і вважали значущими, коли p (рис. 5А). Примітно, що випробування polyI: C дало дещо більший видимий ефект, ніж виклик R5-HIV-1ADA, і було використано як позитивний контроль для експерименту. Крім того, X4-HIV-1IIIB не спричинив жодної значної транслокації NF-κB/p65 (дані не наведені). Цікаво, що на відміну від E або cTr, екзогенне лікування hE не змогло блокувати ядерну транслокацію NF-κB і створило зображення, подібні до клітин UT (дані не показані).
ЕК статевих органів від резистентних до ВІЛ (ВІЛ-R) комерційних секс-працівників (ЖКС) мають значно нижчий рівень вираженості деяких PRR
Беручи до уваги наші дані in vitro (рис. 5), ми дослідили, чи зменшили експресію вроджених вірусних сенсорів у ЖКС ВІЛ-R, які залишаються вільними від ВІЛ та мають більш високі Tr та E у своїх CVL [22], [30]. ЕК статевих органів. Кількісна RT-PCR цервікальної ЕК показала, що РКС ВІЛ-R справді мали значно знижені рівні мРНК TLR2, 3, 4 та RIG-I порівняно зі сприйнятливими (ВІЛ-S) РСС (рис. 6). У сукупності наші дані вказують на те, що резистентність до ВІЛ-1 може бути пов’язана зі збільшенням рівня опосередкованого Е-методом зниження експресії вроджених PRR слизових оболонок на ГК на порталі вірусного входу.
Відносні рівні експресії мРНК TLR2, TLR4 та RIG-I у цервікальних ЕК ВІЛ-S (▪, N = 10) та ВІЛ-R (•, N = 10) оцінювали за допомогою RT-qPCR. Відносна кількість експресії цих генів нормалізувалася щодо 18S. Дані відображаються як середнє значення ± SD. Статистичний аналіз проводили з використанням ANOVA, причому p вважали значущим, коли p Wira CR, Grant-Tschudy KS, Crane-Godreau MA (2005) Епітеліальні клітини в жіночих репродуктивних шляхах: центральна роль як сторожові імунного захисту. Am J Reprod Immunol 53: 65–76. [PubMed] [Google Scholar]
- 10 прихованих функцій програми Activity, які піднімуть вашу фізичну форму на новий рівень
- BMR Розрахунок коефіцієнтів фізичної активності шляхом множення BMR на PAR - Втрата ваги для всіх
- Ідея діяльності Виготовлення тарілок MyPlate
- ACE - Сертифікований грудень 2018 року - Вивчіть, скільки калорій ви спалюєте, залежить від часу доби
- Діяльність; Bellabeat