Наукові досягнення у харчуванні тварин: обіцянка нового століття: Матеріали симпозіуму (2001)
Розділ: 5 поживних речовин як регулятори експресії генів
5
Поживні речовини як регулятори експресії генів
Університет штату Мічиган
Макроелементи (вуглеводи, ліпіди та білки) відіграють фундаментальну роль у зростанні та розвитку ссавців, служачи джерелом енергії, а також компонентами для синтезу структурних та регулюючих компонентів клітин. Деякі макроелементи також впливають на функцію клітин через зміну циркулюючих гормонів (наприклад, регуляція глюкози вивільнення інсуліну з β-клітин підшлункової залози). Ми вже багато років знаємо, що деякі мікроелементи, такі як вітаміни А і D, мають значний вплив на експресію генів завдяки регуляції внутрішньоклітинних рецепторів, які зв'язують промотори певних генів.
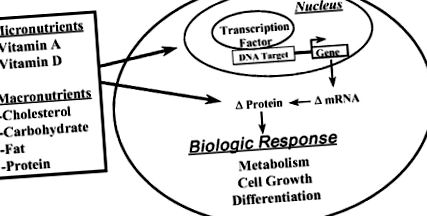
Поняття, що макроелементи або їх метаболіти можуть також впливати на експресію генів, - це нова концепція, яка з’явилася за останнє десятиліття. Зараз стало зрозуміло, що певні макроелементи (або їх метаболіти) впливають на експресію генів і призводять до змін у кількості ключових білків, які функціонують на критичних етапах метаболічних шляхів або контролюють поділ або диференціацію клітин (рис. 5-1). Тут я коротко описую, як три макроелементи (тобто холестерин, глюкоза та харчовий жир) впливають на експресію генів, змінюючи клітинний метаболізм.
РИСУНОК 5–1. Огляд поживних речовин як регуляторів експресії генів.
РЕГЛАМЕНТ ХОЛЕСТЕРОЛУ
SREBP синтезуються як
Білки-попередники 125 кд (pSREBP) прив'язані до ендоплазматичного ретикулуму та мембран Гольджі. Специфічні протеази перетравлюють попередник, утворюючи 65 кд форму SREBP (nSREBP), яка рухається до ядра, де він зв'язує SRE. Холестерин регулює вміст ядерних речовин
РИСУНОК 5–2. Регуляція холестерину метаболізму холестерину.
SREBP, контролюючи етап протеолізу. Холестерин контролює проходження SREBP з ендоплазматичного ретикулуму в гольджі. Коли рівень холестерину низький, відбувається протеоліз pSREBP, який генерує nSREBP і активуються специфічні SREBP-регульовані гени. З підвищенням рівня внутрішньоклітинного холестерину протеоліз SREBP знижується, що призводить до падіння nSREBP та пригнічення транскрипції генів. Таким чином, холестерин є регулятором зворотного зв’язку для власного синтезу шляхом контролю вмісту ядерних речовин SREBP.
РЕГУЛЮВАННЯ ГЛЮКОЗИ
Вплив глюкози на експресію гена традиційно приписують його регуляції вивільнення інсуліну з β-клітини підшлункової залози. Однак дослідження з первинними гепатоцитами та β-клітинами підшлункової залози показали, що глюкоза діє незалежно від інсуліну для контролю експресії генів. Коли концентрація глюкози в клітинах печінки збільшується, ферменти, такі як піруваткіназа та ацетил-КоА карбоксилаза, збільшуються. Це призводить до збільшення потоку метаболітів глюкози в синтез жирних кислот. У β-клітині підшлункової залози транскрипція піруваткінази та гена інсуліну індукується глюкозою. В обох випадках глюкоза стимулює транскрипцію специфічних генів, які збільшують клітинний вміст відповідної мРНК та білка. Ці гени, регульовані глюкозою, містять у своїх промоторах певні цис-регуляторні елементи, які називаються вуглеводами (або глюкозою)
елементи відповіді. На жаль, ідентичність факторів транскрипції, що зв’язують ці елементи, та механізм регуляції глюкози цих факторів невідомий. Тим не менше, загальний ефект цього регуляторного механізму полягає у сприянні засвоєнню глюкози з кровообігу, її внутрішньоклітинному метаболізму та асиміляції в ліпіди.
Регулювання жирної кислоти
Дієтичний жир і жирові кислоти, що утворюються в ньому, стали основними регуляторами експресії генів принаймні за допомогою трьох різних механізмів: 1) як попередники ейкозаноїдів, 2) як ліганди для ядерних рецепторів та 3) як контролери вмісту ядер SREBP1c.
Ейкозаноїди - це продукти окислення арахідонової кислоти, поліненасиченої жирної кислоти (ПНЖК). Ці продукти включають простагландини, лейкотреїни та тромбоксани та включають два ферментативні шляхи - циклооксигеназу (ЦОГ) та ліпоксигеназу. Арахідонова кислота вивільняється з фосфоліпідів клітинної мембрани під дією фосфоліпази А2 і перетворюється в ейкозаноїди за допомогою ЦОГ або ліпоксигеназ. Ці біоактивні ліпіди, як простагландин Е2 (PGE2), секретуються з клітин, де вони діють локально на пов'язані з плазматичною мембраною рецептори, пов'язані з G-білками (GPR) на клітинах-мішенях (рис. 5-3). Ці рецептори контролюють внутрішньоклітинні рівні другого месенджера, такі як цАМФ і вільний кальцій, які, в свою чергу, контролюють численні клітинні процеси завдяки змінам фосфорилювання білків. Отже, зв’язування ейкозаноїдів з GPR швидко стимулює фосфорилювання білків, що призводить до змін у метаболізмі, продукції цитокінів та продукуванні молекул адгезії. Деякі з цих ефектів включають зміни в експресії генів через контроль активності певних факторів транскрипції, таких як cFos, cJun, NFκB та cMyc.
Дефіцит основних жирних кислот пов'язаний із зменшенням вмісту фосфоліпідів у арахідоновій кислоті та виробленням ейкозаноїдів. Виробництво ейкозаноїдів пов'язане із запальними реакціями та захистом господаря. Цікаво, що деякі дієтичні жири, особливо високонасичені жирні кислоти n-3, є поганим субстратом для ЦОГ. Це призводить до зниження вироблення ейкозаноїдів, а також до зменшення запальної реакції.
Другий шлях впливу жирних кислот на експресію генів - це регуляція сімейства ядерних рецепторів, які називаються рецепторами, активованими проліфератором пероксисоми (PPAR). Визначено чотири підтипи PPAR (тобто α, β, γ1 та γ2). Це члени стероїдної надродини ядерних рецепторів, які зв'язують мотиви ДНК, що називається регуляторним елементом проліферації пероксисоми (PPRE). PPAR зв'язують PPRE у поєднанні з другим рецептором, який називається ретиноїдним X-рецептором (RXR). PPAR були вперше визначені як молекулярні мішені для проліфераторів пероксисом. Пероксисоми - це субклітинні органели, які беруть участь у β-окисленні жирних кислот та метаболізмі холестерину. Проліфератори пероксисом є
РИСУНОК 5-3. Ейкозаноїдна регуляція експресії генів.
структурно різноманітний клас гідрофобних сполук, які призводять до пероксисомної проліферації в печінці гризунів. Однак певні препарати мають у якості молекулярних мішеней специфічні PPAR. Наприклад, гіполіпемічні препарати можуть націлювати PPARα, тоді як PPARγ є молекулярною мішенню для сенсибілізуючих інсулін препаратів.
PPARs були пов'язані з регуляцією експресії генів, що беруть участь майже у всіх аспектах метаболізму жирних кислот (тобто поглинання жирних кислот, зв'язування жирних кислот, окислення жирних кислот та диференціація адипоцитів). Крім того, повідомляється, що ці рецептори беруть участь у запаленні, а також у рості та диференціації клітин. Цікаво, що жирні кислоти, їх метаболіти та деякі ліки зв'язуються та активують PPARα, подібно до того, як стероїд зв'язується зі стероїдним рецептором. Наприклад, у печінці гризунів гіполіпемічні препарати та сильно ненасичені жирні кислоти n-3 активують PPARα, що призводить до посиленого окислення пероксисомних та мікросомальних жирних кислот. У преадіпоцитах тіазолідиндіони та, можливо, ейкозаноїди зв'язуються з PPARγ2 та активують його. Це прискорює швидкість диференціації адипоцитів та підвищує чутливість до інсуліну жирового депо.
Хоча PPARs привертали значну увагу як молекулярні мішені для регуляції експресії генів жирних кислот, виявляється, що ці фактори не є єдиними мішенями для впливу жирних кислот на геном. Недавні дослідження показують, що один із SREBP, а саме SREBP1c, особливо чутливий до регуляції жирних кислот. Кілька звітів, що з'явилися за останні 2 роки, свідчать про те, що SREBP1c відіграє важливу роль як у печінковому, так і в адипоцитарному ліпогенезі, тобто в синтезі жирних кислот і тригліцеридів. Харчування тварин, доповнене поліненасиченими жирними кислотами, також пригнічує мРНК, що кодує SREBP1c
як попередник, так і ядерна форма SREBP1c. Оскільки SREBP1c є ключовим фактором транскрипції декількох ліпогенних генів, його зниження призводить до зменшення експресії ліпогенних генів та de novo ліпогенезу.
Очевидно, що вплив жирних кислот на функцію клітин виходить далеко за межі того, щоб служити джерелами енергії та структурними компонентами мембран. Жирні кислоти потрапляють в клітини, піддаються метаболізму і можуть служити лігандами як мембранних, так і ядерних рецепторів. Альтернативно, жирні кислоти або їх метаболіти можуть регулювати ядерну кількість SREBP1c, ключового фактора транскрипції в синтезі жирних кислот і триацилгліцеринів.
РЕЗЮМЕ
Я висвітлив деякі останні досягнення в регуляції макроелементів експресії генів, і я надав деталі, необхідні для розуміння ролі та впливу цих поживних речовин. На додаток до своєї ролі джерела енергії, як структурних елементів або попередників сигнальних молекул, макроелементи явно мають глибокий вплив на експресію генів. Ця взаємодія поживних речовин і геному взаємодіє з іншими сигнальними мережами, щоб забезпечити інтеграцію клітинного контролю між споживанням їжі та внутрішніми механізмами регулювання. Він відображає адаптивну реакцію, дозволяючи клітинам пристосовуватися до змін у типі, кількості та тривалості поживних речовин для ефективного росту.
- Штучна освіта - РД поєднує харчування та творчі вирази, щоб найкраще навчати студентів
- Форум здоров’я та харчування тварин - “Харчування шлунково-кишкового тракту, біохімія,
- Теорії старіння та харчування, наслідки та вплив поживних речовин SpringerLink
- Тяга тварин Додаток Б Харчування тварин Розрахунок раціону
- Харчування тварин та раціони кормів Infonet Biovision Home