Збільшення секреції аліментарного інсуліну, незважаючи на подібні реакції шлункового інгібуючого пептиду (GIP) при неповнолітньому ожирінні
Анотація
Швидкість секреції інсуліну більша після перорального прийому глюкози, ніж після парентерального введення еквівалентного глюкозного навантаження. Ця посилена секреторна реакція β-клітин на пероральне навантаження глюкозою є результатом вивільнення головним чином двох гормонів кишечника: шлункового інгібуючого поліпептиду (GIP) та глюкагоноподібного пептиду-1, які посилюють індуковану глюкозою секрецію інсуліну. Через їх інсулінотропну дію їх аномальна секреція може брати участь у патогенезі гіперінсулінемії дитячого ожиріння. У цьому дослідженні ми використовували гіперглікемічний затискач з невеликим навантаженням глюкозою всередину, щоб оцінити вплив дитячого ожиріння на відповідь GIP у семи худих передпубертатних та 11 передпубертатних дітей із ожирінням та у 14 худих підлітків та 10 підлітків із ожирінням. Глюкозу в плазмі крові гостро підвищували до 11 мМ шляхом введення внутрішньовенно. глюкози і витримували при цій концентрації протягом 180 хв. Кожен суб'єкт поглинав перорально глюкозу (30 г) через 120 хв, а інфузію глюкози регулювали для підтримання плато глюкози в плазмі. Базальні концентрації інсуліну та С-пептиду та швидкість секреції інсуліну (розраховані методом деконволюції) були значно більшими у дітей із ожирінням у порівнянні з худими дітьми (стор
Добре відомо, що прийом глюкози породжує більший рівень концентрації циркулюючого інсуліну в плазмі порівняно з внутрішньовенним введенням. навантаження глюкозою (1, 2). Це збільшення секреції інсуліну в основному спричинене вивільненням кишкових гормонів, які діють на β-клітини для посилення секреції інсуліну, індукованої глюкозою (3). Цей ефект, відомий як ефект інкретину, в основному пояснюється GIP, що виробляється K-клітинами дванадцятипалої кишки та тонкої кишки (4–8), та GLP1 (7–36 амід) з L-клітин клубової кишки ( 9–15).
Значення інкретинового ефекту випливає з центральної важливості інсуліну та порушень в обміні інсуліну в патологічних станах ожиріння та діабету 2 типу. Гіперінсулінемія, найчастіша біохімічна зміна ожиріння, є наслідком посиленої секреції інсуліну, а також зменшення дробової екстракції печінки через інсулін (16). Підвищена секреція інсуліну, особливо після їжі, була пов’язана на кількох моделях ожиріння на тваринах із надмірно активною ентеро-інсулярною віссю (17, 18). Наприклад, мутантна ob/ob миша демонструє генералізовану гіперплазію ендокринної клітини тонкої кишки (17), і концентрація GIP в кишечнику, і циркулююча концентрація гормону підвищені (19). Ці відхилення можуть бути вторинними для збільшення споживання енергії, а не основними. Більше того, миша ob/ob виявляється особливо чутливою до інсулінотропного ефекту GIP (20). Подібні результати були знайдені у мишей db/db (21), але не у жирних щурів Цукера (fa/fa) (22).
Однак невідомо, чи можуть такі моделі ожиріння гризунів визначити роль ентеро-інсулярної осі в невпорядкованій функції β-клітин при ожирінні людини. Хоча деякі дослідження спостерігали підвищену концентрацію GIP натще у дорослих із ожирінням (3) та перебільшену відповідь GIP на пероральний вміст глюкози або рідкої їжі (23-26), інші дослідження не змогли знайти збільшення кількості стимульованих поживними речовинами реакцій GIP у дорослих страждають ожирінням (27, 28). Різниця у глюкозі або розмірі їжі та їх складі, можливо, сприяла мінливості реакцій GIP у цих дослідженнях. Примітно, що цілісність GIP-відповіді ніколи не досліджувалась при ожирінні у дітей, що чітко асоціюється з порушенням регуляції функції β-клітин на ранніх стадіях її розвитку.
У поточному дослідженні ми використовували гіперглікемічний затискач з невеликим навантаженням пероральної глюкози, щоб вивчити внесок GIP у глюкозо-індуковану секрецію інсуліну при ожирінні у дітей (2, 29). Ця методика дозволяє розділити ефекти гіперглікемії та кишкових інсулінотропних факторів на відповідь β-клітин.
GIP стимулює секрецію інсуліну лише за наявності гіперглікемії легкого та середнього ступеня (29). Дійсно, GIP, що виділяється у відповідь на прийом жиру, сам по собі не стимулює секрецію інсуліну, слугуючи захистом від невідповідної секреції інсуліну та гіпоглікемії (22). Оскільки інсулінотропна дія GIP залежить від глюкози, з більшими ефектами, що спостерігаються при більш високих концентраціях глюкози, ми підняли глюкозу в плазмі до гіперглікемічних концентрацій (11 мМ), щоб мати можливість вивчити її потенціюючий вплив на секрецію інсуліну у худих та ожирілих дітей.
МЕТОДИ
Предмети.
Були вивчені чотири групи суб'єктів, і їх клінічні та біохімічні характеристики вказані в таблиці 1. Діти до пубертату клінічно пройшли стадію Таннера I без біохімічних ознак статевого дозрівання. Підлітки відповідали етапу Таннера і коливались між III та IV. Зразки плазми для вимірювання естрадіолу та тестостерону також брали як біохімічні маркери розвитку пубертату (табл. 1).
Як показано в таблиці 1, вага (у кілограмах) та ІМТ (кілограми на квадратний метр) були значно більшими у людей із ожирінням. IGF-I був найвищим у худих підлітків порівняно з усіма іншими групами (стор 95-й процентиль, специфічний для віку та статі (на основі кривих процентилю для білих дівчаток та хлопців, підрахованих за першим Національним обстеженням здоров’я та харчування 1971–1974 рр.) (30). Відсоток ідеальної ваги за зростом становив> 150% для дітей із ожирінням та 6). Цей аналіз не виявляє реакційної здатності до гастрину, глюкагону, секретину, холецистокініну, панкреозиміну, мотиліну або VIP і не має перехресної реакції з GLP1. Внутрішньо- та міжаналітична мінливість становила 6,2% та 7,8% відповідно.
Визначення ISR.
ISR розраховували шляхом деконволюції концентрацій C-пептидів у плазмі, використовуючи двокампанентну модель кінетики C-пептиду, як описано раніше (31). Ми використовували стандартні кінетичні параметри, що описують кліренс С-пептиду на основі 200 індивідуальних кривих розпаду біосинтетичного С-пептиду у дорослих із нормальним ожирінням та діабетом (32). Ці параметри враховують відмінності на основі віку, статі та площі поверхні тіла. Площа під швидкістю секреції інсуліну та концентрацією інсуліну була розрахована від 0 до 120 хв та від 120 до 180 хв гіперглікемічного затиску, який представляє як глюкозу, так і інкретин. Співвідношення між цими двома областями забезпечило непрямий показник кліренсу ендогенного інсуліну до і після перорального навантаження глюкозою (32, 33).
Статистичний аналіз.
Усі значення представлені як середнє значення ± SEM. Статистичний аналіз проводили з використанням двостороннього ANOVA з повторним дизайном вимірювань та двопалими парними т тест. Коефіцієнти кореляції Пірсона були розраховані для оцінки ступеня зв'язку між змінними. AUC визначали за трапецієподібним правилом від 0 до 120 хв та від 120 до 180 хв дослідження. Відмінності вважалися статистично значущими, якщо відповідні стор ≤ 0,05. Всі статистичні аналізи проводились за допомогою програми комп'ютерного аналізу SAS (версія 6; Інститут SAS, Кері, штат Північна Кароліна).
РЕЗУЛЬТАТИ
Базальна та стимульована концентрація інсуліну та С-пептиду та ISR.
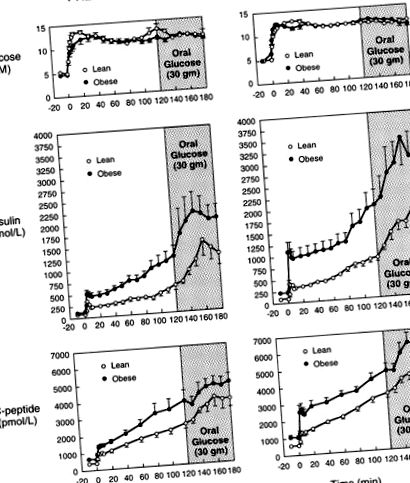
Рисунок 1 ілюструє концентрацію глюкози, інсуліну та С-пептиду в плазмі крові під час гіперглікемічного затиску з пероральним вмістом глюкози у худих і ожирілих передпідлітків та підлітків. У всіх групах рівень глюкози в плазмі підвищувався і підтримувався на рівні 11 мМ за допомогою змінної інфузії 20% глюкози. Це гіперглікемічне плато зберігалося навіть після прийому 30 г пероральної глюкози через 120 хв затискача.
Концентрація глюкози, інсуліну та С-пептиду у плазмі крові під час досліджень гіперглікемічного затиску та перорального дослідження глюкози.
Базальна концентрація інсуліну та С-пептиду в плазмі була більшою в групах ожиріння, ніж у худих дітей (стор Малюнок 2
Швидкість секреції інсуліну під час досліджень гіперглікемічного та орального глюкози.
Площа під кривими секреції інсуліну до і після перорального навантаження глюкозою у худих та ожирілих дітей.
Щоб визначити, чи відрізнявся кліренс інсуліну у худих та ожирілих дітей, ми розрахували співвідношення між AUC секреції інсуліну та AUC концентрації периферичного інсуліну до і після перорального навантаження глюкози. Цей коефіцієнт, що забезпечує опосередкований показник ендогенного кліренсу інсуліну, був незначно, але не суттєво нижчим у ожирілих передпідлітків та підлітків (10,7 ± 1,1 та 10,4 ± 1,1 мл/хв відповідно), ніж у худих передпідлітків та підлітків (11,5 ± 0,7 та 12,9 ± 0,5 мл/хв відповідно). Після прийому малого навантаження глюкозою кліренс інсуліну значно впав як у людей із ожирінням (6,1 ± 0,8 та 6,8 ± 0,8 мл/хв відповідно), так і у худих дітей (6,6 ± 0,8 та 7,9 ± 0,7 мл/хв відповідно), досягнувши значень, які були практично однаковими у всіх чотирьох групах.
Відповідь GIP.
Концентрації GIP в циркулюючому плазмі були подібними на початковому рівні у дітей із ожирінням та худорлявими дітьми і залишалися незмінними протягом перших 120 хв гіперглікемічного затиску (рис. 4). Навпаки, у всіх чотирьох групах концентрація GIP у плазмі різко зросла після прийому всередину глюкози (стор Малюнок 4
Зміни концентрацій GIP у плазмі крові під час досліджень гіперглікемічного затиску та перорального дослідження глюкози.
ОБГОВОРЕННЯ
Інсулінотропні ефекти GIP та GLP1 залежать від глюкози, причому більші ефекти спостерігаються при більш високих концентраціях глюкози (29). Отже, гіперглікемічний стан, використаний у цьому дослідженні, чітко дозволив нам вивчити потенціюючий вплив цього кишкового фактора на секрецію інсуліну. При концентрації евглікемії GIP не впливає на β-клітину, і він стимулює секрецію інсуліну, коли концентрація глюкози в плазмі перевищує 110 мг/дл (6 мМ) (22). Насправді було запропоновано перейменувати GIP в глюкозозалежний інсулінотропний поліпептид (29). Хоча в умовах, що використовуються тут, глюкоза була затиснута у більш високих концентраціях, ми маємо докази того, що у деяких ожирілих дітей спостерігається легка постпрандіальна гіперглікемія, хоча їх толерантність до вуглеводів не порушується (Соня Капріо, особисте спілкування).
Зрозуміло, що GIP сам по собі не може пояснити повний ефект інкретину, який зазвичай асоціюється зі змішаним прийомом їжі, і що додаткові ефекти викликані інсулінотропними ефектами GLP1 (7–36) (29). Слід підкреслити, що на молярній основі приріст GIP після перорального навантаження глюкози (75 г) або стандартного сніданку майже в 4 рази перевищує показник GLP1 (36). З вищих концентрацій GIP у плазмі крові в базальному та постпрандіальному станах було висловлено припущення, що фізіологічно GIP є кількісно більш важливим гормоном інкретину (37).
Значне підвищення концентрації ГІП лише після прийому всередину 30 г глюкози (120 кал), безсумнівно, опосередковувало гостру стимуляцію секреції інсуліну, що спостерігається як у худих, так і у дітей із ожирінням. Однак ми не можемо виключити, що інші інкретини, зокрема GLP1, також були вивільнені в нинішніх умовах, тим самим синергізуючи з GIP для збільшення секреції інсуліну. Цю можливість ще слід вивчити.
У цьому дослідженні ми використовували модель із двома відділеннями для оцінки ISR на основі периферійних концентрацій С-пептиду (31). Використовуючи цей кількісний аналіз, ми виявили підвищену концентрацію базального інсуліну та відповіді першої та другої фази плазми на інсулін у худому статевому пубертаті проти худих дітей перед пубертатом, що може бути враховано збільшенням ISR. Більше того, ISR в цих умовах були значно перебільшені наявністю та тяжкістю ожиріння. Дійсно, між базальним (р = 0,56, стор 16). На відміну від даних, повідомлених для дорослих із ожирінням (16), кліренс інсуліну був подібним у худорлявих та ожирілих дітей, і не було виявлено зв'язку між кліренсом інсуліну та ІМТ. Наше дослідження показує, що підвищена секреція інсуліну є найважливішим фактором патогенезу гіперінсулінемії дитячого ожиріння, тоді як кліренс інсуліну, здається, менше впливає. Слід зазначити, що кінетичні фактори С-пептиду, що використовуються для розрахунку ISR, базуються на даних для дорослих популяцій, і дані, що базуються на кривих розпаду С-пептидів у педіатричної популяції, будуть ідеальними. Однак, наскільки нам відомо, таких даних не існує. В даний час біосинтетичний С-пептид недоступний для проведення цих досліджень.
На закінчення ми виявили, що за умови стабільної гіперглікемії прийом невеликої кількості глюкози викликав еквівалентні відповіді на GIP як у худих, так і у підлітків із ожирінням. Однак, незважаючи на подібні концентрації GIP, секреція інсуліну помітно посилювалась у підлітків із ожирінням. Таким чином, при неповнолітньому ожирінні надмірна аліментарна стимуляція β-клітин може бути незалежною від підвищеного вивільнення кишкових гормонів, таких як GIP.
- Кровопускання покращило секрецію інсуліну та чутливість у недавньому дослідженні
- Кровопускання покращує чутливість та секрецію інсуліну паралельно зменшенню заліза в печінці
- Огляд дивертикулу шлунка Світовий журнал екстреної хірургії Повний текст
- Екстракт журавлини, багатий поліфенолами, захищає від ожиріння, спричиненого дієтою, резистентності до інсуліну та
- Бенджамін Бікман - значення низьковуглеводного харчування; Глюкагон вгору, інсулін вниз