ASEE Prism
Ласкаво просимо до Prism Online
Нова інженерна дисципліна сподівається на виготовлення персоналізованих органів для випробувань або заміни.
Каймінг Є, професор біоінженерії з Бінгемтонського університету, бачить майбутнє охорони здоров’я: пацієнт звертається до лікаря зі скаргами на болі в грудях і діагностує серйозні захворювання серця. Частина його клітин збирається, можливо, під час біопсії або зразка крові. Клітини обробляються і стають базовим матеріалом для створення нового, здорового серця - можливо, виготовленого за допомогою швидкого прототипу або тривимірного принтера - це унікальне для нього. Незабаром - можливо, навіть пізніше того ж дня - нове серце готове до імплантації в тіло пацієнта, замінивши його старий, пошкоджений білет. Ви передбачаєте, щоб подібні процеси використовувались для заміщення багатьох інших пошкоджених або хворих тканин та органів людини. Дійсно, будь-яка технологія, яка може створити настільки складний м’яз, як серце, може легко викинути простіші органи, такі як печінка та нирки.
На замовлення запчастини для зламаних людей можуть здатися науковою фантастикою, але Є впевнений, що така медична революція вже недалеко - за умови, що для її розвитку може бути створена промислова база. “Ця галузь ще не існує; є просто колекція окремих лабораторій », - говорить він. Ось чому ось уже кілька років він є одним із ряду науковців, які активно працюють у зусиллях Національного наукового фонду (NSF) створити як інженерну дисципліну, так і галузь: передове біовиробництво. Мета полягає в тому, щоб забезпечити виробничу базу не тільки для тканинної інженерії - побудови цілих тканин і органів людини для скринінгу наркотиків і, врешті-решт, для трансплантації, - а також для швидкозростаючої галузі клітинної та персоналізованої терапії або регенеративної медицини, які використовують клітини або як імунізацію, або як частину пластирів та імплантатів, щоб вилікувати низку захворювань.
Історія тканинної інженерії та клітинної медицини порівняно коротка. Це було визначене поле лише з середини 1980-х років, і сучасні сучасні версії розпочалися наприкінці 90-х з розвитком технологій стовбурових клітин, зокрема винаходом процесу перепрограмування зрілих дорослих клітин назад у стовбурові клітини або плюрипотентні стовбурові клітини, які можна спонукати виростити будь-який тип тканини. Ранній успіх досяг у 1999 році. Тоді Ентоні Атала, директор Інституту регенеративної медицини Вейк-Форест, успішно використав покриття із покриттям стовбурових клітин для створення штучних сечових міхурів для семи дітей, хворих на роздвоєння хребта. Зовсім недавно, в 2013 році, хірурги успішно пересадили біоінженерну трахею 2-річній дівчинці, хоча пізніше дитина померла від інших ускладнень.
Рухаючись за допомогою нових технологій - насамперед тривимірного друку - поле перейшло на надмірне. Важлива стаття дворічної давнини, написана групою під керівництвом професора клітинної та молекулярної фармакології Каліфорнійського університету в Сан-Франциско Венделла Ліма, стверджує, що "сьогодні біомедицина стоїть на порозі нової революції: використання мікробних та людських клітин як універсальних терапевтичних двигунів », який став би новим« третім стовпом »медицини, в якому зараз переважають маломолекулярні фармацевтичні препарати та біопрепарати, такі як рекомбінантні гормони та препарати на основі антитіл. Але ця революція, що зароджується, додає вона, "зажадає розвитку основоположної інженерної науки про клітину, яка забезпечує системну основу для безпечного та передбачуваного зміни та регулювання поведінки клітин". І саме в цьому «рухається розвинене біовиробництво», говорить Афанасіос Самбаніс, директор програми відділу хімічних, біоінженерних, екологічних та транспортних систем NSF.
Стандартизація процесів
Потрібна нова дисципліна "для того, щоб визначити найважливіші виклики та бар'єри, які необхідно подолати для просування галузі", та навчити інженерів та вчених, які б керували нею, пояснює Самбаніс, який також є професором хімічної та біомолекулярної галузей. машинобудування в Georgia Tech. По суті, NSF регулює свій вплив та фінансування, щоб створити та назвати нову інженерну дисципліну, орієнтовану на лазерну регенеративну медицину. Це поняття завойовує похвалу дослідників регенеративної медицини. "Безумовно, необхідна стандартизація процесів тканинної інженерної терапії регенеративною медициною, щоб зменшити витрати та зробити виробничі процеси більш економічними, ефективними та стійкими", - говорить Атала, інститут якого ініціював науково-дослідну програму з промислового машинобудування школі та брав участь в одному з передових семінарів з біовиробництва NSF.
Коли NSF спонсорував у липні 2013 року семінар-практикум з удосконаленого біовиробництва, робоче визначення було ширшим і включало більш традиційні технології біовиробництва, такі як інженерні бактерії для виробництва фармацевтичних препаратів, палива та нових матеріалів. NSF навмисно розпочав з більш інклюзивного визначення, щоб гарантувати, що жодні важливі сфери не залишаються поза увагою, говорить Самбаніс. З тих пір NSF спонсорував 15 або більше таких семінарів, і з’явилося більш вузьке, точне визначення, яке повністю зосереджено на регенеративній медицині. "Ми хочемо відрізнити це від традиційної біоіндустрії", - пояснює Є. «Це не ферментація наркотиків; це не біореактори ".
Поза NSF те, що називається вдосконаленим біовиробництвом, залишається досить широким та еластичним, і це може заплутати. Наприклад, університет Великобританії в Шеффілді може похвалитися Розширеним центром біовиробництва, але його дослідження широкомасштабне і включає сфери, які, на думку NSF, не належать до цієї дисципліни - біологічні процеси виробництва хімічних речовин, енергії та їжі, наприклад. "Поки що в усьому світі не існує згоди щодо того, що таке вдосконалене біовиробництво", - говорить Олександр Леонеса, доцент кафедри машинобудування в Virginia Tech, який керує програмою інженерії загальних та вікових інвалідностей NSF. Назва "насправді не охоплює реальної задіяної роботи", говорить він. Деякі залучені зараз розглядають можливість пошуку нового імені.
Тканини, вирощені на замовлення
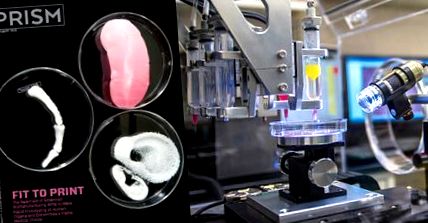
Ви вважаєте, що органи, побудовані з нуля, можуть бути легко доступні протягом п’яти-десяти років, принаймні найосновніші, такі як підшлункова залоза та печінка. Звичайно, серця дуже складні, і штучно вирощені в лабораторіях, ймовірно, через пару десятиліть. Існує щонайменше три різні методи побудови органів з живих клітин. Найбільше уваги привертає тривимірний друк, який використовує багаті клітинами біологічні фарби або гідрогель для побудови органу по одному надтонкому шару за один раз на основі складних комп’ютеризованих тривимірних моделей, що включають судинні системи. Існує також оригінальний метод побудови органів з клітинами на ешафотах, саме так Атала формував свої сечові міхури. Його біологічно розкладаються риштування були утворені з колагену або композиту колагену та полігліколевої кислоти. Третій метод, що використовується переважно в Японії, - це двовимірна конструкція, яка також вирощує власну матрицю і самостійно збирається у тривимірний орган.
Інша можлива технологія - це так званий орган на чіпі, мікрочіп, на який вбудовані та відведені від пацієнта дротові клітини, щоб визначити, як ліки однозначно впливатиме на один з його органів. Вже існують компанії, що працюють над комерціалізацією цього типу технологій. "Це великий прогрес, але він обмежений", - говорить Самбаніс. Хоча він може визначити вплив ліків на один або, можливо, два органи, він не може відтворити, як це може вплинути на все тіло пацієнта. Щоб обійти це, каже він, дослідники працюють над розподілом всього людського тіла на окремі модулі, "як функціонуюча особа", а також розміщують і з'єднують усі ці модулі на одному чіпі. NSF сподівається незабаром призначити семінар-практикум, щоб спробувати з'ясувати, чи можна досягти консенсусу між слідчими щодо критеріїв, щоб врешті-решт визначити, який метод найкраще працює.
Потенціал зменшення витрат
Хоча зрештою дослідники очікують, що створені людиною органи будуть використовуватися для трансплантації, швидше за все, вони спочатку будуть використовуватися для скринінгу наркотиків, усуваючи необхідність проведення деяких дослідів на тваринах та людях. Це скоротить витрати на розробку. Дійсно, нинішня висока вартість виведення нових видів терапії на ринок є однією з визначних пам'яток клітинної медицини. Важко передбачити, як пацієнти реагують на маломолекулярні та біологічні препарати, тому ці препарати потребують у середньому 14 років для розвитку та мають коефіцієнт відмови більше 95 відсотків. Успішне комерціалізація нової лікарської терапії може коштувати близько 2 мільярдів доларів. Як зазначено в дослідженні UCSF, клітинна терапія є дуже складною, але ця складність "може насправді зробити ці агенти більш передбачуваними в клініці, ніж малі молекули або біопрепарати", а отже, дешевшими в розробці.
На даний момент тканинна інженерія та клітинна терапія надзвичайно дорогі. Тим не менше, деякі компанії вже використовують імунні клітини пацієнтів для лікування раку. "Є переваги", - каже Самбаніс, головним чином те, що на відміну від хіміотерапії, немає різких побічних ефектів. Але до цих пір ці терапії, крім того, що є дуже дорогими, не справляють вражаюче краще, ніж інші препарати. Це пояснюється тим, що спосіб їх виготовлення зараз неефективний, каже Є. В даний час все робиться вручну, тому результати залежать від того, хто збирає клітини, а хто їх змінює. "Вам потрібен більше контролю якості", - наполягає він. Мета полягає в розробці стандартизованих автоматизованих систем, які спираються на належну виробничу практику для збирання та маніпулювання клітинами до того, як їх вводять, вбудовують у пластири чи імплантати або вирощують у цілий орган, що підлягає трансплантації. "Нам потрібно підвищити ефективність процесів", - стверджує Беттінгер.
Інша проблема - як збільшити масштаби персоналізованої медицини. Наприклад, якщо ви говорите про пересадку сердець, кожній людині потрібно лише одне, але в цьому може бути мільйон людей. Отже, це мільйон сердець, усі унікальні. І на відміну від традиційного виробництва, яке спирається на однакові типи та кількість сировини, кожна персоналізована терапія потребуватиме різної сировини. І все ж кінцеві результати повинні мати певну єдність - кожне серце може бути особливою конструкцією, але воно повинно виконуватись як серце. Виконати ці завдання буде непросто, попереджає Девід Вільямс, професор, директор з міжнародних справ Інституту Вейк-Форест. Уільямс, який також є президентом Міжнародного товариства тканинної інженерії та регенеративної медицини (TERMIS), у минулому році був співавтором статті в Science Translational Medicine, яка вказує на труднощі у спробі стандартизувати та автоматизувати виробничі процеси, що забезпечують лікування пацієнта.
Галузі також потрібні ланцюги поставок. Для цього ключові постачальники забезпечували б основи синтетичної біології, які часто називають біоцеглями. Ці блоки послідовностей ДНК розміщуються в живих клітинах - людських, але часто клітини бактерій E. coli - LEGO-подібні, щоб переробити їх, щоб викликати функцію, яка не існує в природі, скажімо, зупиняючи перевиробництво білка, що викликає захворювання. "Це побудова цілої системи, починаючи від клітинного рівня", - пояснює Леонеса.
Також важливим для вдосконаленого біовиробництва, але не його частиною, будуть ефективніші технології моніторингу та візуалізації, які краще дозволять лікарям бачити, як працюють трансплантати. Також потрібно винаходити неінвазивні пристрої, що контролюють створення нової тканини або органів. Якщо ви готуєте новий препарат у біореакторі, можна вийняти невелику пробу для тестування. "Але якщо у вас вирощують серце із стовбурових клітин, якщо ви виймаєте одну клітину, ви зупиняєте процес", - пояснює Є.
Що б в кінцевому підсумку це не називали, зростаюча дисципліна може призвести до збільшення фінансування досліджень тканинної інженерії. "Створення нової дисципліни, безсумнівно, допоможе вимагати і сприятиме збільшенню фінансування досліджень у цій галузі", - прогнозує Є. Наразі, на думку деяких прихильників, фінансування було надто мізерним. У грудні 2013 року заснований у Вірджинії Фонд Мафусаїла розпочав премію "Новий орган з печінкою" у розмірі 1 мільйон доларів, п'ятирічний конкурс на розвиток тканинної інженерії та регенеративної медицини та обґрунтування необхідності збільшення фінансування. Група нарікає, що фінансування цієї галузі в США складає менше 500 мільйонів доларів на рік, що є незначною сумою порівняно з тим, що ФНП та Національний інститут охорони здоров’я разом витрачають на рак та ВІЛ/СНІД. У електронному листі до Prism у відповідь на цю критику NSF наголосив, що "протягом декількох десятиліть відігравав важливу роль у появі тканинної інженерії як галузі", додаючи: "NSF продовжує розглядати розвинене біовиробництво як критичну область" і "Важливим напрямом інвестицій".
Хоча поки що немає жодних оцінок того, наскільки великою може бути побудована вітчизняна чи глобальна галузь навколо передового біовиробництва, співробітники NSF кажуть, що ця галузь може дати значний економічний поштовх економіці Америки. Нещодавно група прихильників поїхала до Європи та Азії, щоб оцінити глобальний статус передових досліджень біовиробництва. "Вони [європейські та азіатські дослідники] значною мірою інвестують у цю сферу", - говорить Самбаніс. "Вони думають, що це майбутнє не лише для лікування пацієнтів, але й економічної можливості". Наприклад, нещодавня стаття португальських дослідників виклала прогрес у технологіях біофабрикації для регенерації та відновлення пошкодженої шкіри, а також проблеми, які залишаються; Незабаром дослідники Единбурзького університету розпочнуть клінічні випробування клітинної терапії для стимулювання стовбурових клітин печінки для формування нової, здорової тканини та відновлення пошкоджень, спричинених цирозом; і дослідники шведського університету в Гетеборзі ініціюють зусилля з біоінженерної матки для лікування безплідних жінок.
Будь-яка дисципліна, яка може змінити спосіб надання медичної допомоги, безсумнівно, буде величезною. І, за словами Леонеси, великі фармацевтичні компанії звертають увагу, і багато хто бачить необхідність брати участь. Великі фармацевтичні товари виробляють і заробляють мільярди доларів на різноманітних ліках, у тому числі на, наприклад, для лікування діабету. Але якщо інженери зрештою вироблять нові трансплантаційні підшлункові залози зі стовбурових клітин, попит на інсулін зникне. "Це зробить революцію у тому, що вони роблять [велика фармація], або виведе їх з ринку", - говорить Леонеса.
Стигма та обережні слова
Усі прихильники передового біовиробництва погоджуються, що ключовою метою є забезпечення освіченості нового покоління інженерів та науковців для задоволення потреб дисципліни. Але все ще ведуться суперечки щодо того, чи повинні бути програми з дисципліни. "Я думаю, що це відбудеться", - каже Леонеса, можливо, спочатку неповнолітньою, просунувшись до сертифіката, і врешті-решт просунувшись до аспірантури, перш ніж стати бакалавратом. Вільямс каже, що він вітає зусилля, спрямовані на підвищення рівня освіти з цієї дисципліни, додаючи, що "над цим я працюю в TERMIS". Але Беттінгер переживає, що стигматизація виробництва може викликати шкоду для деяких студентів. "Це звучить як робота" синіх комірців ", але це зовсім не так". Леонеса погоджується: "Виробництво - це велике слово, до якого додається багато багажу".
Є, звичайно, слова обережності. Уільямс організував конференцію з питань регенеративної медицини в Сіані, Китай, яка висвітлила деякі інші бар'єри. Вони включають труднощі у розробці системного інженерного підходу для інтеграції всіх нових швидкозростаючих технологій, що використовуються в передовій біовиробництві, таких як наука про стовбурові клітини, методи біофабрикації та візуалізація регенерованої тканини; відсутність міжнародно визнаних стандартів для тестування інженерних тканин; консервативне ставлення багатьох регулюючих органів; високі витрати та недостатнє фінансування; та етичні проблеми. Дійсно, технологічна консалтингова компанія Gartner Inc. попереджала в 2013 році, що технологія біодруку органів розвивається настільки стрімко, що спричинить серйозні етичні дискусії вже наступного року. "Можливість друкувати людські органи та тканини буде набагато швидше, ніж загальне розуміння та прийняття наслідків цієї технології", - сказав Піт Басільєр, директор досліджень Gartner. Буде занепокоєння, якщо в органах будуть використовуватися нелюдські клітини, і занепокоєння щодо якості та технологій виробництва, сказав він.
Ось чому важливо терміново вирощувати промислову базу для вдосконаленого біовиробництва, яка поглиблена контролем якості, каже Є. Хороша виробнича практика допоможе переконати регуляторів - і громадськість - у тому, що лікування на основі клітин є безпечним та передбачуваним, стверджує він. Ви також впевнені, що залучення технологій, які можуть вилікувати недуги, а не просто лікувати, виявиться непереборним. З точки зору маркетингу, це унікальна точка продажу сучасного біовиробництва - і це сильна сторона.
Томас К. Гроуз
Томас К. Гроуз - головний кореспондент Призми, який базується у Великобританії.
Дизайн Нікола Ніттолі
Зображення надано Інститутом регенеративної медицини Вейк-Форест
- Як встановити дефіцит калорій при втраті жиру; Повна продуктивність людини
- Скільки вуглеводів для поповнення глікогену після підйому; Повна продуктивність людини
- Його можна назвати людською сіткою
- Як виготовляється пилосос - виробництво, виготовлення, історія, запчастини, машина, історія, сировина
- Довготривале обмеження калорій покращує клітинні процеси контролю якості скелетних м’язів людини