Захворювання нирок та множинна мієлома
Еліот К. Хехер
* Нефрологічний відділ та Центр трансплантації, штат Массачусетс, загальна лікарня, Бостон, штат Массачусетс;
Гельмут Г. Ренне
† Відділення патології, Бригам і жіноча лікарня, Бостон, штат Массачусетс; і
Якоб П. Лаубах
‡ Центр множинної мієломи Джерома Ліппера, Відділ гематологічної злоякісності, Департамент медичної онкології, Інститут раку Дани Фарбер, Бостон, штат Массачусетс
Пол Г. Річардсон
‡ Центр множинної мієломи Джерома Ліппера, Відділ гематологічної злоякісності, Департамент медичної онкології, Інститут раку Дани Фарбер, Бостон, штат Массачусетс
Резюме
Пошкодження нирок є частим ускладненням множинної мієломи та інших дискразій плазматичних клітин, і це пов’язано зі збільшенням смертності. Багато патогенних механізмів можуть сприяти пошкодженню нирок у пацієнта з мієломою, частина з яких є результатом нефротоксичного моноклонального Ig, а частина з них не залежить від відкладення парапротеїнів. Патогенні механізми, що лежать в основі парапротеїнових захворювань нирок, дедалі чіткіше вивчені. Новий аналіз, що дозволяє кількісно оцінити вільні легкі ланцюги в сироватці, допоміг діагностувати нову хворобу та дозволив раніше виявити рецидив. Нові мієломні агенти продемонстрували значну перспективу у зменшенні ниркової недостатності у деяких пацієнтів та покращенні результатів. Трансплантація стовбурових клітин залишається головною опорою для лікування молодих пацієнтів з мієломою, які є придатними кандидатами для інтенсивної терапії, тоді як роль нових препаратів, плазмообмін та трансплантація нирок продовжує розвиватися.
Вступ
Традиційно серед найбільш тугоплавких та найстрашніших злоякісних захворювань множинна мієлома та інші пов’язані з нею розлади плазматичних клітин отримують заслужену увагу внаслідок значного прогресу у розумінні базової біології злоякісних плазматичних клітин та наявності більш ефективних та менш токсичних нових методів лікування. У той же час, ниркові ефекти розладів плазматичних клітин також отримують підвищену увагу, оскільки ширший патологічний та клінічний спектр цих захворювань краще оцінюється, а терапевтичні можливості розширюються. Визначена аномальним кліренсом креатиніну, ниркова недостатність присутня майже у половини хворих на мієломну хворобу при появі і пов’язана зі збільшенням смертності. Наявність співіснуючих захворювань нирок обмежує терапевтичні можливості та право на трансплантацію стовбурових клітин (1,2). У деяких серіях виживання зменшується до менш ніж 1 року у пацієнтів з асоційованою з мієломою АКІ, які не відновлюють функцію нирок, і насправді оборотність асоційованої з мієломою пошкодження нирок є більш передбачуваною для виживання пацієнтів, ніж відповідь на системну хіміотерапію (3,4).
До моноклональних розладів плазматичних клітин належать передзлоякісна моноклональна гаммопатія невизначеного значення (MGUS), одиночна плазмацитома, амілоїдоз легких ланцюгів (AL) та множинна мієлома як у її безсимптомній, так і в симптоматичній формі (5). Порушення є загальними, МГУС вражає до 3,2% всіх осіб старше 50 років, а множинна мієлома становить 13% усіх гематологічних раків (6–8) На момент діагностики 37% пацієнтів з мієломою мають менше 65 років. років, а ще 37% пацієнтів мають вік> 75 років; решта 26% - у віці від 65 до 74 років (8). З огляду на те, наскільки поширеними є порушення плазматичних клітин, очевидно, що нефрологи регулярно стикатимуться з цими станами.
Механізми ураження нирок мієломою та клітинами плазми крові
Таблиця 1.
Механізми ниркової недостатності при дискразіях плазмоклітин: Ig-залежні та -незалежні
| Ig-залежні механізми | |
| Нефропатія литого типу (традиційно відома як мієломна нирка) | Фактори ризику включають мієлому легкої ланцюга з виведенням моноклонального Ig> 10 г/д, виснаження об’єму, сепсис, ліки (див. Нижче); Осадження Ig відбувається переважно в канальцях |
| Моноклональне захворювання відкладення Ig | Може бути присутнім системний синдром; Відкладення Ig може бути в канальцях або клубочках, але, як правило, не в обох |
| Легкий ланцюговий амілоїдоз (AL) | Часто асоціюється з альбумінурією нефротичного діапазону та λ-легкими ланцюгами; може бути присутнім системний синдром, і відкладення амілоїдів відбувається переважно в клубочках |
| GN | Мембранопроліферативні, дифузні проліферативні, півмісяцеві, кріоглобулінемічні - всі визнані |
| Тубулоінтерстиціальний нефрит | Також це може бути наслідком не-Ig механізмів |
| Мінімальні зміни захворювання | Альбумінурія, як правило, присутня на додаток до легкої ланцюгової протеїнурії |
| Мембранозна гломерулопатія | |
| Пурпура Геноха – Шолейна/нефропатія IgA | Пов’язаний з мієломою IgA |
| Імунотактоїдна гломерулопатія (і, можливо, фібрилярна ГН) | Рідкісні умови; зв'язок між фібрилярною хворобою та парапротеїнами невизначений |
| Внутрішньокапілярні моноклональні відкладення тромбів IgM | Пов’язана з макроглобулінемією Вальденстрема |
| Тромботична мікроангіопатія (ТМА) | Парапротеїн спричинює пошкодження ендотелію, що спричиняє ТМА |
| Синдром гіперв'язкості | Частіше зустрічається у випадках мієломи IgA, IgG3 або IgM |
| Ig-незалежні механізми | |
| Виснаження об’єму | Може спричинити преренальну азотемію та гострий канальцевий некроз та/або сприяти розвитку гіпсової нефропатії |
| Сепсис | |
| Гіперкальціємія | Може спричинити AKI безпосередньо або сприяти розвитку гіпсової нефропатії |
| Синдром лізису пухлини | Сечова кислота або фосфатна нефропатія |
| Токсичність ліків | Золедронат: рідкісна причина гострої ниркової недостатності |
| Памідронат: рідкісна причина вогнищевого вогнищевого та сегментарного гломерулосклерозу | |
| Ненстериодні протизапальні препарати, інгібітор ангіотензинперетворюючого ферменту, блокатор рецепторів ангіотензину, петльові діуретики або йодований контраст можуть спричинити лить нефропатію | |
| Пряма паренхіматозна інвазія плазматичними клітинами | Рідкісна причина; асоційований із запущеною або агресивною мієломою |
| Пієлонефрит | Рідкісна причина; багатофакторний від імунодефіциту та дефіциту Ig та хіміотерапія від мієломи |
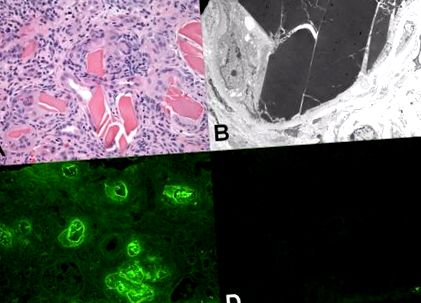
Нефропатія легкої ланцюга (також відома як мієлома нирки). (А) Канальці містять еозинофільні білкові зліпки, які мають кристалічний та розбитий вигляд. Зверніть увагу на помітну запальну реакцію з багатоядерними гігантськими клітинами чужорідного тіла, що знаходяться в безпосередній близькості від литого матеріалу (ділянка, забарвлена гематоксиліном та еозином). (В) Електронна мікроскопія показує характерний електронно-щільний литий матеріал всередині канальця. Умови в канальцях полегшили організацію легкого ланцюга в надмолекулярну кристалоподібну структуру. (C) Імунофлуоресцентна мікроскопія з флуоресцеїнованими анти-λ-антитілами показує сильне фарбування гіпсу для цього легкого ланцюга. Зверніть увагу на велике фонове фарбування тканини для λ-легкого ланцюга, відображення вищої плазми і, отже, концентрацію цього білка в тканинах. (D) Забарвлення зліпків для κ-легких ланцюгів є негативним. Крім того, фарбування фону для цього легкого ланцюга значно слабше, ніж для λ-легких ланцюгів.
Системне захворювання відкладень κ-легкого ланцюга. (А) Клубочок виявляє виразний вузликовий вигляд, спричинений розширенням мезангіального матриксу у відповідь на відкладення парапротеїну (ділянка періодичної кислоти – Шиффа). Зверніть увагу на потовщення трубчастих базальних мембран та помітний інтерстиціальний фіброз. (Б) Електронна мікроскопія показує характерні зливні та дрібнозернисті щільні відкладення типу Рендалла вздовж внутрішнього аспекту зморшкуватої клубочкової мембрани фундаменту. Ендотелій пошкоджений цим процесом і відсутній у цьому сегменті капілярної петлі. (C) За допомогою імунофлуоресцентної мікроскопії з флуоресцеїнованими анти-κ-антитілами всі базальні мембрани та мезангіальні вузлики виявляють сильне фарбування цього легкого ланцюга. (D) Фарбування фундаментних мембран та мезангіальних вузликів для λ-легких ланцюгів значно слабше і ближче до фону. Фарбування для всіх важких ланцюгів також є негативним (не показано).
Легкий ланцюг амілоїду (AL) зі специфічністю λ-легкого ланцюга із залученням клубочків (Glom) та артерій (Art). (А) Червона пляма Конго виявляє оранжево-червоні відкладення, що розширюють мезангій та проникають у периферійні стінки капілярів Глома та Мистецтва. (B) Амілоїдні відкладення демонструють характерне яблучно-зелене двозаломлення при погляді під поляризованим світлом. Тільки ті амілоїдні агрегати з фібрилами під певним кутом орієнтації демонструють зелене двозаломлення у будь-якому заданому положенні поляризаційних фільтрів. Коли обертають предметне скло на сцені мікроскопа, буде виявлено зелене двозаломлення амілоїдних відкладень з фібрилами під різними кутами орієнтації всередині тканини. (C) Імунофлуоресцентна мікроскопія з флуоресцеїнованими анти-λ-антитілами демонструє сильне фарбування грубих і зливних амілоїдних відкладень у Гломі та стінці. (D) Реакційна здатність амілоїду є негативною для κ-легких ланцюгів, як виявлено у флуоресцеїнованого реагенту проти κ-легкого ланцюга.
Мієломи, які виробляють лише легкі ланцюги, становлять 40% –60% важкої мієломно-асоційованої травми нирок, що відображає нефротоксичність фільтрованого легкого ланцюга (5). Насправді саме незвичайні властивості розчинності легких ланцюгів, пов’язаних з мієломою, призвели до їх первісної ідентифікації понад 150 років тому, як білки Бенс – Джонса, у пацієнта з легкою ланцюговою протеїнурією. Несекреторна мієлома рідко асоціюється з пошкодженням нирок. Баланс випадків обумовлений найпоширенішим типом мієломи, при якому інтактний моноклональний Ig виділяється разом з невеликою кількістю супутнього моноклонального легкого ланцюга. Деякий ступінь ниркової недостатності спостерігається в певний момент природної історії майже всіх випадків мієломи; У 70% пацієнтів, які виділяють більше 10 г/д легкого ланцюга, розвинеться ниркова недостатність, тоді як у тих пацієнтів з рідкісною формою мієломи IgD, здається, у деяких серіях у 100% випадків розвивається ниркова недостатність (2). Нефрологи, які проводять оцінку пацієнтів із ХХН, повинні мати на увазі, що іноді у пацієнтів розвивається MIDD в результаті малого клону плазматичних клітин, який продукує (23) моноклональний Ig з нефротоксичністю, що значно перевищує його вміст у плазмі (24).
Як детально викладено в таблиці 1, асоційована з мієломою ниркова недостатність також може бути наслідком Ig-незалежних механізмів. Ці механізми включають гіперкальціємію, нефропатію сечової кислоти, виснаження об’єму, сепсис, рабдоміоліз, нестероїдні протизапальні засоби та інгібітори ренін-ангіотензинової системи (25, 26). Рідко може бути присутнім пієлонефрит або пряма інвазія паренхіми нирок плазматичними клітинами. Амінобісфосфонат золедронат рідко асоціюється з АКІ у хворих на мієлому, а його фармакологічний двоюрідний брат памідронат асоціюється із руйнується ФСГС (27,28). З огляду на те, що бісфосфонати відіграють дуже важливу роль у контролі кісткової хвороби при мієломі та лікуванні гіперкальціємії, їх обережне застосування слід продовжувати, незважаючи на ці повідомлення, причому памідронова кислота часто надається перевагу при порушеннях функції нирок та золедоновій кислоті зі зниженою дозою бути корисним. Невизначеність щодо бісфосфонатів, на яку слід звернути увагу у майбутніх клінічних випробуваннях, включає дозу та тривалість застосування, особливо у пацієнтів із запущеною ХХН або діалізною залежністю, у яких може спостерігатися більший ризик розвитку адинамічної хвороби кісток та інших ускладнень в результаті зниження ниркового кліренсу наркотики.
Значного прогресу було досягнуто у з'ясуванні молекулярних подій, що призводять до моноклональних Ig-опосередкованих пошкоджень нирок, що було предметом нещодавнього огляду (29). Легкі ланцюги фільтруються в клубочку і зазнають клатрин-залежного ендоцитозу за допомогою рецепторної системи мегалін/кубілін. Деякі з цих легких ланцюгів стійкі до хімічної деградації і накопичуються у вигляді осадів, які заважають функції проксимальних канальців (30,31). Легкі ланцюги, що руйнуються, індукують прозапальні цитокіни, такі як моноцитарний хемоаттрактантний білок-1 та IL-6 та -8 (32,33). Ці легкі ланцюги також, здається, каталізують продукцію активних форм кисню, що, в свою чергу, призводить до запальної інфільтрації клітин, відкладення матриксу та фіброзу, і це може сприяти епітеліально-мезенхімальній трансформації епітеліальних клітин ниркових канальців (34). Як активована мітогеном кіназа, так і шляхи NF-κB опосередковують провоспалительный каскад (32,33).
Виявлення моноклональних Ig
Трансплантація нирки
Іноді пацієнти з асоційованою з мієломою нирковою недостатністю досягають стійкої ремісії мієломи, але залишаються залежними від діалізу, і, отже, передбачається трансплантація нирки. Ризики трансплантації нирки у цієї популяції включають рецидивуючу мієлому (можливо, більш вірогідну внаслідок ефектів імуносупресії), моноклональну Ig-опосередковану дисфункцію трансплантата та інфекцію. Повідомлялося про ранню важку дисфункцію алотрансплантата в результаті моноклонального Ig некротизуючого GN, і частіше спостерігаються більш підгострі форми погіршення трансплантата у пацієнтів, чия рідна хвороба нирок була MIDD (96,97). Якщо початковим ураженням була литяна нефропатія, ризик рецидиву трансплантата нирки здається низьким, якщо мієлома залишається в стадії ремісії (98). Нещодавно Naina та співавт. (99) вивчав результати реципієнтів з трансплантованою ниркою та MGUS; У 2 з 23 пацієнтів з передтрансплантаційним MGUS розвинулася тліюча мієлома, а у 2 пацієнтів - інша лімфопроліферативна хвороба після трансплантації протягом середнього спостереження 8,5 років. Жоден з пацієнтів, у яких розвинувся MGUS після трансплантації, не розвинув мієлому, але у 2 пацієнтів розвинулася лімфопроліферативна хвороба після трансплантації через десятиліття після трансплантації (99).
Для того, щоб пацієнта з мієломою можна було розглядати для трансплантації нирки, більшість центрів вимагають, щоб пацієнти перебували у стадії ремісії без лікування протягом щонайменше 3-5 років. Іноді пацієнти з MIDD або амілоїдом можуть бути кандидатами на трансплантацію нирки після досягнення повної гематологічної відповіді, незалежно від того, чи проводили SCT (100). Опублікованої інформації про тліючу мієлому мало, хоча більшість центрів неохоче продовжують. Трансплантація може тривати для більшості пацієнтів з MGUS, якщо причина ниркової недостатності не пов’язана з MGUS, а рівень моноклональних Ig стабільний і низький. Консультації щодо попередньої трансплантації повинні враховувати ризик, який здається низьким, що пригнічення імунодефіциту прискорить передзлоякісний стан (98). Лікування парапротеїнової хвороби після трансплантації виходить за рамки цієї статті, але як бортезоміб, так і леналідомід успішно використовуються.
Висновок
Нефротоксичний моноклональний Ig може спричинити пошкодження нирок завдяки надзвичайно різноманітному набору механізмів, і тому нефрологи та інші клініцисти повинні мати низький поріг для тестування відповідних пацієнтів на парапротеїни. Може бути показано більш широке використання біопсії нирок для виявлення моноклональних Ig-опосередкованих захворювань нирок, оскільки терапевтичні можливості при парапротеїнових захворюваннях покращились. Аналіз FLC на сироватці крові є чутливим біомаркером, корисним як допоміжний діагностичний інструмент для моніторингу реакції на терапію багатьох парапротеїнових захворювань. Бортезоміб, леналідомід та талідомід ефективніше націлюються на плазматичні клітини та їх мікросередовище та представляють захоплюючі терапевтичні досягнення в цій галузі. Аутологічна SCT асоціюється із підвищеним ризиком у пацієнтів із розвиненою нирковою недостатністю, і, отже, її застосування обмежене. Незважаючи на те, що ентузіазм зменшився щодо використання плазмообміну для лікування парапротеїнових АКІ, нові діалізатори, що очищають легкі ланцюги, виявляють перспективу в цьому плані в поєднанні з ефективною хіміотерапією. Трансплантація нирки пацієнтам із малігнізацією плазматичних клітин, як правило, протипоказана, хоча рідкісний пацієнт, який пережив тривалу ремісію та має стабільний рівень легкого ланцюга, може відповідати.
Розкриття інформації
E.C.H., H.R. та J.L. не розкривають інформації. P.G.R. працює в консультативних комітетах з питань тисячоліття, Celgene та Johnson & Johnson та отримує фінансування на дослідження від Millennium та Celgene.
Подяка
Автори з вдячністю висловлюють адміністративну підтримку Мішель Мальйо у підготовці цього рукопису.
Цю роботу частково підтримав Фонд досліджень множинної мієломи Ріка Кормана.
- Добавки до здоров’я для собак із захворюваннями нирок
- Невропатія IgA (хвороба Бергера) Причини, симптоми та лікування - Американський нирковий фонд (АКФ)
- Препарат від печії, пов’язаний із ризиком захворювання нирок 5 продуктів, які можуть природно нейтралізувати шлункову кислоту
- Захворювання нирок на пізніх стадіях, що знижують кількість уратів, не пропонують допомоги MedPage сьогодні
- Рис з низьким вмістом білка медичний рис при хронічній хворобі нирок - ScienceDirect