Заблокований тубуліном стан VDAC вивчали шляхом розділення полімерів та АТФ
Пов’язані дані
Анотація
Нещодавно повідомлене про функціональну взаємодію між залежним від напруги аніонним каналом зовнішньої мітохондріальної мембрани, VDAC та димерним тубуліном спостерігається як оборотна блокада каналу. Використовуючи розподіл полі- (етиленгліколю) з різними молекулярними вагами та вимірювання потенціалу реверсування, ми досліджуємо розмір та іонну селективність повністю відкритих та блокованих тубуліном станів VDAC, відновлених у плоскі ліпідні бішари. У той час як ефективний радіус каналу зменшується лише в 1,34 ± 0,15 рази, селективність змінюється від початково аніонної до катіонної. Безпосередньо вимірюючи розподіл АТФ, ми демонструємо, що ці зміни забороняють АТФ проникати в канал у заблокованому тубуліном стані.
1. Вступ
Нещодавно було виявлено, що один з найпоширеніших білків у цитозолі більшості еукаріотичних клітин, димерний тубулін, є потужним інгібітором залежного від напруги аніонного каналу зовнішньої мітохондріальної мембрани VDAC [1, 2]. Взаємодія тубулін-VDAC розглядається як оборотні переходи каналу, відновленого в плоскі ліпідні мембрани, між його відкритим та блокованим тубуліном станами. Інгібування є високочутливим до напруги, і, залежно від потенціалу зовнішньої мембрани мітохондрій, може знадобитися концентрація тубуліну від мікромолярних до наномолярних. Експерименти з ізольованими мітохондріями свідчать про те, що взаємодія VDAC і тубуліну є функціонально важливим для регуляції дихання мітохондрій [2, 3]. Блокований стан тубуліну все ще є високопровідним іоном (близько 40% провідності відкритого стану в 1 М KCl), що може означати, що інгібування VDAC тубуліном обмежується величиною цієї залишкової провідності. Однак вважається, що головна роль VDAC - регуляція обміну АТФ/АДФ [4-6], а не потік малих іонів, тож справді важливим є ефект блокування тубуліну на транспорт нуклеотидів.
Існує довгий перелік різних сполук, що впливають на регулювання напруги VDAC (див. [4, 5, 7]), де такі поліаніони, як поліаніон Кеніга та декстрансульфат, є найпотужнішими інгібіторами VDAC [8, 9]. Зокрема, було показано, що поліаніон Кеніга інгібує транспорт нуклеотидів аденіну в ізольованих мітохондріях [8] та клітинах [10]. Однак регуляторна дія тубуліну була визнана зовсім недавно [2, 11]. Щоб зрозуміти функціональне значення взаємодії VDAC-тубулін, ми досліджуємо основні біофізичні властивості блокованого тубуліном стану.
У цьому дослідженні ми застосовуємо три підходи для оцінки функціональних особливостей блокованого стану. Спочатку ми оцінюємо зміну характерного радіуса VDAC при його закупорюванні тубуліном за допомогою полімерного розподілу в канал [12, 13] в обох станах. Вичерпний список посилань щодо цього підходу можна знайти в недавній публікації нашої лабораторії [14]. Суть підходу полягає в аналізі проникнення різного розміру полі (етиленгліколю), ПЕГ, в канал, заповнений водою, шляхом вимірювання його провідності у присутності цих полімерів. Провідність каналу по-різному реагує на ПЕГ з різною молекулярною масою, при цьому полімери є досить малими для розподілу в порі, зменшуючи свою провідність залежно від ваги. Виходячи з характерної молекулярної маси полімеру, який відокремлює розділення від виключення, ми робимо висновок, що ефективна площа поперечного перерізу каналу зменшується в два рази в результаті закупорки.
По-друге, ми аналізуємо індуковану блокадою зміну селективності малих іонів в каналі при концентраціях солей, близьких до фізіологічних. Ми показуємо, що селективність каналу змінює свій знак: від переважно аніонної селективності у відкритому стані він переходить до катіонної селективності в блокованому тубуліном.
По-третє, ми оцінюємо розподіл АТФ як у відкритий, так і в заблокований тубуліном канал. Ми виявили, що, перебуваючи у відкритому стані, додавання АТФ зменшує провідність каналу, але це не змінює провідності блокованого тубуліном стану. Ми прийшли до висновку, що АТФ електростатично і, принаймні частково стерично, виключається із заблокованого тубуліном стану VDAC.
2. Матеріали та методи
Процедура відновлення VDAC у ліпідні бішари була описана раніше [2, 15]. Двошарові шари формували з дифітаноїлфосфатидилхоліну (Avanti Polar Lipids, Inc. Alabaster, AL). Якщо не зазначено інше, використовували 1 М водних розчинів KCl, забуференних 5 мМ Hepes при рН 7,4. Потенціал визначається як позитивний, коли він більший на стороні додавання VDAC (цис-сторона). Після введення каналів VDAC тубулін додавали по обидва боки мембрани при постійному перемішуванні протягом 2 хв. Послідовно додавали полі (етиленгліколь) різних молекулярних ваг (Sigma) до кінцевої концентрації 15% (мас./Мас.). Розчин АТФ (Sigma) в 1 М KCl і рН, відрегульований до 7,4, вводили в відсіки камери шляхом перфузії. Струми реєстрували та аналізували, як описано раніше [2] (див. Також Додатковий матеріал).
3. Результати та обговорення
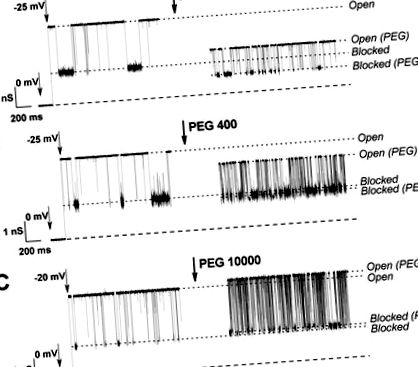
Вплив ПЕГ трьох різних молекулярних ваг на відкриті та блоковані тубуліном стани VDAC показано на малюнку 1. У присутності ПЕГ 106 (рис. 1А) провідність обох станів зменшується додаванням полімеру. Це пов’язано з розподілом полімеру в порі каналу, який витісняє іони та збільшує в’язкість розчину (рис. 1, пунктирними лініями Відкрити та Відкрити (ПЕГ)). Провідність блокованого тубуліном стану також помітно знижується у присутності PEG 106, але значно меншою мірою на PEG 400 (рис. 1A, B, пунктирними лініями Blocked and Blocked (PEG)), що свідчить про те, що це занадто звужуються для молекул ПЕГ 400 до значного розподілу. У випадку ПЕГ 10000 (рис. 1С), відкритий та блокований тубуліном стани демонструють деяке збільшення провідності, що означає, що цей полімер ефективно виключається з обох станів каналу. Також варто відзначити, що ПЕГ посилює взаємодію між тубуліном та VDAC, що призводить до більш частих подій блокування.
Сліди іонного струму через окремі канали VDAC у присутності 10 нМ тубуліну, зміненого додаванням ПЕГ 106, ПЕГ 400 та ПЕГ 10000. Ліві сліди: блокування каналів тубуліном у безполімерному розчині; правильні сліди: вплив додавання ПЕГ на провідні стани каналу. Мембранно-купальний розчин містить 1 М KCl з 5 мМ HEPES, рН 7,4. Штрихові лінії внизу означають нульовий струм. Записи були відфільтровані цифровим способом на частоті 1 кГц з використанням алгоритму Бесселя.
На малюнку 2 підсумовано експерименти з розділення полімерів, інтерпольованих до нульової напруги. Як у відкритому, так і в блокованому тубуліном станах коефіцієнт збільшується із значення, близького до відношення провідності розчину, яке змінюється додаванням полімеру (перервана пряма лінія приблизно 0,6), до значення, яке трохи перевищує 1,0. Точки даних для блокованого тубуліном стану зсуваються вліво в напрямку менших молекулярних ваг полімеру. Це говорить про те, що характерний розмір блокованого стану менший, оскільки він здатний ефективніше виключати полімери.
Відносні зміни провідності VDAC, викликані додаванням 15% (мас./Мас.) ПЕГ різної молекулярної маси. Відношення провідності каналу в присутності певного ПЕГ до його провідності в безполімерному розчині будується як функція молекулярної маси ПЕГ. Трикутники та кола відповідають відкритому та блокованому тубуліном станам VDAC відповідно. Пунктирна лінія в 0,6 відповідає співвідношенню провідності основного розчину з полімерами та без них. Суцільні лінії на основі експериментальних даних представляють найкращі результати за допомогою рівняння. (1).
Для кількісної оцінки розділення ми використовуємо підхід [13], досить детально викладений у недавній публікації [14]. Ми застосовуємо таку емпіричну формулу, щоб відповідати даним:
де g (w)/gnoPEG - відношення провідності каналу в присутності ПЕГ з молекулярною масою w до його провідності в безполімерному розчині, а χ - параметр, що характеризує відносну амплітуду зміни провідності каналу між режими повного виключення, g (w) max та повного проникнення, g (w) min:
Вибравши g (w) max/gno PEG = 1,07 та g (w) min/gno PEG = 0,54, щоб врахувати поведінку провідності при найвищій і найнижчій молекулярній масі полімеру, ми підходимо для рівняння. (1) до експериментальних даних для отримання характерної маси полімеру w0, яка розділяє режими проникнення та виключення полімеру, та параметра α, що характеризує різкість переходу між двома режимами.
Вважається, що регуляція потоків АТФ/АДФ є основною функцією VDAC [4, 5]. Оскільки при фізіологічних концентраціях солі АТФ є багатозарядним аніоном, важливо характеризувати іонну селективність блокованого стану VDAC в умовах солі, близьких до таких, що є фізіологічно важливими. Тут ми використовували градієнт KCl 150 мМ проти 50 мМ для визначення потенціалів розвороту відкритого та заблокованого станів каналу (рис. 3). Як і очікувалося, напруги, що відповідають нульовому струму при цьому градієнті концентрації KCl, так звані потенціали розвороту, різні для відкритого та блокованого тубуліном станів. Вони, відповідно, становлять 15,5 мВ і -13,7 мВ, тобто селективність каналу змінюється від t + = 0,2, t - = 0,8 (де t + і t - катіонні та аніонні транспортні числа, див. Додатковий матеріал) у відкритому стані сприятливих аніонів до t + = 0,75, t - = 0,25 в блокованому тубуліном стані, що сприяє катіонам.
Співвідношення струм-напруга для одного каналу у відкритому (трикутники) та заблокованому тубуліном (кола) станах у мембрані, що розділяє 150 мМ (цис) та 50 мМ (транс) розчини KCl (2 мМ HEPES, pH 7,4). Блокування VDAC тубуліном перетворює початкову аніонну селективність каналу на катіонну, про що свідчить зміна знака потенціалу розвороту.
Згідно із запропонованою моделлю [1, 2], блокування VDAC тубуліном трактується як проникнення одного з негативно заряджених С-кінцевих хвостів (CTT) тубуліну в чисту позитивну пору VDAC. Експериментальні докази, що підтверджують цю модель, полягають у тому, що тубулін із усіченим CTT не блокує VDAC [2]. Негативно заряджений хвіст зміщує баланс зарядів у порі VDAC у бік чистого негативного заряду, що пояснює незначну катіонну селективність блокованого тубуліном стану. Слід зазначити, що такий зворот селективності аналогічний такому, що спостерігається при переході каналу у напружені замкнені стани [9, 21], але, подібно до провідності, чітко визначений і не демонструє мінливості, властивої напрузі штатів. Порівняння цих властивостей напружених індукованих замкнутих станів та блокованого тубуліном стану сприяє використанню моделі блоку проникнення КТТ порівняно з посиленою напругою струму тубуліну.
Основна маса останніх досліджень „широких” каналів (див. [22-24] та посилання на них) демонструє, що їх іонна селективність здебільшого має електростатичне походження. Отже, зміна селективності каналу повинна бути набагато виразнішою для багатозарядного АТФ, ніж для однозарядного хлоридного аніона. Беручи до уваги додаткову стеричну перешкоду в заблокованому стані, наші результати свідчать про те, що заблокований тубуліном стан повинен бути практично непроникним для АТФ.
Для підтвердження цього твердження ми виконали прямі вимірювання розподілу ATP на VDAC, слідуючи підходу, описаному раніше [15, 25]. Було показано, що АТФ, доданий до розчину для купання мембрани 1 М NaCl, знижує його питому провідність, але через зв’язування АТФ з порою VDAC він зменшує провідність каналу більшою мірою [15]. Щоб перевірити, чи це було б так із заблокованим станом тубуліну, ми виміряли провідність каналу у присутності як тубуліну, так і АТФ. Результати, показані на малюнку 4, демонструють, що вимірюване зменшення провідності спостерігається лише для відкритого стану каналу. Ефект дещо менший, ніж раніше повідомлялося про VDAC іншого походження (Neurospora crassa) [15], але якісно узгоджується з попередніми висновками. Симетричне додавання 100 мМ АТФ зменшує провідність каналу у відкритому стані приблизно на 10%, але, в межах точності наших вимірювань, не змінює провідності блокованого тубуліном стану. Це свідчить про те, що АТФ виключається із заблокованого стану, що підтверджує наші аргументи, засновані на зміні радіусу каналу та малоіонної селективності.
Вплив додавання 100 мМ АТФ на провідність VDAC у відкритих і блокованих тубуліном станах. Три верхні групи точок даних показують, що додавання АТФ зменшує провідність відкритого стану за рахунок розподілу АТФ в канал [15, 25]. Три нижчі групи точок даних демонструють, що ATP-блокований стан тубуліну не впливає, що свідчить про те, що цей стан непроникний для ATP.
4. Висновки
Ми виявили, що блокування VDAC тубуліном зменшує його діафрагму приблизно в два рази, як визначають ПЕГ різного розміру (рис. (Рис. 1 1 та та 2). 2). Ще важливіше те, що блокада перетворює аніонну селективність каналу для малих однозарядних іонів на катіонну (рис. 3). Для багатозарядженої та об’ємнішої молекули АТФ пряма оцінка його впливу на провідність каналу в двох станах (рис. 4) показує, що в межах точності наших вимірювань АТФ не розподіляється в заблокований стан. У сукупності ці аргументи дозволяють зробити висновок, що блокований тубуліном стан VDAC практично непроникний для АТФ.
Додатковий матеріал
Подяка
Автори дякують Келі Шелдон за очищення VDAC. Це дослідження було підтримано Програмою внутрішньошкільних досліджень Національного інституту здоров’я дітей та розвитку людини Юніс Кеннеді Шрайвер, NIH.
Список скорочень
| VDAC | залежний від напруги аніонний канал |
| ПЕГ | полі- (етиленгліколь) |
Виноски
Заява видавця: Це PDF-файл нередагованого рукопису, який прийнято до друку. Як послуга для наших клієнтів ми надаємо цю ранню версію рукопису. Рукопис пройде копіювання, набір версій та перегляд отриманого доказу, перш ніж він буде опублікований у остаточній формі. Зверніть увагу, що під час виробничого процесу можуть бути виявлені помилки, які можуть вплинути на вміст, і всі юридичні застереження, що стосуються журналу, стосуються.
- Цільова програма навчання - Рада державних закупівель наступного покоління
- Єврейські архіви штату Вашингтон - цифрова колекція
- Стан продовольчої безпеки та харчування у світі 2020 - ДАНІ ЮНІСЕФ
- Обрізка запасної шини Олія каноли може скоротити жир на животі Пенсільського університету
- Лекція доктора Бутейко в Московському державному університеті 1969 р. (Книга PDF)