Вплив неперетравлюваних вуглеводів ячменю на обмін глюкози, апетит та добровільне споживання їжі протягом 16 год у здорових дорослих
Анотація
Передумови
Останні знання про тварин дозволяють припустити, що мікробний метаболізм кишечника може впливати на метаболізм господаря, включаючи гормони, що регулюють апетит. Метою цього дослідження було оцінити потенційний вплив цільнозернового зерна ячмінного продукту, багатого власними неперетравлюваними вуглеводами (харчовими волокнами та стійким крохмалем), на маркери метаболізму та регулювання апетиту у здорових осіб.
Методи
Варені ядерці ячменю (БК) або білий пшеничний хліб (WWB; посилання) отримували як пізній вечірній обід для 19 молодих людей у випадковому порядку, використовуючи перехресний дизайн. Під час наступних стандартних страв на сніданок та обід (10,5-16 год) забирали кров для аналізу глюкози, плазмового інсуліну, адипонектину, греліну, глюкозозалежного інсулінотропного поліпептиду (GIP) та глюкагоноподібного пептиду-1 (GLP-1 ), вільних від сироватки жирних кислот (FFA) та інтерлейкіну (IL) -6. Крім того, визначали відчуття апетиту, довільне споживання енергії та дихання H2.
Результати
BK як вечірня їжа підвищувала плазмовий GLP-1 натще (P
Передумови
Метаболічний синдром (MetS) являє собою сукупність факторів ризику, що ідентифікують суб’єктів із високим ризиком розвитку діабету 2 типу (T2D) та серцево-судинних захворювань [1]. Поширеність ожиріння та T2D зростає у всьому світі, і за оцінками Всесвітньої організації охорони здоров’я в 2012 році кількість людей, які страждають на T2D, у всьому світі становитиме 347 мільйонів, а кількість смертей від діабету зросте на дві третини в період з 2008 по 2030 рік [2]. . Таким чином, необхідність у профілактичних стратегіях є нагальною.
Метою даної роботи було оцінити вплив власних неперетравлюваних вуглеводів у відварених ядрах ячменю (БК), що споживаються ввечері, на глікемію, відчуття апетиту, регулюючі апетит гормони та добровільне споживання їжі, натщесерце та в постпрандіальній фазі після двох послідовне харчування (сніданок і обід). Змінні, визначені в крові, були глюкозою, інсуліном, GLP-1, глюкозозалежним інсулінотропним поліпептидом (GIP), греліном, вільними жирними кислотами (FFA), адипонектином та інтерлейкіном (IL) -6. Крім того, визначали екскрецію водню (H2) з диханням як маркер ферментації товстої кишки. Харчування на сніданок та обід здійснювалось за бажанням, дозволяючи оцінити вплив на ніч на метаболізм та регуляцію апетиту в реальній харчовій ситуації. З цією метою вуглеводні еквівалентні страви, що складаються з вареного БК або білого пшеничного хліба (WWB, еталонний прийом їжі), пропонувались як вечеря здоровим суб’єктам із використанням рандомізованого перехресного дизайну.
Матеріали і методи
Предмети
У дослідженні взяли участь 19 здорових добровольців, 6 чоловіків та 13 жінок у віці 24,2 ± 1,9 року з нормальними показниками маси тіла (ІМТ) (середнє значення ± SD = 22,3 ± 2,0 кг/м 2). Критеріями включення були вік від 20 до 35 років, ІМТ від 18 до 25 кг/м 2, некурящий і відсутність відомих метаболічних порушень або харчової алергії. Схвалення дослідження було надано Регіональною комісією з етичного огляду в Лунді, Швеція (Довідка 668/2008).
Вечірня контрольна та контрольна їжа
Їжа для тестування та порівняння була заснована на 50 г потенційно доступного крохмалю.
BK, пробна їжа; Одну порцію (96,8 г) злегка відполірованих сухих ядер ячменю (Finax, Хельсінгборг, Швеція) кип'ятили протягом 20 хв у 150 мл води, що містить 0,25 г NaCl. Вся вода вбиралася в ядра. БК мав вигляд аналога рису і споживався з 250–300 мл води.
WWB, еталонне харчування; WWB випікали за стандартизованою процедурою в домашній випічці (модель Severin № BM 3983; вибір меню, програма 2 [білий хліб, 1000 г, швидкий (час2: 35)]). Хліб виготовляли з 540 г білого пшеничного борошна (Kungsörnen AB, Ярна, Швеція), 360 г води, 4,8 г сухих дріжджів, 4,8 г NaCl. Після охолодження кору видаляли, хліб нарізали, а порції (119,7 г хліба) загортали в алюмінієву фольгу, клали в поліетиленові пакети і зберігали в морозильній камері (-20 ° C). У день споживання випробовуваним було наказано розморожувати хліб при температурі навколишнього середовища, все ще обмотаний алюмінієвою фольгою та у поліетиленовий пакет. WWB споживали з 250–300 мл води.
Ad libitum сніданок та ad libitum обід
Сніданок складався з комерційного хліба з білого пшениці з низьким вмістом клітковини (долар Сторфранська, Локарп, Мальме, Швеція), вершкового масла (BreGott, Arla Foods, Стокгольм, Швеція) та шинки. Бутерброди нарізали невеликими шматочками (6,5 × 6,5 см), подавали їх як подвійні бутерброди цілими або різали по діагоналі. Випробовувані мали вільно вибирати кількість споживаної їжі. Сніданок подавали з 300 мл води.
Обід складався зі шведського хашу, тобто смаженої суміші нарізаної кубиками картоплі, м’яса та цибулі (Felix Krögarpytt, Procordia Food AB, Eslöv, Швеція). Якщо кетчуп (Felix, Procordia Food AB, Eslöv, Швеція) було обрано для вживання з хешем, випробовувані були зобов’язані підтримувати кількість кетчупу в обох обідніх ситуаціях. До обіду подавали воду (250 мл).
Вивчати дизайн
Дизайн був рандомізований перехресний. BK та WWB були включені як пізній вечірній обід (21:30), розділений приблизно на 1 тиждень. Кожен вечірній прийом їжі вживався двічі, це означає, що випробовуваний брав участь чотири окремі випадки. Вимірювання натощак проводили під час усіх чотирьох відвідувань, а вимірювання після їжі проводили під час двох відвідувань (обраних випадковим чином), одного відвідування після БК та WWB відповідно. У дні вимірювання після їжі випробовуваним забезпечувалося споживання сніданку та обіду в режимі лібіту, а протягом експериментального дня неодноразово вимірювали змінні фізіологічних тестів. Глюкоза в крові, подих H2, візуальна аналогова шкала (VAS) оцінюють суб’єктивний апетит (голод, ситість і бажання їсти) та зразки для вимірювання інсуліну, активного греліну, загального GIP та активного GLP-1 були отримані натще і 15, 30, 45, 60, 90, 120, 180, 210, 225, 240, 255, 270, 300 та 330 хвилин після початку сніданку. Зразки для IL-6 та адипонектину відбирали через 0, 60, 120, 210, 270 та 330 хвилин, а вимірювання FFA проводили у часи 0 та 210 хв.
Процедура
Аналіз складу поживних речовин у вечері, сніданку та обіді
Тестова та еталонна їжа аналізувались щодо загального крохмалю [30], наявного крохмалю [31], RS [32] та DF [33]. Інформація щодо вмісту крохмалю та ДФ у вечірніх випробувальних та еталонних стравах наведена в Таблиці 1. До аналізу загального та наявного крохмалю та ДФ продукти сушили та розмелювали на повітрі. РС аналізували на продуктах, які їли. Доступний крохмаль у шроті BK обчислювали шляхом віднімання РС із загального крохмалю, тоді як потенційно доступний вміст крохмалю в еталонному WWB та комерційному хлібі для сніданку з білої пшениці аналізували згідно Holm та ін. ін[31].
Харчовий склад страв для сніданку та обіду наведено в Таблиці 2. Перед аналізом бутерброди для сніданку готували як з’їдені, а потім нарізали невеликими шматочками та сушили заморожуванням. Обід (хеш) готували відповідно до інструкцій, а потім змішували з додаванням води в пасту з подальшою сушкою заморожуванням. Ліофілізовані зразки подрібнювали в ступці перед аналізом. Зразки аналізували на вуглеводи (наявний крохмаль) [31], білки та жири. Вміст сирого білка визначали за допомогою елементарного аналізатора (FlashEA 1112, Thermo Fisher Scientific Inc, Waltham, MA, USA). Вміст жиру вимірювали гравіметрично методом Шміда-Бондзинського-Рацлаффа (SBR).
Аналіз фізіологічних змінних
Для визначення рівня глюкози в крові брали зразки капілярної крові, уколені пальцями (HemoCue®B-глюкоза, HemoCue AB, Енгельхольм, Швеція). Венозну кров збирали для вимірювання сироватки (FFA) та s-IL-6 та плазми (p) адипонектину, p-інсуліну, p-греліну, p-GIP та p-GLP-1.
Аналізи Milliplex ™ MAP (HMH-34K Milliplex ™ MAP, Millipore, Сент-Чарльз, США) проводили для одночасного вимірювання інсуліну, активного греліну, загального GIP та активного GLP-1. Збірки для збору крові для аналізу за допомогою Milliplex ™ MAP додавали з інгібіторним коктейлем, що складається з DPPIV-інгібітора (10 мкл/мл крові) (Millipore, Сент-Чарльз, США) та Pefablock SC (1 мг/мл крові) (Roche Diagnostics, Mannheim, Німеччина) до забору крові. Пробірки, що містять гальмівний коктейль, витримували в холоді протягом максимум 6 днів до забору крові. Після забору крові пробірки, призначені для аналізів Milliplex ™ MAP, центрифугували протягом 30 хвилин при 1000 × g протягом 10 хвилин при 4 ° C. Плазму видаляли і негайно зберігали (-20 ° C) у пробірках Еппендорфа до аналізу. Зразки крові аналізували за допомогою імуноаналізів на поверхні флуоресцентно мічених мікросферних гранул і зчитували на приладі Luminex 200 (Luminex Corporation, США). Для оцінки результатів був використаний Milliplex ™ Analyst v.3.4 (VigeneTech Inc., Carlisle, USA).
Плазмі та сироватці для аналізу FFA, IL-6 та адипонектину давали згортатися при температурі навколишнього середовища (сироватка) або витримували на льоду та центрифугували протягом 30 хвилин (плазма). Зразки відокремлювали (3500 об/хв протягом 10 хв при 4 ° C) і зберігали у морозильній камері (-20 ° C) до аналізу. Концентрації FFA визначали ферментативним колориметричним методом (NEFA C, метод ACS-ACOD, WAKO Chemicals GMbH, Німеччина). IL-6 визначали за допомогою високочутливого твердофазного імунологічного аналізу (R&D Systems Inc, Міннеаполіс, США). Концентрації адипонектину вимірювали за допомогою твердофазного набору для імуноферментного аналізу на двох ділянках (Mercodia Adiponectin ELISA, Mercodia, Уппсала, Швеція). Водень у повітрі, що видихається, вимірювали як показник бродіння товстої кишки за допомогою EC 60 або Gastro + (Газолізер Bedfont EC60, Рочестер, Англія).
Розрахунки та статистичні методи
Результати
Дихання H2
Екскреція Н-дихання H2 (P Таблиця 3 Фізіологічні реакції, дихання H 2 та оцінки суб’єктивного апетиту натщесерце, 10,5 год після вечірнього тестового або контрольного прийому їжі 1
Дихання H 2 виведення протягом експериментальної доби. Середня екскреція H2 після їжі через 10,5-16 год після прийому вечері відповідно до BK або WWB. Значення є середніми ± SEM. Пунктирними лініями на осях y вказується середньозважене значення, розраховане для WWB (8,8 ppm) та BK (31 ppm), відповідно. BK, ядерне ядро; Н2, дихальний водень; WWB, білий пшеничний хліб.
Добровільне споживання енергії під час сніданку та обіду
Споживання енергії за бажанням під час сніданку становило 400 ккал та 415 ккал відповідно до вечірнього прийому їжі відповідно до норми BK та WWB, без суттєвої різниці залежно від попередньої вечері (таблиця 4). При прийомі BK як пізнього вечірнього прийому їжі випробувані значно зменшили споживання енергії в обід на 12% порівняно з споживанням енергії в обід після вечірнього прийому їжі WWBЗначення Р 2 було вище після сніданку після вечірньої трапези з БК (P Малюнок 2
Додаткова відповідь глюкози в крові та плазми крові на інсулін. Середній приріст глюкози в крові (A) та інсулін у плазмі крові (B) змінюється (Δ) від концентрації натщесерця після вечері відповідно з BK або WWB. Значення є середніми ± SEM. BK, ядерне ядро; WWB, білий пшеничний хліб.
Вечеря BK генерувала нижчі концентрації циркулюючого f-FFA порівняно з WWB (P ⋅ хв/л) порівняно з після вечері WWB (10,7 ± 0,9 пг ⋅ хв/л) (P Малюнок 3
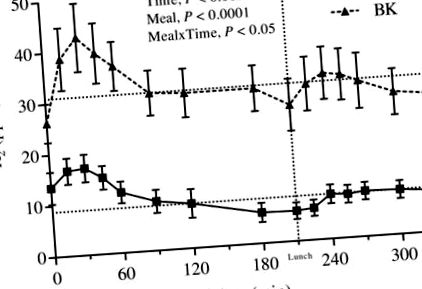
Відповідь GLP-1. Середня концентрація GLP-1 у плазмі крові протягом експериментального дня після вечері відповідно з BK або WWB. Значення є середніми ± SEM. BK, ядерне ядро; GLP-1, глюкагоноподібний пептид-1; WWB, білий пшеничний хліб.
Реакція Греліна після сніданку. Середня концентрація греліну в плазмі після прийому вечері відповідно до BK або WWB. Значення є середніми ± SEM. BK, ядерне ядро; WWB, білий пшеничний хліб.
Запальні змінні
Спостерігалася тенденція до зниження концентрації f-IL-6 після вечірнього прийому їжі (P = 0,06) (таблиця 3). Концентрація IL-6 після їжі показана на малюнку 5. Не було значущих відмінностей у стані адипонектину натще, залежно від попереднього вечірнього прийому їжі. Однак менш виражене зниження концентрації адипонектину в плазмі крові від стану натще (0–330 хв) спостерігалося після БК як вечірнього прийому їжі (-1,4%) порівняно з післявечірньою їжею Світового балансу (-7,9%) (P Малюнок 5
Інкрементальні зміни адипонектину та відповідь IL-6. Середній приріст адипонектину в плазмі (A) зміни (Δ) та середньої концентрації сироваткового ІЛ-6 (B) під час експериментального дня після вечері відповідно до BK або WWB. Значення є середніми ± SEM. BK, ядерне ядро; ІЛ-6, інтерлейкін-6; WWB, білий пшеничний хліб.
Суб’єктивні оцінки апетиту
Результати після їжі для оцінки суб’єктивного апетиту представлені на малюнку 6 та в таблиці 4. Не було виміряно жодних суттєвих відмінностей в суб’єктивних рейтингах апетиту в стані голодування залежно від попереднього вечірнього прийому їжі (таблиця 3). Був нижчий почуття голоду під час сніданку та обіду (AUC 0–330 хв.) після вечірньої їжі BK, порівняно з вечірньою їжею WWB (P Малюнок 6
Постпрандіальні реакції ситості, голоду та бажання їсти. Середні суб’єктивні показники апетиту (VAS) протягом 5,5 год після сніданку та обіду, після вечері відповідно до BK або WWB. Значення є середніми ± SEM. BK, ядерне ядро; WWB, білий пшеничний хліб.
Обговорення
Метою цього дослідження було вивчити метаболічні ефекти власних ферментованих вуглеводів у відварених ядерних ядрах у перспективі на ніч. У порівнянні з попередніми дослідженнями [23, 35], експериментальний дизайн є новим, оскільки період експериментального відбору проб значно подовжується, охоплюючи період від 10,5-16 год після прийому тестового та еталонного вечірнього прийому їжі. Далі дане дослідження мало на меті дослідити вплив вечері на змінні обмінні показники метаболізму, апетит та добровільне споживання енергії після обіднього сніданку та обіду; тобто в більш реалістичній ситуації з харчуванням, ніж дослідження зі стандартизованим розміром їжі.
Висновки
Результати вказують на те, що неперетравлювані вуглеводи, наявні в БК, мають потенціал для полегшення регуляції глюкози у здорових осіб протягом 10,5-16 годин, зменшення запальних маркерів, зниження рівня жирних кислот, зменшення відчуття голоду та зменшення споживання енергії на наступному обіді . Цікаво, що вечірня їжа BK призвела до збільшення вивільнення GLP-1 протягом усього експериментального періоду. Вплив пропонується опосередковувати за допомогою ферментації мікрофлори кишечника, пропонуючи роль мікробіоти кишечника в модуляції метаболізму господаря у людини. Ферментація товстої кишки специфічних неперетравлюваних вуглеводів може забезпечити один із можливих механізмів, за допомогою яких РГ виявилася корисною у профілактиці ожиріння та T2D. Взяті разом, сприятливі ефекти BK підтримують пребіотичний потенціал власних неперетравних вуглеводів у продуктах на основі ядер ячменю.
Внески авторів
ACN, EMÖ та IMEB розробили дослідження; EVJ, ACN, EMÖ та IMEB контролювали та/або проводили дослідження; EVJ аналізував дані та проводив статистичний аналіз; Доповідь написали EVJ, ACN, EMÖ та IMEB; а ACN, EMÖ та IMEB несли основну відповідальність за остаточний зміст. Усі автори прочитали та затвердили остаточний рукопис.
- Вплив екстракту листя рамі на метаболізм глюкози та ліпідів у крові у мишей DBB SpringerLink
- Вплив форми їжі та строків прийому їжі на апетит та споживання енергії у худих молодих людей та
- Відмінні антиоксидантні та протизапальні ефекти флавонолів Журнал сільського господарства та харчування
- Жирна їжа змінює мозок, впливаючи на гомеостаз і обмін речовин; Новини-Медичні
- Вплив анамнезу дієти на енергетичний обмін та фізіологічні параметри у мишей C57BL6J -