Вплив метаболічного середовища на ключових етапах розвитку фолікулів у великої рогатої худоби: фокус на біосинтезі стероїдів
Школа сільського господарства та харчової науки,
Школа сільського господарства та харчової науки,
Школа сільського господарства та харчової науки,
Школа сільського господарства та харчової науки,
Школа сільського господарства та харчової науки,
Школа ветеринарної медицини,
Школа ветеринарної медицини,
Школа медицини та медичних наук, Університетський коледж Дубліна, Белфілд, Дублін;
Школа ветеринарної медицини,
Школа сільського господарства та харчової науки,
Центр досліджень та інновацій тварин та пасовищ, Teagasc, Athenry, Co. Голуей, Ірландія; і
Центр досліджень та інновацій тварин та пасовищ, Teagasc, Athenry, Co. Голуей, Ірландія; і
Школа ветеринарної медицини, Університет Глазго, Глазго, Великобританія
Школа сільського господарства та харчової науки,
Адреса для запитів на передрук та іншої кореспонденції: A.C.O. Еванс, Центр науки про сільське господарство та харчові продукти UCD, Белфілд, Дублін, 4, Ірландія. (електронна пошта: [електронна пошта захищена]).
Анотація
На метаболічне середовище самок можуть впливати як хронічні, так і гострі стресові фактори у критичні моменти репродуктивного циклу і можуть бути шкідливими для репродуктивної функції (7, 17). Наприклад, у м’ясних тварин гостре обмеження дієти зменшило системну концентрацію метаболічних гормонів (інсулін, IGF-I) і призвело до збільшення кількості ноновуляторних фолікулів; крім того, фолікули, які овулювали, мали знижену швидкість росту, максимальний діаметр та секрецію естрадіолу (8, 9, 52, 53). Ця ситуація подібна до спостережуваних метаболічних адаптацій до лактації у ранньому післяпологовому періоді у годуючої молочної корови, коли вони мають подібні метаболічні профілі та мають знижену функцію преовуляторного фолікула, тобто зниження системного естрадіолу, незважаючи на збільшений діаметр овуляційного фолікула (68). Дієтичні маніпуляції для подолання цих метаболічних стресових факторів за рахунок збільшення поживного циркулюючого інсуліну скоротили інтервал від отелення до першої овуляції (32) та збільшили кількість дрібних фолікулів (300 також видалили.
АНОВА
Аналіз шляху винахідливості
qRT-ПЛР
Таблиця 1. Номер доступу, символ гена та назва, що використовуються для генерування прямої та зворотної послідовностей праймерів для аналізу qRT-PCR
Всі праймери використовували при кінцевій концентрації 300 нМ.
Аналіз найбільш підходящої нормалізації qRT-PCR для клітин тека та гранульози проводили за допомогою програми geNorm у програмному забезпеченні Biogazelle qBase plus (http://www.qbaseplus.com; Biogazelle, Гент, Бельгія) (35). В експеримент 1, оптимальний коефіцієнт нормалізації розраховували як середнє геометричне значення DDX39B і UBIQ для клітин тека, тоді як середнє геометричне ДАД1 і UBIQ був рекомендований для гранульозних клітин. Для зразків в експеримент 2, оптимальний коефіцієнт нормалізації розраховували як середнє геометричне значення DDX39B і ACTB для клітин тека, тоді як середнє геометричне ДАД1 і UBIQ був рекомендований для гранульозних клітин. Всі дані про експресію для генів, що нас цікавлять, калібрували нормалізовано, а значення експресії для кожного гена визначали у довільних одиницях.
Статистичний аналіз фізіологічних та qRT-ПЛР вимірювань
Зразки сироватки, плазми та фолікулярної рідини та результати qRT-PCR аналізували із застосуванням систем статистичного аналізу (SAS Institute, Cary, NC). Нормальність та однорідність дисперсії даних визначали за допомогою гістограм, qqplots та процедури UNIVARIATE в SAS. Коли була виявлена неоднорідність дисперсії, дані трансформувались шляхом підняття змінної до рівня лямбда, як визначено за допомогою аналізу трансформації Бокса-Кокса за допомогою процедури TRANSREG в SAS. Тести гіпотез (P значень) проводили, де це було доречно, на трансформованих та нетрансформованих даних. Середні значення найменших квадратів та стандартні помилки відображають аналіз нетрансформованих даних.
В експеримент 1, Вплив на стадію розвитку фолікулів, статус тварини (корова/телиця) та їх взаємодія на аналіти сироватки крові, фолікулярну рідину та відносну експресію генів визначали із застосуванням методики змішаної моделі (PROC MIXED) у SAS. В експеримент 2, Вплив лікування (1,2 М проти 0,4 М) на аналіти плазми, фолікулярну рідину та відносну експресію генів визначали, використовуючи процедуру PROC GLM у SAS. Всі дані про експресію генів для генів, що представляють інтерес, представлені як середні значення ± SE відкаліброваних, нормованих, відносних значень експресії у довільних одиницях. Коефіцієнти кореляції Пірсона серед аналітів крові та значення експресії генів визначали, використовуючи PROC CORR SAS. Коефіцієнти кореляції класифікували як сильні (r> 0,6), помірні (r від 0,4 до 0,6) або слабкі (r
Таблиця 2. Концентрації аналітів (± SE) у сироватці крові, зібраній у день відновлення тканин у годуючих молочних корів та телиць
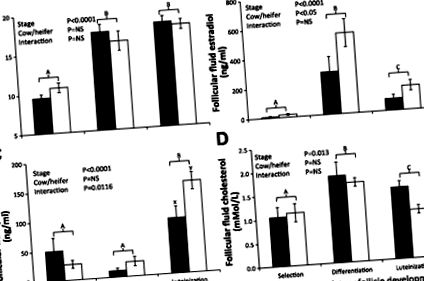
Рис. 1.Середній (± SE) діаметр (A), виміряні після дисекції та концентрації фолікулярної рідини естрадіолу (B), прогестерон (C.) та холестерину (D) для нещодавно відібраного домінантного фолікула (Вибір: корови n = 5, телиці n = 6), диференційований домінантний фолікул (Диференціація: корови n = 7, телиці n = 5), і лютеїнізований домінантний фолікул (лютеїнізація: корови n = 4, телиці n = 6) для корів, що годують (чорні смуги) та телиць (білі бруси). Загальні ефекти лікування наведені в кожній панелі для кожної фолікулярної характеристики із значенням, встановленим на P 0,05.
Часові зміни в експресії генів домінантних фолікулів на різних стадіях фолікулярної хвилі.
Рис.2.Міжгруповий аналіз (BGA) з використанням аналізу відповідності даних RNA-Seq для theca (A) та гранульоза (B) клітини на основі загального профілю транскрипції для нещодавно відібраного домінантного фолікула (SDF), диференційованого домінантного фолікула (DDF) та лютеїнізованого домінантного фолікула (LDF) у телиць та корів, що годують.
Рис.3.Кількість диференційовано експресованих транскриптів (DEG) у клітинах теки та гранульози великої рогатої худоби з домінантних фолікулів, зібраних у молочних телиць (n = 17) та годуючих молочних корів (n = 16) при відборі (корів n = 5, телиці n = 6), Диференціація (корів n = 7, телиці n = 5), і лютеїнізація (корів n = 4, телиці n = 6) стадії розвитку преовуляторного фолікула. Цифри в прямокутниках вказують на кількість ДЕГ під час диференціації (виділення проти диференціації) та лютеїнізації (диференціація проти лютеїнізації) у клітинах теки та гранульози. Цифри в овалах вказують на кількість DEG між телицями та коровами, що годують, на стадії розвитку фолікулів у клітинах теки та гранульози. Стрілки біля цифр вказують напрямок змін (вгору - проти регульованого).
qRT-PCR перевірка даних RNA-Seq.
Для підтвердження було відібрано чотири гени в клітинах гранульози, щоб підтвердити, що фолікули були відновлені на правильних стадіях розвитку домінантного фолікула. Був значний етапний ефект для експресії мРНК стероїдогенних ферментів та рецепторів гонадотропіну (P
Рис.4.Відносні значення виразу для 3BHSD (A), CYP19A1 (B), FSHR (C.), і LHCGR (D) в клітинах гранульозної бички великої рогатої худоби Середні значення (± SE) експресії відкалібровані нормованими значеннями відносної експресії (CNRQ) у довільних одиницях (AU) і наводяться для годуючих молочних корів (суцільні чорні смуги) та телиць (суцільні білі смуги) для нещодавно вибраного домінантного фолікула (вибір: корів n = 5, телиці n = 6), диференційований домінантний фолікул (Диференціація: корови n = 7, телиці n = 5), і лютеїнізований преовуляторний фолікул (лютеїнізація: корови n = 4, телиці n = 6). Загальні ефекти лікування наведені в кожній панелі для кожного гена із значенням, встановленим на P 0,05.
Аналіз шляху.
Таблиця 3. П’ять найкращих канонічних шляхів з найнижчими значеннями P за точним тестом Фішера для шляхів, генерованих IPA, для клітин теки та гранульози телиць та корів, що годують, під час диференціації фолікулів (виділення проти диференціації) та лютеїнізації (диференціація проти лютеїнізації)
Характеристика канонічного шляху біосинтезу стероїдів в експерименті 1.
Враховуючи, що концентрація фолікулярної рідини в стероїдах відрізнялася не тільки між стадіями розвитку фолікулів, але й різнилася між телицями та коровами, які годують груддю, ми вирішили зосередити цей документ на характеристиці відмінностей ключових компонентів біосинтезу стероїдів для виявлення цільових генів у цей шлях, який може бути сприйнятливий до метаболічних впливів. Цікаво, що в клітинах тека у годуючих молочних корів вища експресія в п’ять (SQLE, SC4MOL, SC5DL, EPB, NQO1) гени в процесі біосинтезу стероїдів, ніж телиці при диференціації. Для підтвердження тимчасового та тваринного статусу (корова/телиця) вплив на такі зміни експресії генів qRT-PCR був використаний для перевірки двох генів, для яких зазначена РНК-Seq диференційовано виражалася між коровами та телицями при диференціації (SC4MOL та SQLE), а також перший фермент на шляху (HMGCR), який не відрізнявся між коровами та телицями (рис. 5). Подібно до результатів RNA-Seq, експресія HMGCR, SC4MOL, і SQLE збільшився від відбору до диференціації та зменшився під час переходу від диференціації до лютеїнізації (P
Рис.5.Відносні значення виразу для HMGCR (A), SQLE (B), SC4MOL (C.), і ЗІРКА (D) у клітинах тека бика. Середні значення (± SE) експресії - це значення CNRQ в АС, наведені для годуючих молочних корів (суцільні чорні смуги, n = 16) та телиць (суцільні білі смуги, n = 17) для нещодавно відібраного домінантного фолікула (вибір: корови n = 5, телиці n = 6), диференційований домінантний фолікул (Диференціація: корови n = 7, телиці n = 5), і лютеїнізований преовуляторний фолікул (лютеїнізація: корови n = 4, телиці n = 6). Загальні ефекти лікування наведені в кожній панелі для кожного гена із значенням, встановленим на P 0,05.
Експеримент 2
Метаболічні профілі та характеристики фолікулярної рідини яловичих телиць пропонували 1,2 проти 0,4 М.
Концентрації глюкози, інсуліну та IGF-I у плазмі крові були значно вищими у телиць яловичини, що годували 1,2 М, ніж ті, що пропонували 0,4 М (табл. 4). Телиці, яких годували 1,2 М, також мали тенденцію до вищих концентрацій холестерину в плазмі, ніж ті, що годували 0,4 М (P = 0,084). Телиці, яких годували 0,4 М, мали значно вищі концентрації BHB.
Таблиця 4. Середні значення найменших квадратів для концентрацій аналітів у плазмі, зібраних у день відновлення тканини, та діаметра домінантного фолікула, виміряного після розсічення та концентрації фолікулярної рідини естрадіолу, прогестерону, IGF-I та холестерину для нещодавно вибраного домінантного фолікула для контрольних (1,2 млн.) та обмежених (0,4 млн.) телиць
* Е2, естрадіол; Р4, прогестерон.
Не було різниці в діаметрі фолікула (ранній домінантний фолікул від першої хвилі циклу) між телицями, пропонованими 1,2 М, проти тих, що пропонували 0,4 М. Однак телиці, пропоновані 1,2 М, мали значно вищі концентрації фолікулярної рідини естрадіолу, IGF-I та концентрація холестерину, ніж запропонована 0,4 М. Концентрація фогелярної рідини прогестерону не відрізнялася між групами.
Характеристика канонічного шляху біосинтезу стероїдів у експерименті 2.
В експеримент 2, щоб визначити, чи є зв'язок між ЗІРКА експресія та вироблення естрадіолу залишалися дійсними в іншій моделі порушеного метаболічного стану, qRT-ПЛР проводили на генів-кандидатів у процесі біосинтезу холестерину (HMGCR, SQLE, SC4MOL, ЗІРКА) в клітинах тека, визначених як суттєво різні між годуючими молочними коровами та телицями в експеримент 1. Фолікули телиць, яких годували 1,2 М, мали вищу експресію мРНК SC4MOL (P
Рис.6.Відносні значення виразу для HMGCR, SC4MOL, SQLE, і ЗІРКА у клітинах тека телятини. Середні значення (± SE) виразів - це значення CNRQ в АС, наведені для телиць із пропонованим вмістом 1,2 (М) (чорні смуги, n = 8) та 0,4 М (білі смуги, n = 11).
Рис.7.Схематична модель відбору генів, що беруть участь у біосинтезі холестерину de novo та стероїдогенезі в фоновікулі яєчників бичачого преовулятора (ферменти зображені у прямокутниках). Поглинання позаклітинного холестерину у вигляді ліпопротеїдів високої щільності (ЛПВЩ) та ліпопротеїдів низької щільності (ЛПНЩ) досягається шляхом зв'язування з відповідними рецепторами (ЛПНЩ і SRB1) на мембрані теки, тоді як внутрішньоклітинний холестерин генерується синтез de novo з жирних кислот. Вільний клітинний холестерин транспортується із зовнішньої мітохондріальної мембрани до внутрішньої мітохондріальної мембрани за допомогою StAR. Це обмежуючий швидкість етап утворення естрадіолу в стероїдогенному шляху із залученням ферментів (деякі з яких показані) як у клітинах теки, так і в гранульозі. Активація та інгібування експресії StAR регулюються трофічними гормонами, факторами росту, різними факторами транскрипції та множинними сигнальними шляхами (докладніше див. Текст).
Коефіцієнти кореляції для зв'язку між концентрацією фолікулярної рідини стероїдів та метаболічними ознаками телиць яловичини з генами, що беруть участь у біосинтезі холестерину в клітинах тека великої рогатої худоби, представлені в таблиці 5. Сильні позитивні коефіцієнти кореляції спостерігалися між концентраціями фолікулярної рідини естрадіолу з рівнями експресії мРНК для SQLE і ЗІРКА і помірні коефіцієнти кореляції з рівнями експресії мРНК для HMGCR і SC4MOL. Співвідношення між рівнями експресії мРНК для ЗІРКА а концентрація IGF-I в циркуляції та концентрація фолікулярної рідини холестерину були помірно позитивними. Більше того, рівні експресії мРНК для ЗІРКА як правило, негативно корелювали з концентрацією BHB, що циркулює.
Таблиця 5. Кореляція генів, що беруть участь у біосинтезі холестерину в клітинах тека бика з концентрацією фолікулярної рідини стероїдів та метаболічними ознаками яловичих телиць (n = 19)
Коефіцієнт кореляції жирним шрифтом відрізняється від нуля (P † P * P ** P *** P 1 Інтернет-версія цієї статті містить додаткові матеріали.
- Вплив вегетаріанської дієти на прояв метаболічного синдрому або його компонентів A систематичний
- Вплив тренувань на аеробних вправах з подальшою низькокалорійною дієтою на ризик метаболічного синдрому
- Вплив 8-тижневої дієтичної добавки DHA на мозковий кровотік та метаболічні функції - повний
- Вплив сухорлявої системи 7 на швидкість метаболізму та склад тіла - PubMed
- Вплив харчового стійкого крохмалю на розвиток надмірної ваги, ожиріння та розладів