Вплив фумігації етанолом на побуріння перикарпа, пов’язане з метаболізмом фенолу, якістю зберігання та антиоксидантними системами плодів вампі під час зберігання в холоді
Коледж біологічних наук та медицини, Університет Хайнань, Хайкоу, Китай
Коледж садівництва, Університет Хайнань, Хайкоу, Китай
Коледж садівництва, Університет Хайнань, Хайкоу, Китай
Коледж садівництва, Університет Хайнань, Хайкоу, Китай
Листування
Вень Лі, Коледж садівництва, Університет Хайнань, Хайкоу 570228, Китай.
Ю Донг, кафедра садівництва, Університет штату Орегон, річка Худ, Орегон, США.
Департамент садівництва, Центр досліджень та розширення сільського господарства Середньої Колумбії, Університет штату Орегон, річка Худ, Орегон, США
Листування
Вень Лі, Коледж садівництва, Університет Хайнань, Хайкоу 570228, Китай.
Ю Донг, кафедра садівництва, Університет штату Орегон, річка Худ, Орегон, США.
Коледж біологічних наук та медицини, Університет Хайнань, Хайкоу, Китай
Коледж садівництва, Університет Хайнань, Хайкоу, Китай
Коледж садівництва, Університет Хайнань, Хайкоу, Китай
Коледж садівництва, Університет Хайнань, Хайкоу, Китай
Листування
Вень Лі, Коледж садівництва, Університет Хайнань, Хайкоу 570228, Китай.
Ю Донг, кафедра садівництва, Університет штату Орегон, річка Худ, Орегон, США.
Департамент садівництва, Центр досліджень та розширення сільського господарства Середньої Колумбії, Університет штату Орегон, річка Худ, Орегон, США
Листування
Вень Лі, Коледж садівництва, Університет Хайнань, Хайкоу 570228, Китай.
Ю Донг, кафедра садівництва, Університет штату Орегон, річка Худ, Орегон, США.
Анотація
1. ВСТУП
Вампі (Clausena lansium (Lour.) Skeels) - вид сімейства Rutaceae, широко культивується на півдні Китаю, наприклад, провінції Гуандун, Гуансі, Хайнань та Юньнань (Chen, Zhang, Chen, Han, & Gao, 2017). Він славиться своєю харчовою цінністю, високим вмістом цукру, кислоти та мінеральних елементів, а його листя та насіння роками використовуються в китайській медицині (Li & Xing, 2016). Прасад та ін. (2010) виявили, що шкірка тканини плодів вампі багата кількістю кумаринів, амідів та алкалоїдів карбазолу, які були визначені як антиоксидантна та протипухлинна функція. Однак вампі - це швидкопсувний плід з коротким терміном зберігання. Крім того, проблеми після збору врожаю, включаючи пом’якшення, підрум’янення перикарпа, втрату смаку та зараження хворобами під час зберігання або транспортування, негативно впливають на повернення виробників або галузей.
Зовнішній вигляд плодів визначено важливою ознакою якості плодів. На прийняття рішень споживачами впливає побуріння тканин околоплодника. Причину розвитку побуріння пояснюють утворенням буро-пігменту o‐Хінони, каталізуючи окислення фенольних сполук поліфенол-оксидазою (PPO) (Ioannou, 2013; Queiroz, Mendes-Lopes, Fialho, & Valente-Mesquita, 2008; Singh et al., 2018). Крім того, зниження рівня антиоксидантів (тобто аскорбінової кислоти та флавоноїдів) та антиоксидантних ферментів (тобто супероксиддисмутази, каталази та пероксидази) може бути відповідальним за розвиток побуріння (Ходжес, Лестер, Манро та Тойвонен, 2004; Manzocco, Calligaris, Mastrocola, Nicoli, & Lerici, 2000; Zhang et al., 2015). Отже, розробка стратегій зменшення підрум’янення перикарпа покращить якість плодів плодів вампі.
Метою цієї роботи було по-перше, дослідити вплив етанолу на розвиток підрум’янення перикарпа, метаболізм фенолу та якість зберігання під час зберігання, а потім, по-друге, оцінити роль етанолу в антиоксидантних системах плодів вампі.
2 МАТЕРІАЛИ І МЕТОДИ
2.1 Фруктовий матеріал
Фрукти вампі (Clausena lansium (Лур.) Мотоцикли, рез. ‘Dajixin’) збирали вручну із саду в Хайкоу, Хайнань, Китай (20.02 ° пн.ш., 111.11 ° з.ш., висота 15 м). Плоди були відібрані за однаковим розміром та кольором, без видимих ознак пошкодження чи хвороб. Плоди поміщали в пластикові контейнери з 1-кг поліетиленовими (ПЕ) мішками (товщиною 0,01 мм, XingFeng Co.), а потім транспортували до лабораторії садівництва після збору врожаю Хайнаньського університету протягом 2 годин.
2.2 Лікування
Загалом було обрано 4050 плодів вампі, які були розподілені на п’ять обробок, потім запечатані у пластикові контейнери та піддані дії 100, 300, 500 та 800 мкл/л етанолу протягом 5 годин при 22 ± 0,5 ° C. Контрольний плід піддавали впливу повітря в тих же умовах. Після обробки фрукти упаковували в незапечатані поліетиленові пакети, а потім зберігали при 8 ± 0,5 ° C та відносній вологості повітря 90% у холодильниках (PRX ‐ 350D ‐ DN, Beijing Puxi Electric Appliance Co. Ltd) протягом 12 днів (оскільки 80% плодів втратили свої комерційні властивості при зберіганні протягом 12 днів, ми брали проби до 12-го дня). Через 2, 4, 6, 8, 10 та 12 днів пробу з 135 плодів на обробку кожного разу переносили до 22 ± 0,5 ° C. Сорок п’ять плодів оцінювали за показниками якості та антиоксидантним аналізом, а 90 плодів використовували для оцінки показника підрум’янення перикарпа та оцінки втрат води. Тканину околоплодника після кожного лікування швидко заморожували і перетирали у рідкому азоті, а потім зберігали при -80 ° C.
2.3 Оцінка індексу підрум’янення перикарпа
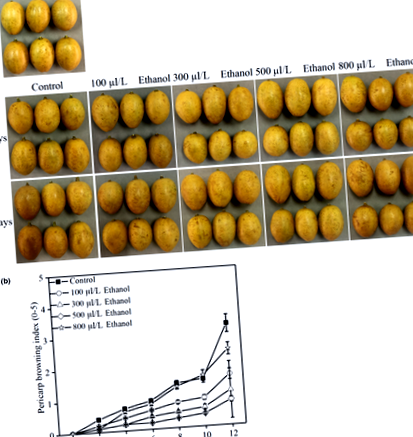
Індекс коричневості перикарпа оцінювали з кожної обробки 30 плодів на повтор і оцінювали шляхом вимірювання розміру загальної зарум'яненої площі на кожному плоді перикарпа. Класифікація була стандартизована за 5-бальною шкалою (Shao, Xie, Chen, & Li, 2013): 1, відсутність підрум’янення перикарпа; 2, 0% –25% площі побуріння перикарпа; 3, 25% –50% площі побуріння перикарпа; 4, 50% –75% площі побуріння перикарпа; 5, 75% –100% площі побуріння перикарпа. Індекс коричневості перикарпа обчислювали як суму кількості плодів у кожній з п’яти категорій за п’ятьма факторами 1, 2, 3, 4 та 5, а ціле ділили на 30 плодів.
2.4 Вимірювання активності поліфенол-оксидази (РРО) та загального вмісту фенолу (ТП)
Активність поліфенолоксидази вимірювали, як описано Luo, Wu, Xie та Chen (2012) з невеликою модифікацією. Два грами тканини околоплодника з 15 попередньо повторних фруктів витягували і гомогенізували в 5 мл 50 ммоль/л натрій-фосфатного буфера (рН 7,8), що містить 0,8 г/л полівінілполіпіролідону (PVPP) і 1 ммоль/л EDTA-Na2. Після центрифугування при 12000 g протягом 30 хв при 4 ° C зразок екстракту (0,1 мл) додавали до 3,0 мл 100 ммоль/л фосфатного натрію (pH 6,4), що містить 50 ммоль/л катехолу. Одну одиницю активності РРО визначали як збільшення поглинання на 0,01 при 420 нм/хв.
Загальну кількість фенолів вимірювали, як описано Habibi and Ramezanian (2017), з невеликою модифікацією. Екстрагували один грам тканини околоплодника з 15 попередніх копій плодів і гомогенізували в 5 мл метанолу, що містить 10 мл/л HCl, протягом 20 хв при 4 ° C у темряві, потім центрифугували при 12000 g при 4 ° C протягом 30 хв. Зразок екстракту (5 мл) розбавляли до кінцевого об'єму 50 мл метанолом, що містить 10 мл/л HCl. Надосадову рідину при 280 нм реєстрували за допомогою спектрофотометра (T6, New Century Inc). Стандартна калібрувальна крива була побудована з використанням галової кислоти, і дані були виражені на основі свіжої ваги у вигляді мг еквіваленту галової кислоти (GAE) кг -1 .
2.5 Оцінка стійкості плодів (FF), вмісту розчинних твердих речовин (SSC) та титруваної кислотності (TA)
Твердість плодів 15 плодів на репліку вимірювали на двох протилежних сторонах екватора кожного плоду після видалення шкірчастих дисків товщиною 2 мм за допомогою ручного вимірювача твердості (FHM-1, Chuk Eatate Co.) з 12-мм конічний зонд. Максимальна сила була записана і виражена в ньютонах (N). Після визначення FF було соком двадцять грамів плодів вампі. SSC визначали за допомогою рефрактометра (N ‐ 1α, Atago Ltd), а дані виражали у відсотках (%). ТА визначали титруванням 5 мл соку і 50 мл дистильованої води плюс три краплі фенолфталеїну до рН 8,3 з 0,1 моль/л NaOH за допомогою рН-метра (ST20, компанія OHOUS) і виражали як еквівалентний відсоток лимонної кислоти.
2.6 Визначення втрати ваги та вмісту малонового диальдегіду (MDA)
Після оцінки показника підрум'янення перикарпа плоди з кожної обробки по 30 плодів на повторність зважували щоразу. Втрата ваги виражалася як відсоток втрати вихідної ваги.
Вміст малондіальдегіду вимірювали, як описано Ding et al. (2015) з невеликою модифікацією. Два грами тканини околоплодника з 15 попередньо повторних фруктів гомогенізували у 5,0 мл 0,05 моль/л фосфатного натрію натрію (pH 7,8) і центрифугували при 12000 g протягом 15 хв при 4 ° C. Зразок супернатанту (3,0 мл) додавали до 3,0 мл 5 г/л тіобарбітурової кислоти. Після кип'ятіння протягом 15 хв і центрифугування при 12000 g протягом 15 хв при 4 ° C поглинання вимірювали при 450, 532 та 600 нм. Вміст MDA розраховували за формулою 6,45 × (A532 - A600) - 0,56 × A450 і дані були виражені на основі нової ваги у мкмоль/кг.
2.7 Визначення вмісту аскорбінової кислоти (AsA), загальних флавоноїдів (TF) та загальної антиоксидантної здатності (TAC)
Вміст аскорбінової кислоти вимірювали, як описано Wang et al. (2016). Два грами тканини околоплодника з 15 попередньо повторних фруктів гомогенізували в 5 мл 20 г/л щавлевої кислоти і центрифугували при 12000 g протягом 15 хв при 4 ° C. Супернатант розбавляли до кінцевого об’єму 50 мл 20 г/л розчину щавлевої кислоти. Вміст AsA визначали титруванням 10 мл розведеного розчину 2,6-розчином дихлорфеноліндофенолу (DCPIP). Реєстрували обсяг розчину DCPIP, який використовувався для досягнення постійного червоного кольору. Стандартна калібрувальна крива була побудована з використанням аскорбінової кислоти, і дані були виражені на основі свіжої ваги як мг еквівалента аскорбінової кислоти (AAE) кг -1 .
Загальний вміст флавоноїдів вимірювали, як описано Хабібі та Рамезаняном (2017) з невеликою модифікацією. Один грам тканини околоплодника з 15 попередніх копій плодів екстрагували і гомогенізували в 25 мл метанолу, що містить 10 мл/л HCl, протягом 20 хв при 4 ° C у темряві, а потім центрифугували при 12000 g при 4 ° C протягом 30 хв. Супернатант при 325 нм реєстрували. Була побудована стандартна калібрувальна крива з використанням катехіну, і дані були виражені на основі нової ваги як мг катехінового еквівалента (CE) кг -1 .
Загальний вміст антиоксидантної здатності визначали за допомогою аналізу 1,1-дифеніл-2-пікрилгідразилу (DPPH). Здатність поглинати вільні радикали DPPH вимірювали, як описано Alothman, Kaur, Fazilah, Bhat та Karim (2010). Коротко, зразок екстракту TF (100 мкл) додавали до 2,9 мл 0,1 моль/л DPPH. Для вимірювання максимальної абсорбції DPPH використовували контрольний зразок, що складався з однакового об'єму розчинника. Поглинання при 517 нм реєстрували для визначення концентрації залишку DPPH. Вміст ТАС розраховували за формулою (A517 управління - A517 зразок) /A517 контроль × 100, і дані були виражені про відсоток інгібування радикала DPPH.
2.8 Визначення активності супероксиддисмутази (SOD), каталази (CAT) та пероксидази (POD)
Активність супероксиддисмутази вимірювали, як описано Шадмані, Ахмадом, Саарі, Дінгом і Таджидіном (2015) з невеликою модифікацією. Два грами тканини околоплодника з 15 попередньо повторних фруктів гомогенізували в 5 мл 50 ммоль/л фосфатного натрію натрію (рН 7,8), що містить 0,5 г/л PVPP і 0,5 ммоль/л EDTA-Na2. Після центрифугування при 12000 g протягом 20 хв при 4 ° C зразок екстракту (0,1 мл) додавали до 2,9 мл 50 ммоль/л фосфатного буфера натрію (pH 7,8), що містить 130 ммоль/л метіоніну, 750 мкмоль/л нітросинього тетразолію (NBT) і 20 мкмоль/л рибофлавіну. Була визначена одна одиниця активності СОД, яка спричиняла 50% інгібування зниження NBT, як моніторували в хвилину при 560 нм.
Активність каталази вимірювали, як описано Beers and Sizer (1952). Один грам тканини околоплодника з 15 попередньо повторних фруктів гомогенізували в 5 мл 50 ммоль/л фосфатного буфера натрію (рН 7,8). Після центрифугування при 12000 g протягом 20 хв при 4 ° C зразок екстракту (0,3 мл) додавали до 2,0 мл 50 ммоль/л натрій-фосфатного буфера (рН 7,8) і 20 ммоль/л H2O2. Для однієї одиниці активності CAT було визначено кількість ферменту, здатного викликати 0,01 зміну в хвилину при 240 нм.
Активність пероксидази вимірювали, як описано Zhang et al. (2019) з невеликою модифікацією. Два грами тканини околоплодника з 15 попередньо повторних фруктів гомогенізували в 5 мл 100 ммоль/л ацетатного буфера (рН 5,5), що містить 1 ммоль/л поліетиленгліколю, 40 г/л ПВПП і 10 г/л Triton X ‐ 100. Після центрифугування при 12000 g протягом 20 хв при 4 ° C зразок екстракту (0,1 мл) додавали до 3,0 мл 25 ммоль/л гваяколу та 0,2 мл 0,5 моль/л H2O2. В одній одиниці активності POD визначали кількість ферменту, здатного викликати 0,01 зміну на хвилину при 470 нм.
2.9 Статистичний аналіз
Експерименти проводились із використанням повністю рандомізованої конструкції. Був проведений односторонній дисперсійний аналіз (ANOVA), щоб визначити суттєві відмінності середніх засобів за допомогою тесту Данкана з багаторазовим діапазоном (стор
3 РЕЗУЛЬТАТИ ТА ОБГОВОРЕННЯ
3.1 Вплив фумігації етанолом на розвиток підрум’янення перикарпа
Показник підрум’янення перикарпа різко збільшився у всіх обробках протягом усього 12-денного періоду зберігання (рис. 1а та b). Етанол ефективно пригнічував розвиток підрум’янення навколоплодника порівняно з контролем плодів. Після 12 днів зберігання при 8 ± 0,5 ° C показник підрум’янення перикарпа 100, 300, 500 та 800 мкл/л етанолу розвинув 1,6, 1,1, 0,8 та 2,4 відповідно, вказуючи на те, що реакція плодів вампі на обсмажування перикарпа залежало від концентрації етанолу, як це було показано раніше в китайській ягоді (Zhang et al., 2007), полуниці (Li et al., 2018) та шовковиці (Choosung, Utto, Boonyaritthongchai, Wasusri та Wongs‐ Aree, 2019) фрукти.
3.2 Діяльність РРО та вміст ТП
Добре задокументовано, що зміни концентрації фенолу та активності РРО призводять до розвитку підрум’янення плодів (Joslyn & Ponting, 1951; Sapers & Hicks, 1989). Розробка ефективного способу зниження активності РРО може безпосередньо контролювати побуріння (Laurila, Kervinen, & Ahvenainen, 1998; Moon, Young Kim, Yeul Ma, & Lee, 2019). У цьому дослідженні етанол, застосовуваний при 100, 300 та 500 мкл/л, суттєво пригнічував збільшення активності РРО протягом усього періоду зберігання (рис. 2а), вказуючи на те, що етанол може змінити активний центр або структуру РРО, в результаті чого зменшення побуріння (Valero, Varon, & Garcia ‐ Carmona, 1990). Підвищений вміст ТП спостерігався під час усіх процедур протягом 6 днів зберігання (рис. 2b). Понад 6 днів у контрольних та 500 мкл/л оброблених етанолом фруктів спостерігалося зниження вмісту ТР, тоді як плоди, оброблені етанолом у 100, 300 або 500 мкл/л, підтримували відносно стабільний або збільшували вміст ТП до 12 днів, що свідчить про те, що втрата ТР у контролі та плодів, оброблених етанолом, 500 мкл/л, може бути пов'язана з виробництвом o‐Хінони шляхом окислення фенольних сполук. Взяті разом, одне з можливих пояснень боротьби з підрум'яненням перикарпа етанолом може бути пов'язане зі зниженою активністю РРО і підтримкою рівня ТР (Cheng, Liu, Feng, Dong, & Guan, 2019).
3.3 Якість зберігання
У цьому дослідженні, порівняно з початковим, контрольний плід різко знизився у FF та TA через 12 днів зберігання (рис. 3a та c). Збільшення SSC суттєво зменшилось при контрольній обробці (рис. 3b). Етанол уповільнював зниження вмісту FF і TA, одночасно збільшуючи рівень SSC під час зберігання. Ефект обробки етанолом 500 мкл/л показав найбільші позитивні ефекти на інгібування втрат FF та TA та стимулювання накопичення SSC, вказуючи на те, що застосування етанолу при 500 мкл/л було ефективним для значного зменшення підрум'янення перикарпа та збереження зберігання якість порівняно з необробленими фруктами. Однак підвищення концентрації етанолу в застосуванні з 500 до 800 мкл/л спричинило посилення підрум’янення перикарпа та погіршення якості, що вказує на те, що висока концентрація етанолу, що застосовується, може призвести до пошкодження клітин плодів.
- Чи має питна вода більше 10 літрів на день будь-яку користь або побічний ефект Медичні науки
- Зелений чай для схуднення Як зробити схваленим FDA - Вітаміни для метаболізму та схуднення
- Куріння марихуани збільшує ваш метаболізм!
- Краудфандінг на Fresh Prime Keto Відгуки АФЕРА ТА ЛЕГІТ Підвищують рівень вашого метаболізму! КУПІТЬ ЗАРАЗ на
- GUAM Найкращі антицелюлітні креми з водоростями, ефект схуднення; Позначений тегами; ціна зростаюча