Внутрішньовенне введення мультипотентних мезенхімальних стромальних клітин кісткового мозку має a
СТАТТІ ДОСЛІДЖЕНЬ
Внутрішньовенне введення мультипотентних мезенхімальних стромальних клітин кісткового мозку нейтрально впливає на діабетичну кардіоміопатію, спричинену ожирінням
Себастьян Д. Каліґаріс і Полетт Конгет
Інститут Ciencias, Факультет медицини, Clínica Alemana, Університет дель Десарролло, Сантьяго, Чилі.
Ожиріння є основною глобальною проблемою охорони здоров'я. У пацієнтів із ожирінням розвивається метаболічний синдром, який є сукупністю клінічних ознак, що характеризуються резистентністю до інсуліну та дисліпідемією. Його серцевий прояв, діабетична кардіоміопатія, призводить до серцевої недостатності.
Мультипотентні мезенхімальні стромальні клітини, отримані з кісткового мозку, також звані мезенхімальними стовбуровими клітинами (МСК), розглядаються як терапевтичний засіб не тільки при серцево-судинних захворюваннях, але й при інших дегенеративних станах.
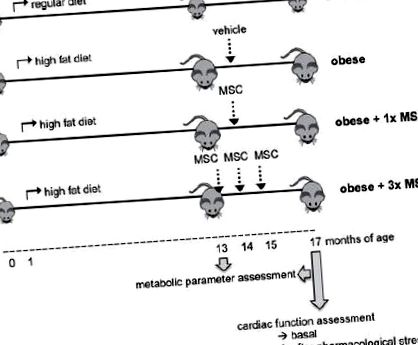
Нашою метою було оцінити, чи внутрішньовенне введення MSC змінює серцеву дисфункцію у мишей із ожирінням. З цією метою мишей C57BL/6 годували звичайною (нормальною) або жирною дієтою (ожирінням). Повні тварини отримували носій (ожиріння), разову дозу (ожиріння + 1х MSC) або три дози (ожиріння + 3x MSC) 0,5x10 6 сингенної MSC. Через два-три місяці після введення МСК серцеву функцію оцінювали за допомогою катетеризації серця, в базальному стані та після фармакологічного стресу.
У порівнянні зі звичайними мишами, ожирілі миші виявляли гіперглікемію, гіперінсулінемію, гіперхолестеринемію та серцеву дисфункцію після стресового стану. Екзогенний МСК не покращував і не порушував цю серцеву дисфункцію.
Таким чином, внутрішньовенне введення МСК має нейтральний вплив на діабетичну кардіоміопатію, спричинену ожирінням
Ключові терміни: Ожиріння, метаболічний синдром, діабетична кардіоміопатія, мультипотентні мезенхімальні клітини строми, серцева функція, добутамін.
ВСТУП
Ожиріння є основною глобальною проблемою охорони здоров'я (Хайдар і Косман, 2011). Зміни у способі життя, переважно прийом їжі з високим вмістом калорій та сидячі звички, різко збільшують її поширеність. У більшості пацієнтів із ожирінням розвивається метаболічний синдром, сукупність клінічних ознак, що характеризуються резистентністю до інсуліну та дисліпідемією (Бонора та ін., 2003). Цей переддіабетичний стан було визнано незалежним фактором ризику серцево-судинних захворювань, зокрема гіпертонії, атеросклерозу та діабетичної кардіоміопатії (Обунай та ін., 2007).
Діабетична кардіоміопатія була описана в 1972 році як серцева недостатність без ознак гіпертонії, ішемічної хвороби серця або клапанна або вроджена вада серця (Rubler та ін., 1972). Протягом останнього десятиліття він набув актуальності, оскільки призводить до серцевої недостатності (Асгар та ін., 2009); її патофізіологія досі недостатньо вивчена. Однак повідомляється, що накопичення ліпідів кардіоміоцитів змінює їх енергетичний обмін, посилюючи окислювальний стрес, погіршуючи обробку кальцію та дисфункцію мітохондрій, що сприяє загибелі кардіоміоцитів та інтерстиціальному фіброзу (Boudina and Abel, 2010). В даний час клінічні методи лікування діабетичної кардіоміопатії спрямовані на затримку її прогресування, головним чином шляхом поліпшення метаболічних змін за допомогою гіпоглікемічних засобів та серцевої діяльності за допомогою β-адреноблокаторів та інгібіторів ангіотензинперетворюючого ферменту (Miki та ін., 2013). Отже, нові методи лікування, призначені для зменшення серцевої недостатності у людей із ожирінням, мали б значний вплив на систему охорони здоров’я (Бернарді та ін., 2012).
МАТЕРІАЛИ І МЕТОДИ
Самців мишей C57BL/6 утримували при постійній температурі (22 ± 2 ° C) та вологості (60%), при 12:12 годинному світлі: темний цикл та необмежений доступ до їжі та води. При необхідності тваринам злегка знеболювали севофлуоран (Abbott Laboratories, штат Іллінойс, США) або 60 мг/кг кетаміну плюс 4 мг/кг ксилазину. Під час жертвоприношення тваринам проводили глибоку анестезію та отримували передозування кетаміну/ксилазину (60/4 мг/кг). Протоколи для тварин були затверджені Комітетом з етики Медичного факультету, Clínica Alemana, Universidad del Desarrollo.
Індукція ожиріння
Всім мишам годували регулярний раціон до місячного віку. Потім їх тримали на звичайній дієті (нормальній) або переходили на дієту з високим вмістом жиру (ожирінням) до кінця дослідження (16 місяців перевіреної дієти). Звичайна дієта складалася з 10 кал.% Жиру, 20 кал.% Білків і 70 кал.% Вуглеводів (Champion SA, Сантьяго, Чилі). Дієта з високим вмістом жиру складалася з 60 кал.% Жиру, 20 кал.% Білків і 20 кал.% Вуглеводів (D12492, Research Diets Inc., NJ, США) ((Calligaris та ін., 2013а; Езкер та ін., 2011).
Кількісна оцінка рівня глюкози, інсуліну, тригліцеридів та холестерину в крові
Після чотирьох годин голодування зразки крові відбирали з хвостової вени насторожених мишей. Рівні глюкози в плазмі крові визначали за допомогою глюкометричної системи Accu-Chek Performa (Roche Diagnostic, Німеччина). Рівень інсуліну в плазмі крові визначали за допомогою ультрачутливого набору ELISA для інсуліну миші (Mercodia, Уппсала, Швеція). Рівні тригліцеридів і холестерину в плазмі крові визначали, використовуючи набори TG Color GPO/PAP та Colestat (Wiener Lab, Росаріо, Аргентина), відповідно (Ezquer et al, 2011).
Оцінка серцево-судинних параметрів при базальних та стресових станах
Мишей глибоко знеболювали і поміщали в положення лежачи на терморегульованій пластині. Температуру тіла контролювали за допомогою ректального термометра і подавали газоподібний кисень. Гемодинамічні параметри вимірювали за допомогою катетеризації серця (Calligaris та ін., 2013b; Лоренц і Роббінс, 1997). Катетером був датчик тиску Mikro-Tip SPR-671 (Millar, Х'юстон, США), з'єднаний з перетворювачем тиску/вольта PCU-2000 (Millar) і підключений до системи збору даних PowerLab 4/30 (AdInstruments, Bella Vista, Австралія). Для оцінки серцевої функції в умовах стресу в яремну вену вводили пластмасову трубку PE-10 (Warner Instruments Co, CT, USA), підключену до насоса KDS-KDS210P (Kdsciaching Inc., MA, США), і вводили добутамін безперервно при 12 нг/г/хв протягом двох хв. Добутамін - це β-адренергічний агоніст з високою спорідненістю до β1-рецепторів, що експресується в серці. При системному введенні він збільшує серцевий попит, спричиняючи серцевий стрес. Отримані дані аналізували за допомогою програмного забезпечення LabChart 7Pro (AdInstruments, Bella Vista, Австралія).
Ізоляція MSC та розширення ex vivo
Шість-вісім тижнів самок мишей C57BL/6 жертвували вивихом шийки матки. Клітини кісткового мозку отримували промиванням стегнових і гомілкових кісток стерильним PBS. Після центрифугування клітини ресуспендували в альфа-MEM (Gibco, NZ), додавали 10% відібраної фетальної бичачої сироватки (Gibco) та 80 мкг/мл гентаміцину (Сандерсон Лабораторія, Чилі) і висівали при щільності 1х10 6 ядерних клітин/см 2. Неадгезивні клітини видаляли через 72 години шляхом зміни середовища. Коли вогнища досягли місця злиття, приклеєні клітини відокремлювали 0,25% трипсином, 2,65 мМ EDTA (Gibco), центрифугували і культивували при 7000 клітин/см 2. Після двох субкультур прилеплені клітини були охарактеризовані та трансплантовані (Ezquer та ін., 2008).
Фенотип керованого MSC
Оскільки в даний час не існує маркерів консенсусу для мишачих MSC, як для людських MSC (Conget and Minguell, 1999; Dominici та ін., 2006), імунофенотипування проводили методом проточної цитометрії після імунофарбування моноклональними антитілами проти CD45.2 (кон'югований FITC) від BD Pharmingen, США, CD11b (кон'югований PE), Sca-1 (кон'югований APC) та CD90.2 ( PE-спряжений), все від eBioscience, Каліфорнія, США.
Потенціал диференціації MSC оцінювали після впливу клітин на стандартні адипогенні або остеогенні середовища диференціації протягом 14 та 21 дня відповідно (Conget та Minguell, 1999). Зображення отримували за допомогою мікроскопа Nikon T1-SM.
МСК внутрішньовенне введення
Загалом 0,5 × 106 МСК ресуспендували в 0,2 мл 5% плазми миші і вводили через хвостову вену злегка знеболеним мишам. Контрольні тварини отримали 0,2 мл носія.
Статистичний аналіз
Дані представлені як середнє значення ± S.E.M. Для визначення статистичної значущості міжгрупових відмінностей використовували t-критерій Стьюдента для порівняння середніх значень між нормальними та ожирілими мишами, а односторонню ANOVA використовували для порівняння середніх значень серед усіх груп. Значення р
РЕЗУЛЬТАТИ
Метаболічні параметри ожиріних мишей
Порівняно з нормальними мишами, ожиріння мишей виявляло надлишкову вагу, гіперглікемію, гіперінсулінемію та гіперхолестеринемію до кінця періоду дослідження (Таблиця 1).
Фенотип введеного МСК Адміністративними MSC були CD45 -, CD11b -, Sca-1 + та CD90.2 + (Малюнок 2А); вони диференціювались на адипоцити (клітини, що містять нейтральні ліпідні краплі) та остеобласти (клітини, що секретують гідроксилапатит), що відповідають критеріям визначення MSC миші (Рис. 2B) (Sung та ін., 2008).
Серцева функція мишей з ожирінням після введення MSC
За базових умов не спостерігалось значних змін у скорочувальній (dP/dtmax) або релаксаційній (dP/dtmin) здатності серця між нормальними та ожирілими мишами (Рисунок 3A).
Коли серцеву функцію оцінювали після фармакологічного стресу (стимуляція добутаміном), миші з ожирінням продемонстрували статистично значуще зниження обох гемодинамічних показників порівняно з нормальними мишами (рис. 3В).
Екзогенні МСК не суттєво змінили серцеві показники мишей, що страждають ожирінням, за базового стану або після стимуляції добутаміном (рис. 3В). Коли значення dP/dtmin і dP/dtmax, отримані в базальному стані, порівнювали з даними, отриманими в стресовому стані, було помічено, що у ожирілих тварин, які отримували три дози MSC, спостерігалося незначне, але не значне збільшення Δdp/dtmin (добутамме-базалія), що свідчить про поліпшення функції (норма: 3231 ± 1000; ожиріння: 1609 ± 758; ожиріння + 1x MSC: 1,883 ± 632; ожиріння + 3x MSC: 2,423 ± 886).
ОБГОВОРЕННЯ
Діабетична кардіоміопатія виявляється при переробці серця (концентрична гіпертрофія), фіброзі, прогресуючій діастолічній та систолічній дисфункції та порушенні скорочувального резерву при виконанні стрес-тестів (Абель та ін., 2008; Деніелс та ін., 2010). Ці серцеві зміни були пов’язані з підвищеним окислювальним стресом, зміненим гомеостазом кальцію, прогресуючою дисфункцією мітохондрій, починаючи зі зменшення вироблення АТФ, до активації апоптотичних сигналів (вивільнення цитохрому с) та ліпотоксичності (індукованого керамідом апоптозу) (Будіна та Абель, 2010).
Для того, щоб оцінити, чи спостерігається відсутність ефекту залежить від використовуваної дози, ми потроїли кількість введеного МСК. Проте подальшого ефекту не спостерігалося. Ми не тестували більш високу дозу, оскільки кількість клітин, які вже вводили (8 x 10 6), була вже у верхній межі того, що в даний час тестується в клінічних випробуваннях (1-10 x 10 6) (Elnakish та ін., 2012).
У попередньому дослідженні описано сприятливий ефект введення MSC на стрептозотоцинових щурів-діабетиків (Чжан та ін., 2008). Хоча екзогенний МСК сприяв ангіогенезу та ослабленому переробці серця, функціональних результатів не повідомлялося. Цей короткий звіт є першим дослідженням, проведеним з тих пір, щоб описати вплив MSC на діабетичну кардіоміопатію, спричинену ожирінням, на функціональному рівні. Ми показуємо, що при випробуваних умовах (шлях, час та дози) донорські МСК мають нейтральний вплив на діабетичну кардіоміопатію, спричинену ожирінням.
Подальші дослідження слід проводити з метою покращення передбачуваного ефекту MSC на серцеву дисфункцію мишей із ожирінням, таких як попереднє кондиціонування MSC, щоб збільшити їх самонаведення та/або стійкість до мікросередовищ окисного стресу (Samper та ін., 2012) та інші шляхи введення, такі як внутрішньоміокардіальне або внутрішньокоронарне (Elnakish та ін., 2012 р .; Матіасен та ін., 2012).
ПОДЯКИ
Ця робота була підтримана грантом FONDECYT № 11090114 SDC.
ЛІТЕРАТУРА
АБЕЛ ЕД, ЛІТВІН SE, І SWEENEY G (2008). Реконструкція серця при ожирінні. Physiol Rev 88, 389-419. [Посилання]
ANKRUM J та KARP JM (2010). Терапія мезенхімальними стовбуровими клітинами: два кроки вперед, один назад. Тенденції Mol Med 16, 203-209. [Посилання]
АСГАР О, АЛЬ-САННІ А, ХАВАНДІ К, ХАВАНДІ А, СЕРСЕРС С, ГРИНШТАЙН А, ЗДОРОВ'Я АМ І МАЛІК РА (2009). Діабетична кардіоміопатія. Clin Sci (Лонд) 116, 741-760. [Посилання]
BERNARDI S, SEVERINI GM, ZAULI G AND SECCHIERO P (2012). Клітинна терапія діабетичних ускладнень. Exp Діабет Res 2012 рік, 872504. [Посилання]
BONORA E, KIECHL S, WILLEIT J, OBERHOLLENZER F, EGGER G, BONADONNA RC, MUGGEO M (2003). Метаболічний синдром: епідеміологія та більш широкий фенотиповий опис. Дані поперечного перерізу дослідження Брунека. Int J Obes Relat Metab Disord 27, 1283-1289. [Посилання]
BOUDINA S, AND ABEL ED (2010). Діабетична кардіоміопатія, причини та наслідки. Rev Endocr Metab Disord 11, 31-39. [Посилання]
CALLIGARIS S, LECANDA M, SOLIS F, EZQUER M, GUTIÉRREZ J, BRANDAN E, LEIVA A, SOBREVIA L AND CONGET P (2013a). Довгострокове дієтичне годування мишами повторює 1 зміну серцево-судинної системи людини: тваринна модель для вивчення ранніх фаз діабетичної кардіоміопатії. PLoS Один (прийнято) [Посилання]
CALLIGARIS S, RICCA M, AND CONGET P (2013b). Сердечний стрес-тест, індукований добутаміном і контролюваний катетеризацією серця у мишей. Журнал візуалізованих експериментів 72, 1-6. [Посилання]
CONGET PA AND MINGUELL JJ (1999). Фенотипові та функціональні властивості мезенхімальних клітин-попередників кісткового мозку людини. J Cell Physiol 181, 67-73. [Посилання]
ДАНІЕЛЬ А, ВАН БІЛЬСЕН М, ЯНССЕН БЖ, БРОНС АЕ, КЛЮТЖЕНС JP, РОМЕН TH, SCHAART G, VAN DER VELDEN J, VAN DER VUSSE GJ І VAN NIEUWENHOVEN FA (2010). Порушення серцевого функціонального резерву у діабетичних мишей db/db типу 2 пов’язане з метаболічним, але не структурним ремоделюванням. Acta Physiol (Oxf) 200, 11-22. [Посилання]
DOMINICI M, LE BLANC K, MUELLER I, SLAPER-CORTENBACH I, MARINI F, KRAUSE D, DEANS R, KEATING A, PROCKOP D AND HORWITZ E (2006). Мінімальні критерії для визначення мультипотентних мезенхімальних стромальних клітин. Заява позиції Міжнародного товариства клітинної терапії. Цитотерапія 8, 315-317. [Посилання]
ELNAKISH MT, HASSAN F, DAKHLALLAH D, MARSH CB, ALHAIDER IA та KHAN M (2012). Мезенхімальні стовбурові клітини для регенерації серця: переклад у приліжкову реальність. Стовбурові клітини 2012 рік, 646038. [Посилання]
EZQUER FE, EZQUER ME, PARRAU DB, CARPIO D, YANEZ AJ AND CONGET PA (2008). Системне введення мультипотентних мезенхімальних стромальних клітин повертає гіперглікемію та запобігає нефропатії у мишей з діабетом 1 типу. Трансплантація кісткового мозку Biol 14, 631-640. [Посилання]
EZQUER M, EZQUER F, RICCA M, ALLERS C І CONGET P (2011). Внутрішньовенне введення мультипотентних стромальних клітин запобігає появі неалкогольного стеатогепатиту у мишей із ожирінням з метаболічним синдромом. J Hepatol 55, 1112-1120. [Посилання]
ГАЙДАР Я.М. І КОСМАН до н. Е. (2011). Епідеміологія ожиріння. Клін Колон Ректальна хірургія 24, 205-210. [Посилання]
JONES DA, CHOUDRY F, AND MATHUR A (2012). Клітинна терапія при серцево-судинних захворюваннях: журнали національного суспільства представляють вибрані дослідження, що сприяли останнім досягненням клінічної кардіології. Серце 98, 1626-1631. [Посилання]
KAJSTURA J, FIORDALISO F, ANDREOLI AM, LI B, CHIMENTI S, MEDOW MS, LIMANA F, NADAL-GINARD B, LERI A, ANVERSA P (2001). Надмірна експресія IGF-1 пригнічує розвиток діабетичної кардіоміопатії та опосередкованого ангіотензином II оксидативного стресу. Діабет 50, 1414-1424. [Посилання]
ЛОРЕНЦ Й.Н. І РОББІНС J (1997). Вимірювання внутрішньошлуночкового тиску та серцевих показників у інтактної миші під наркозом із закритою грудною кліткою. Am J Physiol 272, H1137-1146. [Посилання]
MATHIASEN AB, JORGENSEN E, QAYYUM AA, HAACK-SORENSEN M, EKBLOND A, KASTRUP J (2012). Обгрунтування та дизайн першого рандомізованого, подвійного сліпого, плацебо-контрольованого дослідження внутрішньоміокардіального введення аутологічних мезенхімальних стромних клітин, отриманих з кісткового мозку, при хронічній ішемічній серцевій недостатності (дослідження MSC-HF) Am Heart J 164, 285-291. [Посилання]
МІКІ Т, ЮДА С, КОУЗУ Х І МІУРА Т (2013). Діабетична кардіоміопатія: патофізіологія та клінічні особливості. Heart Fail Rev 18, 149-166. [Посилання]
OBUNAI K, JANI S, AND DANGAS GD (2007). Серцево-судинна захворюваність та смертність від метаболічного синдрому. Med Clin North Am 91, 1169-1184, x. [Посилання]
RUBLER S, DLUGASH J, YUCEOGLU YZ, KUMRAL T, BRANWOOD AW і GRISHMAN A (1972). Новий тип кардіоміопатії, асоційований з діабетичним гломерулосклерозом. Am J Cardiol 30, 595-602. [Посилання]
SAMPER E, DIEZ-JUAN A, MONTERO JA, SEPULVEDA P (2012). Терапія серцевих клітин: посилення ефекту мезенхімальних стовбурових клітин. Stem Cell Rev. [Посилання]
SUNG JH, YANG HM, PARK JB, CHOI GS, JOH JW, KWON CH, CHUN JM, LEE SK AND KIM SJ (2008). Виділення та характеристика мезенхімальних стовбурових клітин миші. Трансплантація Proc 40, 2649-2654. [Посилання]
VALLE-PRIETO A І CONGET PA (2010). Мезенхімальні стовбурові клітини людини ефективно управляють окислювальним стресом. Стовбурові клітини Dev 19, 1885-1893. [Посилання]
VAN LINTHOUT S, STAMM C, SCHULTHEISS HP І TSCHOPE C (2011). Мезенхімальні стовбурові клітини та запальна кардіоміопатія: самонаведення серця та не тільки. Cardiol Res Pract 2011 рік, 757154. [Посилання]
ЧЖАН Н, ЛІ ДЖ, ЛУО Р, ЦЯН ДЖ І ВАН ДЖА (2008). Мезенхімальні стовбурові клітини кісткового мозку індукують ангіогенез і послаблюють реконструкцію діабетичної кардіоміопатії. Exp Clin Ендокринольний діабет 116, 104-111. [Посилання]
Автор-кореспондент: доктор філософії Себастьян Д. Каллігаріс. Instituto de Ciencias, Facultad de Medicina, Clínica Alemana, Universidad del Desarrollo, Santiago, Чилі. Адреса: Av. Лас Кондес 12.438, Ло Барнечі. Телефон: 56 2 23279682 - факс: 56 2 23279693 - Електронна адреса: [email protected]
Отримано: 8 квітня 2013 р. У переглянутій формі: 5 липня 2013 р. Прийнято: 23 липня 2013 р.
Це також контенідо де еста ревіста, крім того, що є ідентифікаційним, так само, як і Licencia Creative Commons
Канада 253, пісо 3º, Dpto. F.
Тел .: (56-2) 22093503
Факс: (56-2) 22258427
- Цілющий кістковий бульйон Яєчний крапельний суп - корисна виделка
- Зцілення клітин за допомогою суперпродуктів 24Life
- Рецепт цілющого відвару з риб’ячих кісток для негерметичних кишок - затишні куточки Крісті
- Чи існує таке поняття, як протизапальна дієта Bone & Joint
- М'ясо N Bone Iberico 101 Jamon Iberico найкраща шинка у світі I