Бор
Наші редактори розглянуть подане вами повідомлення та вирішать, чи слід переглянути статтю.
Бор (B), хімічний елемент, напівметал основної групи 13 (IIIa, або борова група) періодичної системи, необхідний для росту рослин і широкого промислового застосування.
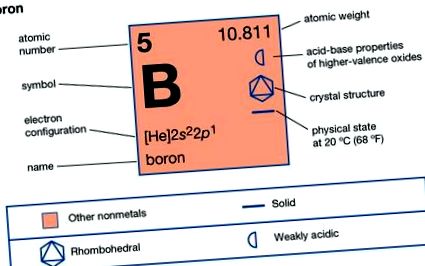
| 5 |
| [10.806, 10.821] |
| 2200 ° C (4000 ° F) |
| 2550 ° C (4620 ° F) |
| 2,34 (при 20 ° C [68 ° F]) |
| +3 |
| 1с 2 2с 2 2п 1 |
Властивості, поява та використання
Чистий кристалічний бор - чорний блискучий напівпровідник; тобто він проводить електрику подібно металу при високих температурах і є майже ізолятором при низьких температурах. Досить важко (9,3 за шкалою Мооса) подряпати деякі абразиви, такі як карборунд, але занадто крихкі для використання в інструментах. Це становить близько 0,001 відсотка від маси земної кори. Бор зустрічається у поєднанні з бурою, кернітом і тинкальконітом (гідратованими боратами натрію), основними комерційними мінералами бору, особливо зосередженими в посушливих районах Каліфорнії, і такими широко розподіленими мінералами, як колеманіт, улексит та турмалін. Сасоліт - природна борна кислота - зустрічається особливо в Італії.
Вперше бор був виділений (1808) французькими хіміками Джозефом-Луї Гей-Люссаком та Луї-Жаком Тенардом та незалежно британським хіміком сером Хамфрі Деві шляхом нагрівання оксиду бору (B2O3) металом калію. Нечистий аморфний продукт, коричнево-чорний порошок, був єдиною формою бору, відомою більше століття. Чистий кристалічний бор може бути важко одержаний відновленням його броміду або хлориду (BBr3, BCl3) воднем на електрично нагрітому танталовому волокні.
Обмежені кількості елементарного бору широко використовуються для підвищення твердості сталі. Доданий у вигляді фероборону із сплаву заліза, він присутній у багатьох сталях, як правило, в діапазоні від 0,001 до 0,005%. Бор також використовується у промисловості кольорових металів, як правило, як розкислювач, в сплавах на основі міді та міді з високою провідністю як дегазатор, а також в алюмінієвих виливках для очищення зерна. У напівпровідниковій промисловості невеликі, ретельно контрольовані кількості бору додають як легуючий засіб до кремнію та германію для зміни електропровідності.
У формі борної кислоти або боратів сліди бору необхідні для росту багатьох наземних рослин і, отже, опосередковано необхідні для життя тварин. Типовими наслідками довготривалої дефіциту бору є затримка, деформований ріст; овочеве «коричневе серце» та «суха гниль» цукрових буряків є одними з розладів через дефіцит бору. Дефіцит бору можна полегшити внесенням у ґрунт розчинних боратів. Однак у надлишкових кількостях борати діють як неселективні гербіциди. Повідомлялося про гігантизм кількох видів рослин, що ростуть у ґрунті, природно багатому бором. Поки незрозуміло, якою є точна роль бору в житті рослин, але більшість дослідників сходяться на думці, що цей елемент певним чином необхідний для нормального росту та функціонування верхівкових меристем, зростаючих кінчиків пагонів рослин.
Чистий бор існує принаймні у чотирьох кристалічних модифікаціях або алотропах. Закриті клітини, що містять 12 атомів бору, розташованих у формі ікосаедра, трапляються в різних кристалічних формах елементарного бору.
Кристалічний бор майже інертний хімічно при звичайних температурах. Кипляча соляна кислота на це не впливає, а гаряча концентрована азотна кислота лише повільно перетворює тонкопорошковий бор в борну кислоту (H3BO3). Бор за своєю хімічною поведінкою неметалевий.
У природі бор складається із суміші двох стабільних ізотопів - бору-10 (19,9 відсотка) та бору-11 (80,1 відсотка); незначні коливання цієї пропорції дають діапазон ± 0,003 атомної маси. Обидва ядра мають ядерний спін (обертання атомних ядер); значення бору-10 має значення 3, а бору-11, 3/2, значення диктуються квантовими факторами. Отже, ці ізотопи використовуються в ядерно-магнітно-резонансній спектроскопії, і спектрометри, спеціально пристосовані для виявлення ядра бору-11, є у продажу. Ядра бору-10 і бору-11 також викликають розщеплення в резонансах (тобто появу нових смуг в резонансних спектрах) інших ядер (наприклад, ядер атомів водню, пов'язаних з бором).
Ізотоп бору-10 унікальний тим, що він має надзвичайно великий переріз захоплення (3836 сантиметрів) для теплових нейтронів (тобто він легко поглинає нейтрони з низькою енергією). Захоплення нейтрона ядром цього ізотопу призводить до вигнання альфа-частинки (ядра атома гелію, символізованого α):
Оскільки альфа-частинка з високою енергією не рухається далеко в нормальній речовині, бор та деякі його сполуки були використані для виготовлення нейтронних екранів (матеріалів, які не проникають нейтронами). У лічильнику Гейгера альфа-частинки викликають відповідь, тоді як нейтрони - ні; отже, якщо газова камера лічильника Гейгера заповнена газоподібним похідним бору (наприклад, трифторидом бору), лічильник реєструватиме кожну альфа-частинку, що утворюється, коли нейтрон, що проходить в камеру, захоплюється ядром бору-10. Таким чином лічильник Гейгера перетворюється на пристрій для виявлення нейтронів, які зазвичай не впливають на нього.
Спорідненість бору-10 до нейтронів також лежить в основі методики, відомої як терапія захоплення нейтронів бору (BNCT), для лікування пацієнтів, які страждають від пухлин головного мозку. Протягом короткого часу після введення певних сполук бору пацієнтові з пухлиною головного мозку сполуки переважно збираються в пухлині; опромінення ділянки пухлини тепловими нейтронами, які спричиняють відносно невелике загальне пошкодження тканини, призводить до виділення в пухлині альфа-частинки, що пошкоджує тканини, кожного разу, коли ядро бору-10 захоплює нейтрон. Таким чином, руйнування може обмежуватися переважно пухлиною, залишаючи нормальну мозкову тканину менш ураженою. BNCT також вивчався як лікування пухлин голови та шиї, печінки, простати, сечового міхура та молочної залози.
- Бор Факти та користь для здоров'я Харчування
- 10 дивовижних переваг та використання яблучного оцту
- Властивості блакитного чаю та користь для здоров’я (особливо для схуднення)
- 10 дивовижних переваг органічних фактів родіоли рожевої
- Американська добавка чемериці Переваги, використання, побічні ефекти, дозування та взаємодія