Вікова зміна ниркової кортикомедулярної диференціації: оцінка за допомогою неконтрастної МРТ із стійкою стаціонарною вільною прецесією (SSFP) з просторово-селективним імпульсом інверсії із використанням змінного часу інверсії
Відділ радіології, медична школа Кавасакі, Курасікі, Окаяма, Японія
Відділ радіології, медична школа Кавасакі, Курасікі, Окаяма, Японія
Відділ радіології, медична школа Кавасакі, Курасікі, Окаяма, Японія
Відділ радіології, медична школа Кавасакі, Курасікі, Окаяма, Японія
Відділ радіології, медична школа Кавасакі, Курасікі, Окаяма, Японія
Відділ радіології, медична школа Кавасакі, Курасікі, Окаяма, Японія
Відділ радіології, медична школа Кавасакі, Курасікі, Окаяма, Японія
Відділ радіології, медична школа Кавасакі, Курасікі, Окаяма, Японія
Відділ радіології, медична школа Кавасакі, Курасікі, Окаяма, Японія
Відділ радіології, медична школа Кавасакі, Курасікі, Окаяма, Японія
Відділ радіології, медична школа Кавасакі, Курасікі, Окаяма, Японія
Відділ радіології, медична школа Кавасакі, Курасікі, Окаяма, Японія
Відділ радіології, медична школа Кавасакі, Курасікі, Окаяма, Японія
Відділ радіології, медична школа Кавасакі, Курасікі, Окаяма, Японія
Відділ радіології, медична школа Кавасакі, Курасікі, Окаяма, Японія
Відділ радіології, медична школа Кавасакі, Курасікі, Окаяма, Японія
Відділ радіології, медична школа Кавасакі, Курасікі, Окаяма, Японія
Відділ радіології, медична школа Кавасакі, Курасікі, Окаяма, Японія
Анотація
Призначення
Оцінити вікову зміну ниркової кортикомедулярної диференціації та товщини кортикальної нирки за допомогою магнітно-резонансної томографії (МРТ) з посиленою неконтрастною стаціонарною вільною прецесією (МРТ) з просторово-селективним імпульсом відновлення інверсії (ІР).
Матеріали і методи
Інституційна комісія з нагляду у нашій лікарні схвалила це ретроспективне дослідження, і згода пацієнта на інформування була відмінена. У цьому дослідженні брали участь 48 пацієнтів без захворювань нирок, яким проводили МРТ із контрастною контрастністю МРТ із просторово селективним ІЧ-імпульсом із використанням змінних часів інверсії (ТІ) (700–1500 мсек). Інтенсивність сигналу кори нирки та довгастого мозку вимірювали для розрахунку коефіцієнта контрастності кортикомедулярної нирки. Додатково вимірювали товщу кортикальної нирки.
Результати
Нирковий кортикомедулярний перехід був чітко зображений у всіх пацієнтів. Середня товщина кірки становила 3,9 ± 0,83 мм. Середнє співвідношення кортикомедулярного контрасту становило 4,7 ± 1,4. Існувала негативна кореляція між оптимальним ТІ для найкращої візуалізації ниркової кортикомедулярної диференціації та віком (р = -0,378; P = 0,001). Однак не було значущої кореляції між коефіцієнтом контрастності ниркової кортикомедулярної терапії та віком (р = 0,187; P = 0,20). Подібним чином не спостерігалося значної кореляції між товщиною кортикальної нирки та віком (р = 0,054; P = 0,712).
Висновок
ХРОНІЧНА ХВОРОБА НІРКИ (ХБН) Пацієнти, у яких необхідний діаліз або трансплантація, постійно збільшуються; таким чином, рання діагностика та оцінка ХХН є особливо важливою, оскільки вона веде до раннього лікування ХХН та ранньої профілактики прогресування захворювання до кінцевої стадії у пацієнтів із ХХН. Кілька попередніх досліджень показали позитивну кореляцію між функцією нирок та об'ємом кори нирки або товщиною кори 1-12. Однак у пацієнтів з нирковою недостатністю було помічено, що ниркова кортикомедулярна диференціація зменшується при посиленій магнітно-резонансній томографії (МРТ) 2, 13-17, що потенційно може спричинити клінічні труднощі при точному вимірюванні товщини і об'єму ниркової кори.
Безконтрастна посилена рівноважна вільна прецесія (SSFP) з просторово-селективним імпульсом відновлення інверсії (ІЧ) - це техніка, яка може підкреслити незначні відмінності в значеннях T1 між корою нирки та довгастим мозком 18-25. Наше попереднє дослідження показало, що чітко виражену ниркову кортикомедулярну диференціацію можна спостерігати при неконтрастному МРТ SSFP із просторово-селективним ІЧ-імпульсом у молодих дорослих шляхом отримання зображень з оптимальним часом відновлення інверсії (ТІ) 10. Однак це дослідження не включало аналіз кореляції між віком та візуалізацією кортикомедулярної диференціації. Тому досі незрозуміло, чи змінюється кортикомедулярна диференціація та товщина кори в нормальних нирках зі старінням. Встановлення базової лінії кортикомедулярної диференціації та товщини кори в нормальній старіючій нирці буде важливим для того, щоб визначити, чи залежить зміна диференціації кортикомедулярної нирки та товщини кори у хворих на ХХН старшого віку залежно від патологічних змін або ефекту старіння. Таким чином, метою цього дослідження було оцінити вікову зміну ниркової кортикомедулярної диференціації та товщини кортикальної нирки за допомогою неконтрастної МРТ SSFP із просторово-селективним ІЧ-імпульсом.
МАТЕРІАЛИ І МЕТОДИ
Предмети
Інституційна комісія з нагляду у нашій лікарні схвалила це ретроспективне дослідження, і згода пацієнта на інформування була відмінена.
У нашому ретроспективному огляді ми виявили 48 послідовних пацієнтів без клінічної історії захворювань нирок (33 чоловіки, 15 жінок; середній вік, 54 роки; діапазон, 23–84 роки), яким була проведена МРТ черевної порожнини, включаючи послідовності SSFP без посилення контрасту з просторово селективними ІЧ-пульс у період з червня 2010 р. По грудень 2011 р. Серед цих пацієнтів 20 пацієнтів були включені в наше попереднє дослідження 10. Жоден з цих пацієнтів не мав в анамнезі захворювань нирок, гіпертонії та інших судинних захворювань. Пацієнтів направляли на обстеження МР для скринінгу доброякісних захворювань живота. Ці пацієнти були розділені на три групи залежно від віку: група 1: 20–39 років (n = 11), група 2: 40–59 років (n = 16), а група 3: 60–89 років (n = 21).
Техніка зображення
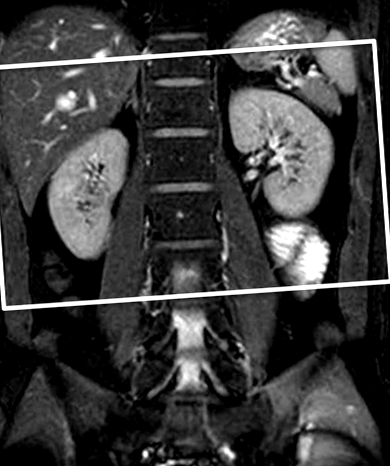
Дослідження МРТ проводили з використанням 1,5-Т апарата (Vantage Atlas MRT ‐ 2003; Toshiba, Токіо, Японія) з використанням котушки Atlas SPEEDER. МРТ SSFP з посиленням контрасту з просторово-селективним ІЧ-імпульсом проводили як частину нашого черевного протоколу. Спочатку корональні зображення SSFP із придушенням жиру без застосування просторово-селективного ІЧ-імпульсу отримували під час однієї затримки дихання для локалізації двосторонніх нирок і використовували як еталонне зображення для визначення положення для розміщення просторово-селективного ІЧ-імпульсу (рис. 1).
Параметрами зображення послідовності SSFP були час повторення/час відлуння (TR/TE) = 4,2/2,1 мсек, кількість придбань = 1, паралельний коефіцієнт зображення = 2, кут перекидання = 90 °, пропускна здатність приймача = 977 Гц/піксель, зріз товщина = 7 мм, поле зору = 400 × 400 мм, а матриця захоплення = 256 × 256. Потім проводили неконтрастну МРТ SSFP нирки з просторово-селективним ІЧ-імпульсом, використовуючи ідентичні параметри візуалізації. Просторово-селективний ІЧ-імпульс товщиною 130 мм був розміщений на обох нирках (рис. 1). Серію топографічно однакових послідовностей SSFP із просторово-селективним ІЧ-імпульсом проводили, використовуючи змінні часи інверсії (TI) (700, 800, 900, 1000, 1100, 1200, 1300, 1400 та 1500 мс), щоб продемонструвати послідовні зміни сигналу міченої кори нирки та довгастого мозку відповідно до ТІ, та для визначення оптимального ТІ, щоб найкраще візуалізувати ниркову кортикомедулярну диференціацію (рис. 2).
Аналіз даних
Статистичний аналіз
Статистичний аналіз проводили за допомогою SPSS v. 17.0 J для програмного забезпечення Windows (Чикаго, Іллінойс). Всі тести були двосторонніми і P
РЕЗУЛЬТАТИ
Середня мінімальна товщина кортикальної нирки для всіх пацієнтів становила 3,9 ± 0,83 мм (діапазон - 2,5–5,7 мм). Середній коефіцієнт кортикомедулярного контрасту, виміряний на знімках SSFP з оптимальним ТІ для всіх пацієнтів, становив 4,7 ± 1,4 (діапазон, 1,9–8,7). Існувала негативна кореляція між оптимальним ТІ для найкращої візуалізації ниркової кортикомедулярної диференціації та віком (р = -0,378; P = 0,001) (рис. 3). Однак не було значущої кореляції між коефіцієнтом контрастності ниркової кортикомедулярної терапії та віком (р = 0,187; P = 0,200) (рис. 4). Подібним чином не спостерігалось значної кореляції між мінімальною товщиною кортикальної нирки та віком (р = 0,054; P = 0,712) (рис.5).
Що стосується оптимального ТІ, коефіцієнт кортикомедулярної контрастності був найвищим, з ТІ 1200 мсек у 4 (36%) і з ТІ 1100 мс у 4 (36%) з 11 суб'єктів у групі 1, тоді як він був найвищим з ТІ 1100 мс у 7 (44%) з 16 суб’єктів у групі 2. У групі 3 коефіцієнт кортикомедулярної контрастності був найвищим із ТІ 1000 мс у 8 (38%) з 21 суб’єкта (табл. 1) (рис. 2) . У порівнянні серед трьох груп середня мінімальна товщина кортикальної нирки в групах 1, 2 та 3 становила 3,9 ± 0,84 мм, 3,9 ± 0,80 мм та 4,0 ± 0,83 мм відповідно. Суттєвої різниці в мінімальній товщі кори нирки серед трьох груп не спостерігалося (P = 0,93). Середній коефіцієнт кортикомедулярного контрасту в групах 1, 2 та 3 становив 4,3 ± 1,4, 4,7 ± 1,2 та 5,0 ± 1,4 відповідно. Суттєвої різниці не спостерігалось у співвідношенні ниркових кортикомедулярних контрастів між трьома групами (P = 0,38).
| 23–39 років (n = 11) | 4 | 4 | 2 | 1 | |
| 40–59 років (n = 16) | 1 | 5 | 7 | 3 | |
| 60–89 років (n = 21) | 1 | 8 | 6 | 4 | 2 |
ОБГОВОРЕННЯ
Це дослідження показало, що ниркову кортикомедулярну диференціацію можна чітко візуалізувати у досліджених вікових групах із середнім коефіцієнтом кортикомедулярного контрасту 4,7 за допомогою неконтрастної МРТ SSFP з просторово-селективним ІЧ-пульсом із використанням оптимального ТІ. У цьому дослідженні ми використовували змінні ТІ (700–1500 мсек з кроком по 100 мсек) у візуалізації SSFP із просторово-селективним ІЧ-імпульсом для визначення оптимального ТІ для найкращої візуалізації нирково-кортикомедулярного з’єднання, оскільки кортикомедулярний контраст динамічно змінювався відповідно до значень ТІ. Наші результати показали негативну кореляцію між оптимальним ТІ для найкращої візуалізації ниркової кортикомедулярної диференціації та віком.
Повідомлялося, що у старінні нирці відбувається кілька структурних та функціональних змін 1. І в корі нирки, і в мозковій речовині вважається, що нирковий кровотік, а також вміст води зменшуються зі старінням 1. Отже, загальне зменшення обсягів паренхіматозної рідини нирок зі старінням скорочує час релаксації T1 кори нирки та довгастого мозку та спричиняє зсув нульової точки кори нирки та довгастого мозку, що призводить до зменшення оптимального значення ТІ для найкращого візуалізація нирково-кортикомедулярного з'єднання у пацієнтів похилого віку. Отже, важливо буде вибрати оптимальне значення TI для візуалізації SSFP із просторово-селективним ІЧ-імпульсом відповідно до віку.
Що стосується коефіцієнта контрастності ниркових кортикомедулярних препаратів, то не було значної кореляції між коефіцієнтом контрастності ниркових кортикомедулярних препаратів та віком. Навіть у літній групі коефіцієнт контрастності ниркових кортикомедулярних препаратів зберігався на одному рівні з молодшою групою. Цей факт вказує на те, що коефіцієнт контрастності ниркових кортикомедулярних препаратів не впливає на старіння, і припускає, що зміна коефіцієнта контрастності ниркових кортикомедулярних препаратів, якщо спостерігатиметься, буде спричинена патологічними змінами паренхіми нирок і може використовуватися як індикатор порушення функції нирок функціонують незалежно від віку. Крім того, цей факт свідчить про те, що МРТ SSFP із просторово-селективним ІЧ-імпульсом був би придатним для вимірювання товщини кортикальної нирки, оскільки кортикомедулярний перехід нирки можна чітко зобразити у всіх поколіннях старше 20 років.
У цьому дослідженні не спостерігалось значущої кореляції між середньою товщиною кори нирки, виміряною на неконтрастних зображеннях MR MRF з просторово селективним ІЧ-пульсом та віком. Кілька досліджень повідомляли, що товщина кори нирки, виміряна на УЗД або комп’ютерній томографії (КТ), корелювала зі ступенем ниркової недостатності при ХХН, і що вимірювання товщини кори нирки було корисним для прогнозування загострення хронічного захворювання нирок та визначення відторгнення трансплантата нирки та дисфункція 3-8, 11, 12, 17. Наші результати показали, що товщина кортикальної нирки в нормальній нирці, виміряна за нашим методом, не впливала на вік. Отже, вимірювання товщини кори нирки цим методом може бути використано як маркер функції нирок навіть у літніх пацієнтів, не враховуючи впливу старіння.
Попереднє дослідження показало, що товщина кори нирки, виміряна при контрастній КТ, обернено корелювала з віком 26 років, що відрізняється від нашого результату. Однак у їх дослідженні застосовували інший спосіб (тобто КТ) для швидкого внутрішньовенного введення контрастних речовин в інший заклад. Товщина кори, посилена під час судинної фази КТ, вважалася перфузійною діючою корою, а не фактичною корою нирок. Також повідомляється, що об'єм нирок за допомогою ангіографії був збільшений приблизно на 50% через збільшення об'ємних канальців за рахунок контрастного осмосу 27. Крім того, середнє вік, а також віковий розподіл були невстановлені в попередньому дослідженні. УЗД може надати більше розуміння, чому товщина кори відрізняється між КТ та МРТ.
Нарешті, у цьому дослідженні маса тіла та зріст пацієнтів не враховувались. Ці фактори можуть впливати на вимірювання товщини кортикальної нирки. Насправді одне дослідження показало, що було виявлено помірну кореляцію між об'ємом кори нирки та масою тіла та зростом 28. Це дослідження продемонструвало широкий діапазон товщини кори нирок для кожної вікової групи, ймовірно, через різницю в індивідуальній масі тіла та зрості. Однак ця різниця у масі тіла та зрості між кожною віковою групою могла бути усередненою, оскільки поточне дослідження не продемонструвало значної кореляції між товщиною кортикальної нирки та віком.
На закінчення слід сказати, що в нормальній нирці, що не підсилюється контрастом, МРТ SSFP із просторово-селективним ІЧ-імпульсом можна використовувати для оцінки нирково-кортикулярної диференціації та товщини кори без впливу на старіння, хоча оптимальне значення ТІ для найкращої візуалізації нирково-кортикомедулярного з’єднання було скорочено зі старінням.
- 5 документальних фільмів, які змінять вашу думку про їжу
- 5 основних проблем харчування дітей дошкільного віку
- Оцінювальна комісія на півмосту GaN потужністю 400 і 800 Вт - нові промислові продукти
- Віковий зсув вісцерального жиру
- 12 книг, щоб змінити своє життя у 2019 році, зцілюй своє тіло, розум, душу та світ - BexLife від Ревеки