Вибірковий вплив фосфатидилхоліну на лізис адипоцитів
Джи-Янг Кім
1 Відділ біомедичних наук Медичного коледжу Ульсана, Інститут наук про життя Асана, Медичний центр Асана, Сеул, Корея
2 Біомедичний технологічний інститут, Ульсанський університет, Медичний коледж, Сеул, Корея
Мін-Сео Квон
1 Відділ біомедичних наук Медичного коледжу Ульсана, Інститут наук про життя Асана, Медичний центр Асана, Сеул, Корея
2 Біомедичний технологічний інститут, Ульсанський університет, Медичний коледж, Сеул, Корея
Син Джунгюн
3 Кафедра біологічної хімії, Корейський університет науки і техніки, Теджон, Корея
4 Центр допінг-контролю, Корейський інститут науки і техніки, Сеул, Корея
Санг-Вук Кан
1 Відділ біомедичних наук Медичного коледжу Ульсана, Інститут наук про життя Асана, Медичний центр Асана, Сеул, Корея
Пісня Youngsup
1 Відділ біомедичних наук Медичного коледжу Ульсана, Інститут наук про життя Асана, Медичний центр Асана, Сеул, Корея
Концептуалізація: YS JK.
Формальний аналіз: JK YS.
Придбання фінансування: YS.
Розслідування: JK MK HS.
Методологія: YS JK SK.
Адміністрація проекту: YS SK.
Ресурси: JK MK.
Нагляд: YS.
Перевірка: JK MK.
Візуалізація: JK YS.
Написання - оригінальний проект: YS JK.
Написання - огляд та редагування: YS.
Пов’язані дані
Всі наші дані містяться в папері та допоміжних інформаційних файлах
Анотація
Вступ
Більше 30% населення США страждає ожирінням. Це серйозний фактор ризику, який може спричинити або посилити багато метаболічних розладів, включаючи серцево-судинні захворювання, дисліпідемію та діабет. Це також було пов'язано з проблемами психічного здоров'я; спостерігається збільшення поширеності депресії серед пацієнтів із ожирінням [1], що, в свою чергу, негативно впливає на багато аспектів життя і може призвести до порушення соціальної поведінки, розладів харчування та зниження самооцінки [2]. Тому зменшення жирової тканини важливо для вирішення медичних питань, а також для естетичних цілей.
У цьому дослідженні ми використовували як методи in vitro, так і модель in vivo на щурах для порівняння жирознижувальної активності PPC та DC та перевіряли їх адипоцитарну специфічність.
Матеріали і методи
Реагенти
PPC (97,8% чистого поліенового фосфатидилхоліну) та DC натрію (99,1% чистого) були придбані у Lipoid (Lipoid Kosmetik AG, Швейцарія) та NZP (New Zealand Pharmaceuticals, Ltd., Нова Зеландія), відповідно. Формула PPC/DC, показана на рис. 1, містить 5% PPC і 2,4% DC натрію у воді, а розчин DC, показаний на рисунку, містить 2,4% DC натрію. Для обробки PPC та DC у преадипоцитах, адипоцитах та щурах 3T3L1 готували 5% розчини PPC та DC у етанолі та воді відповідно.
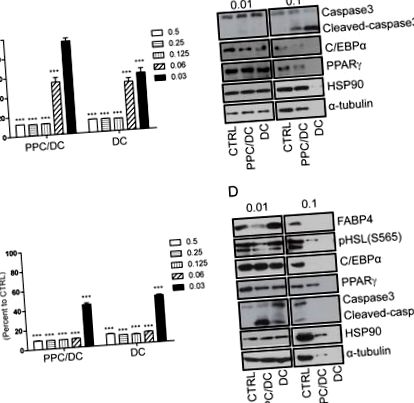
A. Преадипоцит 3T3L1 та життєздатність клітин адипоцитів B. вимірювали через вісім годин після обробки різними дозами формули PPC/DC або DC лише за допомогою тесту МТТ. Зразки білка з преадипоцитів C. 3T3L1 та адипоцитів D. після 0,01% або 0,1% формули PPC/DC або обробки DC протягом восьми годин, були підготовлені та проаналізовані методом Вестерн-блот.
Тварини та експериментальний дизайн
МРТ-аналіз
Було зроблено приблизно 10 знімків, щоб покрити всю область пахової жирової прокладки для кожної тварини до ін’єкції та через 7, 14 та 28 днів після ін’єкції. Після збору всіх зображень проводили сліпий аналіз для вимірювання площі пахового жиру, використовуючи imageJ з порогом інтенсивності жиру (інтенсивності білого), встановленим на 10000.
Культура 3T3L1 та диференціація адипоцитів
Клітинна лінія 3T3L1 культивувалася в мінімальному основному середовищі Дульбекко, доповненому 10% фетальною бичачою сироваткою (HyClone, Logan, UT, США) та 1% пеніциліну-стрептоміцину. Для диференціації адипоцитів 3 × 10 5 клітини 3T3L1 висівали в 12-лункові планшети. Через два дні після посіву адипогенез був індукований переходом на культуральне середовище 3T3L1, доповнене 4 мг/мл дексаметазону, 0,5 мкМ IBX, 0,5 одиниці/мл гумуліну (Lilly, США) та 100 нМ розиглітазону (Рош, Швейцарія). Через два дні після впливу клітин на адипогенне індукційне середовище його замінили свіжим культуральним середовищем 3T3L1, що містить лише 0,5 одиниці/мл гумуліну та 100 нМ розиглітазону. Свіже середовище додавали кожні два дні протягом наступних 5 або 6 днів. Адипогенез визначали за допомогою світлової мікроскопії оцінки утворення ліпідної вакуолі та фарбування Олійно-червоним О.
Аналіз життєздатності клітин
Розчини PPC або DC (5%) розбавляли, отримуючи 1000 × для кожної концентрації, і наносили на культуральне середовище клітин, так що кінцева концентрація розчинника (етанолу для PPC та води для DC), що зазнав впливу на клітини, становила 0,1 % Життєздатність клітин оцінювали за допомогою аналізу МТТ. Коротко кажучи, за день до експерименту 10 × 10 4 клітин висівали в 24-лункові планшети для культури тканин. У день експерименту додавали PPC, DC або контроль (етанол як контроль PPC та воду як DC), як зазначено у легендах на малюнку; за годину до закінчення експерименту застосовували 5 мг/мл МТТ (Duchefa Biochemie, Нідерланди). Клітини промивали PBS, і 150 мкл ДМСО застосовували протягом 15 хв для вилучення барвника. Життєздатність клітин оцінювали шляхом вимірювання поглинання при 565 нм за допомогою планшетного зчитувача (BioTek, США).
Вестерн-блот і антитіла
За день до експериментального дня клітини преадипоцитів 3 × 10 5 3T3L1 висівали в 12-лункові планшети і застосовували формулу PPC/DC, PPC або DC, як зазначено на малюнках. Преадипоцити 3T3L1 диференціювали на адипоцити відповідно до протоколу диференціації адипоцитів, зазначеного вище. Після підтвердження диференціації адипоцитів шляхом візуалізації утворення вакуолі ліпідів за допомогою фарбування Oil Red O, диференційовані адипоцити обробляли формулою PPC/DC, PPC або DC. Зразки білка готували в 120 мкл буфера для лізису (10 мМ Трис (рН 7,4), ЕДТА та 1% SDS з добавкою інгібітора протеїнази (Roche)) на лунку з 24 лунковими планшетами. Для імуноблот-аналізу первинні антитіла до PPARγ, C/EBPα, FABP4, α-тубуліну, HSP90 α/β (Santa Cruz Biotechnology, Inc., Санта-Крус, Каліфорнія, США), PARP, каспази-3 та чутливі до фосфо-гормону використовували ліпазу (HSL) (Cell Signaling Technology, Danvers, MA, USA) та вторинні антитіла для кон'югованих з HRP анти-кролячих або анти-мишачих IgG (Thermo Fisher, США).
Гістологія
Ізольовану тканину щурів негайно фіксували 4% параформальдегідом і вносили у парафін. Зрізи (товщиною 5 мкм) фарбували гематоксиліном та еозином, або імуногістохімічне фарбування проводили з використанням антитіла F4/80 (Abcam, Кембридж, Великобританія) з подальшим застосуванням методу фарбування Авідин-біотин, DAB (Vector Laboratories, Burlingame, Каліфорнія, США).
Аналіз експресії мРНК
Готували загальну РНК, а першу синтезовану кДНК використовували для експресії мРНК, як описано раніше [14]. Коротко кажучи, відразу після розсічення тканину щурів заморожували в рідкому азоті і витримували при -80 ° C для подальшої обробки. Зразки тканин подрібнювали в рідкому азоті, а загальну РНК екстрагували за допомогою реагенту Tri-RNA відповідно до інструкцій виробника. Близько 500 нг загальної РНК було використано для першого синтезу кДНК (Тойобо, Осака, Японія), а експресія мРНК була кількісно визначена за допомогою кількісної зворотної транскрипції-ПЛР (qRT-ПЛР) із сумішшю ПЛР SYBR Green (Тойобо, Осака, Японія). Наступні праймери були використані для специфічної ампліфікації та кількісної оцінки експресії генів за допомогою RT-PCR у реальному часі: EMR1; EMR1-F: 5′-AGGGCCTGGAAGAATCTTGT-3 ′ та EMR1-R: 5′-CGTGTTGATGCAAATGAAGG-3 ′, IL1β; IL1β-F: 5′-AAATACCTGTGGCCTTGGGC-3 ′ та IL1β-R: 5′-CTTGGGATCCACACT CTCCAG-3 ′ та FABP4; FABP4-F: 5′-TCTGGTGAAGCC CAAGATCG-3 ′ та FABP4-R: 5′-CCTCTGGGTTTCCGCCAGTT-3 ′ .
Статистика
PPC має вищу специфічність щодо адипоцитів, ніж DC
Оскільки, здається, формула PPC/DC має вищу ефективність щодо лізису адипоцитів, ніж DC, ми дослідили, чи був PPC активним компонентом, відповідальним за це. Щоб перевірити це, ми провели аналіз життєздатності клітин, порівнюючи індивідуальні ефекти PPC та DC. Ми виявили, що, хоча зниження життєздатності преадипоцитів 3T3L1 при обробці ДК було більшим, ніж те, що спостерігалося при обробці клітин РРС (рис. 2А), життєздатність диференційованих адипоцитів зменшувалася на порівнянну кількість при обробці РРС або ДК (рис. 2B). Ми також спостерігали, що лікування PPC викликало зменшення вакуолей ліпідів, які специфічно виявляються у зрілих адипоцитах, на що вказує зменшена кількість клітин, позитивно забарвлених Олійним Червоним O (S1 Фіг. І S2 Фіг.). Конфокальне зображення живих клітин також показало, що під час восьмигодинного лікування РРС викликав більш сильне зменшення вакуолей ліпідів в адипоцитах порівняно з постійним струмом (рис. 2C та 2D, відеофайли S1 – S4).
Преадипоцит 3T3L1 та життєздатність адипоцитів B. вимірювали через вісім годин після обробки різними дозами PPC або DC за допомогою аналізу MTT. Конфокальні зображення живих преадипоцитів C. 3T3L1 та адипоцитів D., захоплених до (0 год) та восьми годин лікування 0,03% PPC або DC. Білі крапки позначають ліпідні вакуолі зрілих адипоцитів, а восьмигодинне лікування PPC зменшило кількість ліпідних вакуоле-позитивних клітин більшою мірою, ніж лікування DC. Зразки білка з преадипоцитів E. 3T3L1 та адипоцитів F., оброблених 0,01% або 0,03% PPC або DC відповідно протягом восьми годин, готували і експресію преадипоцитів (C/EBPα, PPARγ та HSL) та зрілого адипоциту (C/EBPα, PPARγ, HSL та FABP4) маркери, апоптотичні маркери (відщеплена каспаза3 та розщеплена парп), а також кількість контрольних навантажень (HSP90 та α-тубулін) аналізували за допомогою Вестерн-блоттінгу. Смужка шкали вказує на 20 мкм.
Скорочення жирової тканини за допомогою PPC або DC у моделі щурів
Зображення МР були отримані для вимірювання площі пахової жирової клітковини щурів Спраг-Доулі до (Pre) та 7, 14 та 28 днів після ін’єкції 25 мг PPC (n = 6), 12,5 mg PPC (n = 6 ), 25 мг DC (n = 5) або 12,5 mg DC (n = 5) на одну сторону двосторонньої пахової жирової прокладки та контрольний розчин (етанол для PPC та PBS для DC) на іншу сторону. Дані представлені як відсоток площі пахової жирової прокладки, введеної PPC або DC до контрольної області введеної жирової прокладки.
Ваги двобічно вирізаної тканини, включаючи пахову жирову тканину (IngWAT), епідидимальну жирову тканину (EpiWAT), чотириголовий м’яз та тканини нирок, вимірювали через 30 днів після ін’єкції 25 мг PPC (n = 6), 12,5 мг PPC ( n = 6), 25 мг постійного струму (n = 5) або 12,5 мг постійного струму (n = 5). Дані представлені у відсотках від маси тканини в результаті ін'єкції PPC або DC до маси тканини, отриманої в результаті ін'єкції контрольного розчину.
Ін’єкція постійного струму викликає сильнішу запальну реакцію, ніж PPC
А. Фарбування гематоксиліном та еозином зрізів пахової жирової тканини у щурів через 30 днів після контролю, PPC або ін’єкції постійного струму. Стрілка вказує на інфільтрацію макрофагів, а смуга шкали - 50 мкм. B. Аналіз експресії гена пахової жирової тканини, якій вводять контроль, або 25 мг, або 12,5 мг PPC або DC відповідно. За допомогою qRT-ПЛР у реальному часі відносні рівні експресії FABP4, маркер для зрілих адипоцитів та маркери EMR1, NOS2, CD68, CD80 та IL1β для макрофагів, в паховій жировій тканині, ін'єктованій PPC або DC, порівнювали з експресією в пахова паливна жирова тканина, якій вводять етанол або контрольні розчини PBS відповідно.
Обговорення
Незважаючи на те, що ліпосакція стала широко розповсюдженою та ефективною процедурою зменшення жирових відкладень, вона, як правило, потребує анестезії, і в рідкісних випадках існує ризик медичних ускладнень і навіть смерті. З моменту свого першого застосування в лікуванні ксантелазми, ін’єкція одержуваного з сої КПК виникла як альтернативна процедура зменшення локалізованих жирових відкладень. Насправді кілька клінічних випробувань продемонстрували, що ін'єкція формули, що включає PPC та DC, сприяє зменшенню об'єму жирової тканини [5–7, 16].
Нехірургічні процедури зменшення жиру мають багато переваг, оскільки є економічно вигідними, не потребують анестезії або госпіталізації та не становлять ризику оперування на оперативних шрамах. Однак безпека є найважливішим критерієм застосування як терапевтичного засобу. Ін’єкції постійного струму були пов’язані з багатьма побічними явищами, включаючи біль, набряки, оніміння та набряклість, хоча вони були тимчасовими та обмежувались місцями ін’єкції [17]. Крім того, пацієнти, які отримували ін’єкції постійного струму, скаржились на біль більше, ніж ті, хто отримував формулу PPC/DC [13]. Оскільки жирова тканина безпосередньо пов’язана з нервовою системою [19, 20], біль після лікування PPC/DC може бути спричинений пошкодженням нейронів, опосередкованим DC. Альтернативно, запальна реакція може бути причиною болю, оскільки після лікування постійним струмом спостерігалася посилена інфільтрація макрофагів. Механізм, який лежить в основі цього, ще не з’ясований, і для перевірки потрібні подальші клінічні дослідження, які, можливо, включають підрахунок тривалості та інтенсивності болю після лікування PPC або DC.
Основним обмеженням нашого дослідження була методологія, яка застосовується для приготування рішення PPC. Оскільки PPC погано розчиняється у воді, ми використовували етанол як розчинник. Однак ми використовували лише 0,1% етанолу (1 мкл РРС в етанолі на 1 мл живильного середовища) для обробки преадипоцитів або адипоцитів ППК. При цій концентрації сам етанол не впливав на життєздатність клітин, оскільки зразки, оброблені 0,1% водою (контроль постійного струму) або 0,1% етанолом (контроль РРС), демонстрували порівнянну життєздатність клітин. Крім того, ми порівняли активність клітинної загибелі PPC з такою ж кількістю контролю етанолу. Таким чином, роль PPC в індукції загибелі клітин адипоцитів була остаточно продемонстрована.
Повідомлялося про декілька сприятливих ефектів КПП, включаючи ті, що стосуються лікування гіперліпідемії, деменції та протипечінкового фіброзу [25–30]. Незважаючи на те, що ін'єкція PPC також викликає набряк, наше дослідження показує, що його ефекти є тимчасовими та м'якими, ніж ті, що викликаються постійним струмом. Тому ми пропонуємо PPC бути перспективним агентом для процедур адиподеструкції, оскільки він діє вибірково на адипоцити. Для терапевтичного застосування слід дослідити розробку кращої методології приготування КПП, яка підходить для людини, оптимізація використовуваної дози та інтервалу дозування, а також комбінація з іншими методами лікування [31], яка мінімізує несприятливі ефекти.
- Рейтинг офіційного шкідливого впливу таблеток для схуднення, які не регулюються Fda
- Насичуючий ефект дієт з високим вмістом білка на суб'єктів, які тренуються на стійкість до дефіциту енергії - PubMed
- Nige; s Дієта; Блог про харчування Розриваючись із швів Ожирілі адипоцити буквально вибухають і залишають
- Безкоштовний повнотекстовий полімер Вплив вмісту комономерів на набряклість і механічність
- Reddit - харчування - Думки про надзвичайну дієту kpop idol (чи справжній режим голодування з ефектом йойо)