Варіабельність імунної відповіді, спричиненої PolyIC: наслідки для доклінічних моделей материнської імунної активації
Майло Кареага
кафедра психіатрії та поведінкових наук Каліфорнійського університету, Девіс, США
b Інститут розуму, Каліфорнійський університет, Девіс, США
Сандра Л. Тейлор
c Департамент наук про громадське здоров'я Каліфорнійського університету, Девіс, США
Керолін Чанг
b Інститут розуму, Каліфорнійський університет, Девіс, США
Алекс Чіанг
кафедра психіатрії та поведінкових наук Каліфорнійського університету, Девіс, США
b Інститут розуму, Каліфорнійський університет, Девіс, США
Кетрін М. Ку
кафедра психіатрії та поведінкових наук Каліфорнійського університету, Девіс, США
b Інститут розуму, Каліфорнійський університет, Девіс, США
Роберт Ф. Берман
b Інститут розуму, Каліфорнійський університет, Девіс, США
d Кафедра неврологічної хірургії Каліфорнійського університету, Девіс, США
Джуді А. Ван де Вотер
b Інститут розуму, Каліфорнійський університет, Девіс, США
e Внутрішня медицина, Відділ ревматології, Каліфорнійський університет, Девіс, США
Меліса Д. Бауман
кафедра психіатрії та поведінкових наук Каліфорнійського університету, Девіс, США
b Інститут розуму, Каліфорнійський університет, Девіс, США
f Каліфорнійський національний дослідницький центр приматів, Каліфорнійський університет, Девіс, США
Пов’язані дані
Анотація
Інфікування матері під час вагітності може збільшити ризик розвитку нервово-розвитку у нащадків. Модель доклінічної поліінозинової-поліцитидилової кислоти (PolyIC) стала одним із найбільш широко використовуваних підходів у дослідженнях імунної активації матері (MIA). Однак мінливість молекулярної маси може впливати на імуноактивуючий потенціал PolyIC. Щенята, що народили новонароджених, яким вводили високомолекулярний PolyIC, демонструють виражену цитокінову реакцію та поведінку щодо хвороби, що не спостерігалося у щурів, яким вводили низькомолекулярний PolyIC. Незважаючи на те, що важливим наступним кроком є поширення цих досліджень на вагітних тварин, попередні результати свідчать про те, що молекулярна маса PolyIC є важливим розглядом експериментальної конструкції.
1. Вступ
2. Методи
Усі процедури проводились із схвалення Каліфорнійського університету, Комітету з питань догляду та використання тварин в Девісі та відповідно до керівних принципів, наданих Національним інститутом охорони здоров’я для наукової обробки тварин. Дані доступні за запитом.
2.1. Тварини
Самки щурів Спрег-Доулі (Harlan Sprague-Dawley, Inc., Indianapolis, IN), віком 8 тижнів, утримувались у Службі навчання та досліджень тварин (TRACS) в Університеті Каліфорнії, Девіс. Усі щури були поселені парами у віварії з контролем температури та вологості та підтримувались при кімнатній температурі 22,9 ° C та вологості 53% при 12-годинному циклі світло/темрява (світло світиться о 06:00). Стандартний корпус домашньої клітки складався з поліпропіленових систем житла з індивідуальною вентиляцією (IVC) фірми Lab Products розміром 30,5 см × 35,6 см × 20,3 см із високими кришками з дроту, підстилкою з качанів та гніздом. Тварини-сторожі, які максимально піддаються впливу всіх інших тварин у віварії, є частиною комплексної програми моніторингу здоров’я, що застосовується для виявлення інфекцій, які можуть бути присутніми в колонії. Продовольство та вода забезпечувались за бажанням протягом усього дослідження. Щурам дозволялося звикати до віварію після прибуття з лабораторій Харлана протягом мінімум двох тижнів, перш ніж проводити будь-які процедури.
2.2. КЛЕМИ
CLAMS (Комплексна лабораторна система моніторингу тварин) - це система метаболічних клітин, що дозволяє одночасно вимірювати численні метаболічні параметри, включаючи споживання кисню, вироблення вуглекислого газу, споживання їжі, рівні рухової активності тощо. У приміщенні, де розміщувались CLAMS, підтримували температуру 24 ° C. і 55% вологості. Клітки розміщені в середовищі з контролем світла та температури, що дозволяє користувачеві збирати дані при різних температурах навколишнього середовища. Навколишнє середовище в CLAMS підтримувалося при 24 ° C протягом 12-годинного циклу світло/темрява (світло вмикається о 06:00). Харчування та вода забезпечувались за бажанням. Споживання води, їжі, споживання O2 та вироблення та активність CO2 контролювали протягом 24 годин до та протягом 24 годин після введення Poly IC або введення транспортного засобу. Дані реєстрували у тварин відразу після того, як їх після ін’єкцій знову помістили в CLAMS.
2.3. Імунна активація
2.4. Збір крові
Кров відбирали у щурів у три моменти часу; 3, 4,5 та 6 год після ін’єкції. Щурів окремо виймали з CLAMS і утримували без анестезії, поки 100 мкл крові відбирали з хвостової вени за допомогою голки на 26 г. Температуру вимірювали ректально і реєстрували безпосередньо перед забором крові. Забір крові зазвичай проводився протягом 5 хв. Кров згущували принаймні одну годину, а потім центрифугували при 1000 г протягом 10 хв. Сироватку збирали і зберігали при -80 ° C до аналізу на рівень цитокінів. Зразки часових точок 4,5 год архівували для подальших порівнянь із зразками, відібраними у вагітних щурів після ін’єкцій PolyIC, таким чином, лише 3 години та 6 годин, включені до цього дослідження.
2.5. Аналіз цитокінів
Рівні сироваткових цитокінів IL-1β, IL1-α, IL-2, IL-4, IL-5, IL-6, IL-10, IL-12, IL-13, IL-17, GM-CSF, IFN -γ та TNFα визначали, використовуючи імунологічні аналізи бісеру на щурах (Bio-Rad Laboratories, Геркулес, Каліфорнія). Зразки проводились у двох примірниках відповідно до специфікацій виробника. Всі зразки розводили 1: 4 у розчиннику для зразків, наданому виробником. 50 мкл розведеної сироватки інкубували з кульками, зчепленими з антитілами. Після серії промивань до гранул додавали антитіло до виявлення біотинільованих речовин, і реакційну суміш виявляли додаванням стрептавідин-фікоеритрину. Набори бісеру аналізували за допомогою потокової системи підвісних масивів Luminex ™ 100 (Bio-Plex 200; Bio-Rad Laboratories). Невідомі зразки концентрацій цитокінів розраховували за допомогою програмного забезпечення Bio-Plex Manager, використовуючи стандартну криву, отриману з відомих контрольних концентрацій цитокінів, наданих виробником. Для розрахунку кінцевих концентрацій використовували п'ятипараметричну модель. Концентрації, отримані нижче межі чутливості виявлення (LOD), розраховувались як LOD/2 для статистичного порівняння. Аліквоти супернатанту не мали жодних попередніх циклів заморожування/відтавання. Лише 2% зразків перевищили 15% відхилення від CV та були згодом повторно проаналізовані.
2.6. Статистичний аналіз
3. Результати
3.1. Відмінності цитокінів між групами
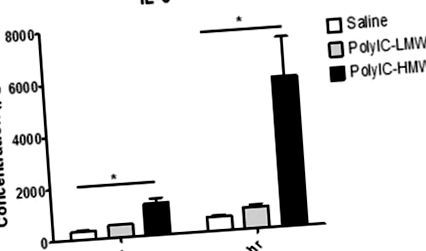
Відповідь IL-6 після ін’єкції PolyIC. Тільки тварини, які отримували HMW-PolyIC, демонструють підвищений рівень IL-6 порівняно з контролем сольового розчину через 3 години та 6 годин після ін’єкції. * P Таблиця 4. Тільки тварини, які отримували HMW-PolyIC, продемонстрували втрату ваги, зміни у споживанні O 2/виробництві CO 2 та зниження поведінки годування та пиття порівняно з тваринами, яким вводили фізіологічний розчин (рис. 3). Тварини, які отримували LMW-PolyIC, не відрізнялися від контрольних. Показники температури та активності тіла не відрізнялися між трьома групами лікування.
Щури, які отримували LMW-PolyIC, не виявляли суттєвих відмінностей у порівнянні з щурами, які отримували лише фізіологічний розчин. Однак щури, які отримували HMW-PolyIC, продемонстрували значні відмінності у (A) втраті ваги (B) у виробництві CO2, (C) споживанні O2, (D) споживанні їжі та (D) споживанні води порівняно з щурами, які отримували сольовий розчин. * P фізіологічний розчин (p Таблиця 1). Виявлено значну взаємодію між групою лікування та часом для IL-6, TNFα, IL-1β та IFN-γ. Як для IL-6 (рис. 1), так і для IFN-γ (рис. 2), тварини, яким вводили HMW-PolyIC, продемонстрували значно вищі рівні порівняно з контролем сольового розчину як через 3 години, так і через 6 годин після ін’єкції. Хоча рівні IL-6 та IFN-γ для тварин, яким вводили LMW-PolyIC, також були вищими, ніж контролі, ці відмінності не були значущими в будь-який момент часу. TNFα та IL-1β (рис. 2) суттєво відрізнялись між тваринами, яким вводили HMW-PolyIC, та контролем в обидва моменти часу, хоча тварини, яким вводили LMW-PolyIC, відрізнялися від контролю лише через 3 години, але не через 6 годин після ін’єкції. Для решти цитокінів, які не продемонстрували значної взаємодії між групою лікування та часом, середні рівні суттєво відрізнялись між тваринами, яким вводили HMW-PolyIC, та контролем, але не між тваринами, яким вводили LMW-PolyIC, та контролем для всіх цитокінів, крім GM-CSF (табл., 3; 3; Додатковий матеріал).
Наші результати вказують на те, що PolyIC з різною молекулярною вагою може викликати істотно різні цитокінові реакції та поведінку при хворобі in vivo, що може сприяти постійним проблемам відтворюваності моделі MIA (Begley and Ioannidis, 2015). Ці результати узгоджуються з попередніми дослідженнями стимуляції клітин (Mian et al., 2013; Zhou et al., 2013), і дають уявлення про можливі механізми, що лежать в основі звітів про варіабельність властивостей імуноактивуючих речовин PolyIC (Harvey and Boksa, 2012). Враховуючи те, що вагітність змінює імунну відповідь матері, важливим наступним кроком є характеристика реакцій цитокінів на HMW-PolyIC та LMW-PolyIC та поведінку хвороби у вагітних тварин. Поки тривають експерименти на грубих тваринах, ми представляємо наші попередні результати, які мають значення для зростаючого поля досліджень моделі MIA, і можуть надати методологічне розуміння, необхідне для підвищення жорсткості та відтворюваності цієї цінної поступальної моделі.
Додатковий матеріал
Додаткові
Подяка
Це дослідження було підтримане пілотними нагородами доктора медицини від Інституту розуму та інвалідності розвитку МІСТ (U54> HD079125) та Центру передового здоров'я Університету Девіса. M.C. була підтримана Програмою підготовки дослідників з питань аутизму UC Davis (T32MH073124) та Центром поліпшення поведінкового здоров’я UC Davis. Автори висловлюють подяку Пітеру Такеучі, Йозефу Рівері та лабораторії фенотипування поведінки щурів у штаті Девіс за їх велику допомогу в роботі з CLAMS та загальним доглядом за тваринами. Ми також хотіли б подякувати Ядерному центру біологічного аналізу Центру досліджень інтелектуальних проблем та розвитку людей з обмеженими можливостями розвитку (IDDRC), зокрема, Лорі Хаапанен, за допомогу в кількісному визначенні цитокінів, а також Біостатистиці, Біоінформатиці та Ядерному проектуванню досліджень за допомогу в статистичний аналіз.
Виноски
Автори заявили, що не існує конкуруючих інтересів.
- Втрата ваги у відповідь на позбавлення їжі передбачає ступінь ожиріння, спричиненого дієтою, у C57BL6J
- Спробуйте план дієти COVID, щоб залишатись здоровими та здоровими з посиленою імунною системою під час блокування здоров’я
- Ці 6 продуктів допомагають знизити вагу та покращують вашу імунну систему
- Імунний еліксир вампірів - цілісний оздоровчий
- Цілющий ефект клізми олії виноградних кісточок з олією кунжуту або без неї в оцтовій кислоті