Троксерутин захищає від DHT-індукованого синдрому полікістозу яєчників у щурів
Виправлення до цієї статті доступне
Ця стаття оновлена
Анотація
Вступ
Синдром полікістозних яєчників (СПКЯ) - це репродуктивна ендокринопатія, поширеність якої, за оцінками, становить 6%
20% (залежно від різних використовуваних діагностичних критеріїв), що робить це найпоширенішим ендокринним станом у жінок репродуктивного віку [1]. Діагностичні особливості СПКЯ включають надлишок андрогену, дисфункцію овуляції та полікістоз яєчників [1]. Ожиріння присутнє у 30–60% хворих на СПКЯ, залежно від країни походження [2, 3]. Найбільш послідовною біохімічною патологією у жінок із СПКЯ є гіперсекреція андрогену, підвищений рівень лютеїнізуючого гормону в сироватці крові та низький до нормального рівня фолікулостимулюючого гормону (ФСГ) у сироватці крові [4, 5]. Моделі тварин, що відображають особливості СПКЯ, є важливими ресурсами для дослідження цього синдрому. Хронічно оброблена 5α-дигідротестостероном (DHT) модель щурів імітує людський фенотип СПКЯ і є придатною моделлю для досліджень щодо СПКЯ.
Вісь гіпоталамус-гіпофіз-гонада (HPG) відіграє центральну роль у вишуканій нейроендокринній регуляції розмноження. Гіпоталамічна секреція гонадотропін-вивільняючого гормону (GnRH) була надійно встановлена як ключовий шлях, який контролює репродуктивну функцію [6]. Аксони нейронів GnRH виступають у серединну височину і вивільняють GnRH, який через гіпофізарну портальну систему потрапляє в передню частину гіпофіза. Передня частка гіпофіза, основна мішень GnRH, реагує на стимуляцію збільшенням секреції ЛГ та ФСГ, що в свою чергу призводить до вироблення стероїдів з яєчників та стимулює генезу та овуляцію фолікулів [7]. Таким чином, GnRH відомий як головний гормон і забезпечує остаточний загальний вихід мережі, що регулює репродуктивну функцію.
На GnRH впливають зовнішні фактори, такі як нейромедіатори та нейропептиди, будь-які зміни регуляторних нейромедіаторів GnRH, такі як гальмівна гамма-аміномасляна кислота (GABA) та стимулюючий глутамат (Glu), можуть призвести до репродуктивної ендокринної дисфункції [8]. Насправді, хронічна ановуляція, характерна для СПКЯ, пояснюється посиленням центрального драйву GnRH та наслідками аберацій гонадотропіну, які, ймовірно, є результатом кумулятивного ефекту зміненого стимулюючого та гальмівного нейромедіатора GnRH в гіпоталамусі та гіпофізі [9]. Кісспептин, а згодом і відкритий нейрінін В (NKB), два нові нейропептиди, що регулюють GnRH, виявилися важливими для нормальної секреції GnRH у людей, потрапили під інтенсивне увагу в останнє десятиліття [10, 11]. Відкрите пов'язане з цим відкриття шляху кспеспетин-/нейрокініну В-/динорфін- (KNDy) ще більше посилило розуміння модуляції секреції GnRH [12]. Нейрони KNDy, що мешкають в області дугоподібного ядра гризунів, коекспресують кісспептин, NKB та DYN [12, 13]. NKB та кісспептин, отримані з KNDy, стимулюють вивільнення GnRH, зв'язуючи рецептор Kisspeptin 1 (Kiss1r) та рецептор нейрокініну 3 (NK3r), експресований на нейронах GnRH [14, 15].
Матеріали і методи
Тваринам і введення троксерутину
Забір крові та тканин
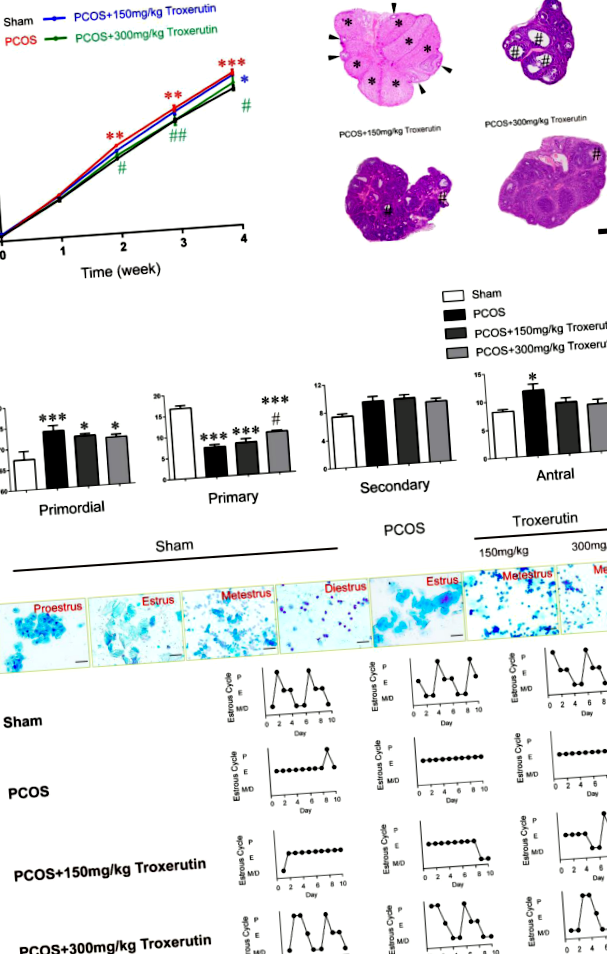
У терміналі дослідження щурів обезголовили, кров стовбура збирали і центрифугували при 3000 об/хв протягом 15 хв. Плазму відокремлювали і зберігали при - 80 ° C до аналізу для біохімічного та гормонального аналізу. Яєчники очищали у фізіологічному розчині та обробляли знежирене. Яєчники фіксували в 10% забуференному формаліні протягом 48 год і вкладали парафін. Зрізи тканини, вкладені в парафін, депарафініровали, розділили на ділянки (6 мкм) і забарвили гематоксиліном та еозином (H&E). Кількість фолікулів класифікували та підраховували у кожному 40-му відділі яєчників по 10 яєчників на групу. Фолікули підраховували згідно з наступним визначенням. Первинний фолікул був оточений одним шаром плоских клітин гранульози. Первинний фолікул містив один шар кубоїдних гранульозних клітин. Вторинний фолікул містив два або більше шарів клітин гранусоли, але антрального простору в шарі гранульози немає. Антральний фолікул демонструє багатошарові клітини гранусоли з наявністю фолікулярного антрального відділу.
Мазки з піхви та естральні цикли
Вагінальні мазки брали щодня о 09:00 з 18-го по 28-й день після першого дня лікування ДГТ, які були кінцевими 10 днів дослідження. Мікроскопічний аналіз (BX41, Olympus) проводили для визначення стадії еструального циклу за переважаючими типами клітин у вагінальних мазках після фарбування метиленовим синім (Solarbio, Пекін). Проеструс складається із збільшених, круглих, ядерних клітин епітелію; еструс складається з великої кількості ороговелих плоскоклітинних клітин; метеструс складається з двох видів клітин: епітеліальних клітин та лейкоцитів із приблизно однаковим вмістом; і діеструс характеризується невеликою кількістю клітин з переважанням лейкоцитів.
Вага тіла, біохімічний та вестерн-блот-аналіз
Вагу тіла вимірювали щотижня після імплантації протягом 4 тижнів.
Концентрацію ЛГ, ФСГ та тестостерону в сироватці крові вимірювали за допомогою імуноферментного аналізу (ELISA) за допомогою комерційних наборів (набір ELISA, CUSABIO, Inc., м. Ухань, Китай) і дотримувались процедури, наведеної в каталозі наборів. . Концентрацію ЛГ, ФСГ і тестостерону оцінювали за стандартною кривою.
Для виявлення статусу гіпоталамусу GnRH гіпоталамус розтинали. Мозок щура обережно виймали і тимчасово клали на лід черевною поверхнею вгору. Таламус - це еліпсоїдальна частина в центрі черевного мозку. З серединою бульби кинереуму та хіазмою зорового нерва як центром, прехіазмальною межею як переднього краю, постміммілярною межею як заднього краю, ретельно розсікали гіпоталамус (4х4х2 мм). Тканину гіпоталамуса гомогенізували для отримання зразків білка. Потім білок (25 мкг) відокремлювали SDS-PAGE і переносили в мембрани. Мембрани інкубували з мишачими моноклональними антитілами до GnRH (1: 1000, MAB5456-C, Millipore, Billerica, MA) та мишачими анти-GAPDH антитілами (1: 20000, Proteintech, Чикаго, США). Після триразового промивання TBST мембрани інкубували з міченими IRDye вторинними антитілами в TBST протягом 2 годин. Смуги на мембрані сканували за допомогою інфрачервоного сканера Odyssey (LI-COR Biosciences, Лінкольн, Небраска, США), а щільність смуг аналізували за допомогою програмного забезпечення ImageJ.
Хроматографічний аналіз
Імунофлуоресцентне фарбування
Після внутрішньосерцевої перфузії звичайним фізіологічним розчином з наступною фіксацією 4% холодним параформальдегідом (PFA) мозок щурів відокремлювали та фіксували в 4% PFA протягом 6 год при 4 ° C. Потім мозок інкубували у 30% сахарозі - 100 мМ фосфатному буфері натрію (рН 7,4) протягом 48 год при 4 ° С. Серійні корональні зрізи (20 мкм) були зроблені від брегми спереду-ззаду - від 2,0 мм до - 3,30 мм. Всього було зібрано 60 секцій на один мозок. Для імунофлюоресцентного фарбування NKB, Kisspeptin, GnRH/NK3R та GnRH/Kiss1r було обрано принаймні три ділянки на мозок.
Для імунофлюоресценції первинні антитіла кролячі анти-NKB (1: 1000, Novus biology, NB300–201), кролячі антикісспептини (1: 1000, H-048-56, Phoenix Pharmaceuticals), кролячі anti-Kiss-1r (1: 500, AKR-001, Alomone Labs), використовували кролячий анти-NK3r (1: 500, abx217136, Abbexa) та мишачий анти-GnRH (1: 1000, MAB5456-C, Millipore, Billerica, MA). Після інкубації з антитілами протягом 24 годин при 4 ° C зрізи промивали PBS, а потім обробляли козячим антимиша IgG (H + L) Alexa Fluor®555 або 488-кон'югованим або козячим IgG проти кроликів (H + L) вторинні антитіла Alexa Fluor®488 (Invitrogen, Eugene, OR, USA). Згідно з інструкціями виробника, для маркування ядра використовували DAPI (Beyotime Biotechnology, Шанхай, Китай). Для негативного контролю зрізи інкубували з PBS замість первинних антитіл. Зображення флуоресценції були зроблені за допомогою мікроскопа Zeiss Axioskop 40 (Carl Zeiss, Оберкохен, Німеччина). Програмне забезпечення Image Pro-Plus 6.0 було використано для напівкількісного вимірювання імунофлуоресцентної щільності. Значення (три слайди для кожного мозку) інтегральної оптичної щільності (IOD) в окремих клітинах представляли кількість цільового білка і були розраховані за допомогою наступного рівняння: Σ IOD/Σ DAPI.
Статистичний аналіз
Всі статистичні аналізи проводили за допомогою програмного забезпечення SPSS (версія 16.0), а дані аналізували за допомогою одностороннього дисперсійного аналізу (ANOVA). Дані були виражені як середнє значення ± s.e.m. Статистичне значення було встановлене P
Результати
Троксерутин знижував масу тіла, покращував патологічну морфологію та функції яєчників у щурів СПКЯ
Спочатку ми дослідили, чи введення троксерутину впливає на масу тіла на моделях ДГТ-індукованих СПКЯ. Проілюстровано часовий курс прийому троксерутину та оцінку фенотипів (рис. 1). Вагу тіла окремої тварини зважували щотижня після імплантації ДГТ протягом 4 тижнів. Вага тіла на початковому рівні та на 1-му тижні не показав значної різниці серед усіх груп. ДГТ-оброблені щури показали значно більшу масу тіла на 2-му (P Рис. 1
Троксерутин змінив ненормальний рівень гонадотропіну та тестостерону в сироватці крові у щурів СПКЯ
Рівні ЛГ, ФСГ та тестостерону в сироватці крові вимірювали на четвертому тижні методом ІФА (рис. 2). Щури СПКЯ продемонстрували значне збільшення рівня ЛГ та тестостерону в сироватці порівняно з підставними щурами (P Рис.2
Троксерутин інгібував підвищений рівень GnRH у щурів СПКЯ
Походження змін ЛГ та ФСГ часто частіше лежить на рівні гіпоталамусового ГнРГ, який відіграє ключову роль у стимулюванні вивільнення гіпофіза гонадотропіну, таким чином ми додатково виявили сироватковий та гіпоталамо-гіпофізарний статус ГнРГ. Як показано на рис. 3, результати вестерн-блоттінгу показали підвищення рівня GnRH в гіпоталамо-гіпофізі щурів СПКЯ (P Рис.3
Троксерутин змінив регуляторні нейромедіатори GnRH в гіпоталамусі щурів СПКЯ
На GnRH можуть впливати регуляторні нейромедіатори, такі як основний інгібуючий GABA та стимулюючий Glu. Як показано на рис. 4, рівні нейромедіаторів у гіпоталамусі показали значну різницю серед певних груп. Точніше кажучи, у щурів СПКЯ спостерігався помітно низький рівень ГАМК (P Рис.4
Троксерутин знижував експресію Kisspepetin1/Kiss1r та Neurokinin B/NK3r в гіпоталамусі
Кісспептин і NKB, що секретуються з нейронів KNDy в ARC, вважаються новими нейромедіаторами, що стимулюють GnRH, та стимулюють експресію рецептора кісспептину (kiss1r) та рецептора нейрокініну B (NK3r) нейронів GnRH в медіанній висхідності (ME). Тут ми провели імунофлюоресцентне фарбування, щоб спостерігати, чи введення троксерутину змінює експресію кісспептину/kiss1r та NKB/NK3r у відповідних регіонах (рис. 5 та рис. 6). IOD позитивних клітин в ARC помітно збільшився у щурів СПКЯ порівняно з фіктивними щурами (P Рис.5
Обговорення
Імпульси GnRH стимулюють синтез та секрецію ЛГ та ФСГ із передньої частини гіпофіза. Загальновідомо, що хоча синтез ЛГ і ФСГ виробляється в одній клітині з назвою гонадотроф, регулюється різною частотою імпульсів GnRH, причому ЛГ сприяє швидким частотам імпульсів (> 1 імпульс на годину), а ФСГ сприяє повільним частотам імпульсів (
Висновки
Взяті вище, ці результати показали, що захист троксерутину від СПКЯ частково може бути обумовлений його здатністю регулювати гіпоталамічний GABA, Glu, кісспептин/kiss1r та NKB/NK3r. Незважаючи на те, що залишається визначеним, чи є ця зміна, спричинена троксерутином, постійною, це дослідження підкреслило його терапевтичний потенціал для СПКЯ. Потрібні будуть більш глибокі дослідження, щоб визначити, чи є троксерутин, націлений лише на нейромедіатори гіпоталамусу, перспективним терапевтичним підходом для лікування СПКЯ.
Наявність даних та матеріалів
Набори даних, використані та/або проаналізовані у цьому дослідженні, доступні у відповідного автора за обґрунтованим запитом.
- Оновлення синдрому полікістозних яєчників нові критерії діагностики та лікування в Японії
- СИНДРОМ WILKIE S РІДКИЙ ПРИЧИНОЮ КОРИСТАННЯ КИШКІВ
- Тонкошкірна тектоніка SpringerLink
- Варикозне розширення вен на сідницях - Питання лікування синдрому тазової конгестиї; Відповіді
- Синдром хиткого їжака VCA Лікарня для тварин