Токсин холери
Токсин холери (КТ) більш ніж на 80% гомологічний LT, а вакцинація вакцинами на основі субодиниць CT-B (CT-B) викликає захисну імунну відповідь проти штамів ETEC, що продукують LT.
Пов’язані терміни:
- Епітеліальні клітини
- Аденилілциклаза
- Ейкозаноїдний рецептор
- Ферменти
- Циклічний монофосфат аденозину
- Антиген
- Білок
- ДНК
- Клітинна мембрана
Завантажити у форматі PDF
Про цю сторінку
Том 2
64.2.1.2.1.1 Рецептор КТ
Бактеріальні токсини та їх вуглеводні рецептори на межі поділу хазяїн-збудник
Кліффорд А. Лінгвуд, Радіа Мафуд, у галузі мікробної глікобіології, 2010 рік
1.1. Токсин холери та дизентерія
Використання ендоцитарних шляхів для запобігання бактеріальній токсинній інфекції
Токсини, що зв’язують ліпіди
Токсин АВ, токсин Шиги, також локалізується на ліпідних плотах через зв'язування з глікосфінголіпідом, Gb3. Подібно КТ, токсин Шига може також потрапляти в клітини за кількома шляхами, включаючи використання як клатрин-залежних, так і незалежних механізмів для ретроградного транспорту [33]. Варто зазначити, що токсин Шига також здатний викликати власну інтерналізацію, створюючи в мембрані інвагінуючі канальці, які згодом відщеплюються від плазматичної мембрани за допомогою актино- та холестеринозалежного процесу [31,32]. Незалежний від клатрину шлях, що експлуатується токсином Шиги, нещодавно був детально описаний [54]. Ендофілін-А2 утворює риштування на інвагінаціях токсинів Шиги і поряд з актином та динаміном бере участь у розщепленні цих канальців із плазматичної мембрани [54] .
В цілому, бактеріальні токсини є досить опортуністичними щодо того, як вони потрапляють до клітин, і пошук одного або суміші відповідних інгібіторів для запобігання поглинанню цих токсинів може виявитися складним завданням.
Оптичне біологічне виявлення за допомогою рецепторів та ферментів (з порфірином)
9.7 Зв’язування холерного токсину
Токсин холери (КТ) - це ентеротоксин AB 5, що виробляється холерним вібріоном, і відповідає за прояви захворювання. У кількох публікаціях вказується, що токсин зв'язується з глікопротеїном і що B-ланцюг зв'язується з гамліозидним пентасахаридом GM1 на клітинній поверхні (Chigorno et al., 1982; Critchley et al., 1979; Critchley et al., 1981; Critchley et al., 1982; Cuatrecasas, 1973b; Cuatrecasas, 1973a; Eidels et al., 1983; Fishman et al., 1978; Kuziemko et al., 1996; Masserini et al., 1992; Singh et al., 2000; Van Heyningen, 1983 ). Сонг і Свонсон (Song et al., 1998; Song and Swanson, 1999) розробили механізм виявлення КТ, заснований на перенесенні енергії флуоресценції флуорофора, пов'язаного з GM1, з виявленням до 0,5 нМ. Куземко та ін. (1996) показали спорідненість до зв'язування та специфічність кількох гангліозидів до КТ. В основному це взаємодії цукор-білок. Ключовим аспектом цих інгібіторів є те, що сайт зв'язування галактози СТ-зв'язуючого рецептора GM1 подібний до місця, що виявляється у фетуїні, GMP та лактоферині. Вони можуть використовуватися як рецептори.
Мерріт та ін. (1994) опублікували кристалічну структуру B-пентамера, зв’язаного з гангліозидом GM1, виявленим на поверхні епітеліальних клітин кишкового тракту людини. Спорідненість КТ до інших гангліозидів наведено Kuziemko та співавт. (1996). Зв'язування КТ з рецепторами гангліозидних мембран було показано ще в 1973 р. Cuatrecasas (Cuatrecasas, 1973b; Cuatrecasas, 1973a).
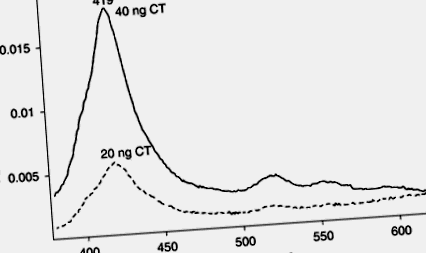
Ми можемо іммобілізувати GM1 на аміноконцевую поверхню предметних стекол Probe-On (tm). Ми також можемо включити тетраамінофенілпорфірин порфірину в гангліозид через –NH- в основі хвостів жирних кислот, використовуючи утворення глутаральдегіду/Шиффа. Коли зв'язується субодиниця В CT, спостерігається спектральна зміна порфірину, як показано на рис. 9.8. Як видно на рис. 9.9, межа виявлення нижче 20 нг КТ. Ми також змогли виявити КТ на рівні 10 нг за допомогою тетра-амінофенілпорфірину, зв'язаного з галактозаміном (дані не наведені).
9.8. Різничні спектри тетра-амінофенілпорфірину, включеного в іммобілізований GM1 у присутності мінус відсутність холерного токсину (КТ).
9.9. Зміна поглинання 419 нм як функція концентрації холерного токсину.
Альтернативні методи доставки вакцини
Брюс Г. Венігер, Марк Дж. Папанія, у розділі «Вакцини» (шосте видання), 2013 рік
Токсини
Токсин холери (КТ) та термостійкий токсин кишкової палички є потужними ад'ювантами, але в природних формах вони можуть бути занадто токсичними для деяких видів використання у людей (див. "Бактеріальні екзотоксини", раніше). 1053, 1057–1062 LT ад’ювант у комерційній швейцарській вакцині проти грипу для введення ІН був підозрюваний як причина багаторазового збільшення ризику паралічу Белла після вакцинації, що призвело до виведення вакцини з ринку у 2001 р. 46, 47 Хоча патогенез впливу вакцини на сьомий черепно-мозковий нерв невизначений, гілки нерва проходять біля носа. Інші несприятливі неврологічні ефекти КТ та ЛТ були висунуті на підставі їх накопичення в нюхових цибулинах мишей BALB/c після назального введення, іноді з одночасним запаленням. 1063 Як результат, нещодавні ад'ювантні дослідження були зосереджені на субодиницях, детоксифікованих версіях та інших варіантах КТ та ЛТ. 1064–1081 Деякі з них, такі як CTA1-DD, не накопичуються в нюховій цибулині мишей BALB/c. 1082
Холерний вібріон
Токсин холери
Потрапляючи в цитозоль, CtxA1 локалізується на цільовому білку, регульованому G-білком аденилілциклазі, розташованому на базолатеральній мембрані. CtxA1 моно-АДФ рибозилати Gsα, субодиниця цільового білка, що ініціює конститутивну дію та, як наслідок, збільшення внутрішньоклітинного цАМФ [130]. Це спричиняє секрецію аніонів у клітинах крипти, головним чином хлориду через апікальні канали CFTR, та гальмування нейтрального всмоктування хлориду натрію в клітинах ворсин, що призводить до загальної масивної секреції рідини в тонку кишку [131]. Під час транзиту через кишечник об’єм рідини значно перевищує нормальну реабсорбційну здатність товстої кишки, і при виході з організму рідина містить велику кількість натрію, хлориду, бікарбонату та калію з невеликою кількістю клітин [132]. .
Аксональні транспортні індикатори
Субодиниця токсину холери В
Холерний токсин (КТ) - це бактеріальний токсин бактерій, що виробляється холерним вібріоном, який з високою спорідненістю зв'язується з клітинними мембранами. КТ складається з активної субодиниці (А), яка індукує токсичність, безперервно активуючи стимулюючі G-білки (Gs), тим самим збільшуючи циклічний рівень аденинмонофосфату, та гомопентамерну зв'язуючу субодиницю (B). Субодиниця В (CTB) зв'язується з монозіалогангліозидом GM1, який скупчений у мембранних мікродоменах на плазматичній мембрані різних типів клітин, включаючи нейрони. Після зв’язування на нервовому кінці КТ стає інтерналізованим в ендоцитарні пухирці, а потім зазнає ретроградного транспорту (зі швидкістю 102 мм на добу -1). Рекомбінантний CTB підтримує специфічне зв'язування CT повного зросту і є повністю атоксичним, що є ідеальним транспортним зондом. Вперше CTB використовували як ретроградний індикатор, але нещодавно було виявлено, що він також є дуже чутливим антероградним транспортним маркером, який дає чітке визначення нейрональних відростків та нервових кінцевих елементів. Застосування субодиниці CTB здійснюється або за допомогою іонофорезу, або за допомогою ін'єкції тиску в область, що цікавить. Потім клітинне мічення може бути виявлено за допомогою флуоресцентного або біотинільованого вторинного антитіла або за допомогою флуоресцентно-кон'югованого CTB.
Розглянуті вище приклади антероградних та ретроградних транспортних індикаторів добре відомі та широко використовуються. Однак їх транспорт, а отже і маркування, обмежується нейронами, де відбувається їх поглинання, що значно обмежує їх здатність наносити карту нейрональних ланцюгів. Транссинаптичні індикатори обходять це обмеження, поширюючись від початкових нейронів до синаптично пов’язаних нейронів другого та третього порядку, забезпечуючи тим самим інформацію про нейронні зв’язки.
Вакцини в теорії та практиці
Бактеріальні ентеротоксини
Токсини холери (КТ) та нестійкі до нагрівання (LT) ентеротоксини, пов’язані з Е. coli, тісно пов’язані між собою і викликають холеру та діарею мандрівників відповідно. Ентеротоксини є корисними ад'ювантами, які збільшують презентацію антигену та диференціювання В-клітин у плазматичні клітини, що продукують sIgA. Обидва вони мають обмежену корисність через генерацію сильної імунної відповіді на ентеротоксини. Суттєві проблеми безпеки пов'язані з використанням інтактних ентеротоксинів як ад'ювантів. Обидва вони дуже токсичні та викликають діарею, параліч Белла та інші неврологічні ефекти.
Новий ад'ювант злитого білка зменшує токсичність, пов’язану з ентеротоксинами. Злитий білок складається з α1-субодиниці холерного токсину (CTA), злитого з молекулою, спрямованою на В-клітину (D) з білка A. Staphylococcus aureus. Ад'ювант CTA1-DD є нетоксичним при введенні інтраназально або парентерально. Він діє, збільшуючи вироблення секреторних IgA та IgG.
Шлунково-кишкова хвороба, пов’язана з токсинами
Патогенна дія бактеріальних токсинів
Кілька інших бактеріальних токсинів мають подібний вплив на аденилатциклазу і відповідають за підвищення рівня внутрішньоклітинного цАМФ в клітинах епітелію кишечника. Сюди належать термостійкі та термостійкі ентеротоксини ентеротоксигенної кишкової палички (або ETEC). Багато штамів ETEC продукують одне з двох споріднених сімейств термостійких ентеротоксинів, відомих як LT-I та LT-II. Ці токсини структурно та ферментативно пов’язані з холерним токсином і спричиняють холероподібну водянисту діарею [1,2]. Інші кишкові патогени (наприклад, Aeromonas hydrophila, Pleisiomonas shigelloides) також показали, що виробляють холеротоксиноподібні теплонестійкі ентеротоксини, що беруть участь у патогенезі [4]. Термостійкі токсини кишкової палички (ST) - це сімейство невеликих пептидів (18–19 амінокислот), які протистоять денатурації та втраті активності навіть при кип’ятінні протягом 15 хвилин. ST є більш поширеним, ніж LT, у людських ETEC, включаючи штами, які продукують як LT, так і ST. Послідовність амінокислот ST нагадує послідовність гуаніліну, нормального пептидного гормону кишечника, який регулює секрецію хлориду шляхом зв'язування та активації твердих частинок гуанілатциклази, яка перетворює GTP на цГМФ. Крім того, ST, як видається, діє за допомогою інших механізмів, щоб зменшити неелектрогенне поглинання NaCl.
Чи є життєздатні ГТО для лікування нейродегенеративних розладів та поліпшення психічного здоров’я?
Бернд Ніліус, Арпад Салласі, у каналах ГТО як терапевтичні цілі, 2015
Аутоімунний енцефаломієліт та розсіяний склероз
Токсин холери -В зв'язується з розгалуженим пентасахаридним фрагментом гангліозиду, GM1. Ця взаємодія білок-гангліозид має важливе значення для ініціювання шляху передачі сигналу, який відповідає за діарею. При мишачому експериментальному аутоімунному енцефаломієліті (ЕАЕ) корисно введення одиниці зшивання GM1 холерного токсину (так званий B-токсин). Холерний токсин-В є партнером, що зв'язує ендогенний лектин, галектин-1. У цих тварин як холерний токсин-В, так і галектин-1 викликали симптоматичне поліпшення. І навпаки, миші, у яких відсутній GM1, демонструють підвищену сприйнятливість до EAE. Поліклональна активація мишачих регуляторних Т (Treg) клітин підвищує регуляцію галектину-1. Крім того, активація CD4 + та CD8 + ефекторних Т (Teff) клітин підвищує GM1. Важливим для теми цього розділу є те, що активація клітин Teff також регулює TRPC5, який, у свою чергу, опосередковує приплив Са 2 + на зшивання GM1 або галектином-1, або холерним токсином-В. Нокдаун shRNA Trpc5 у клітинах Teff блокує контактно-залежне інгібування проліферації клітинами Treg. Ці спостереження свідчать про роль TRPC5 у негативному контролі (придушенні) аутоімунітету [165].
Розсіяний склероз (РС) - це хронічний, невблаганно прогресуючий демієлінізуючий розлад. Хоча патогенез РС невідомий, вважається, що посилене вироблення глутамату відіграє певну роль у нейродегенеративному процесі, спричиненому запаленням. На підтвердження цієї гіпотези, лікворна хвороба, зібрана у хворих на РС, посилює набряк нейронів, опосередкований глутаматом, за допомогою механізму, який, як видається, включає як сигналізацію IL-1β, так і посилення стимуляції AMPA-R. Дійсно, IL-1β значно вищий у лікворі у пацієнтів з активною РС. Було висловлено гіпотезу, що TRPV1 є важливим посередником синаптичної дії IL-1β на центральні глутаматергічні синапси [166]. Відповідно до цієї гіпотези, на мишачій моделі нульових тварин EAE Trpv1 спостерігається знижена інфільтрація ЦНС аутореактивними Т-клітинами [167]. У пацієнтів з РС помилковий SNP у гені TRPV1 корелював з ризиком прогресуючого захворювання [167]. У сукупності ці висновки визначають TRPV1 як потенційну нову терапевтичну мішень у пацієнтів із РС.
- Сушені трави - огляд тем ScienceDirect
- Head Blight - огляд тем ScienceDirect
- Шлунково-кишкова моторика - огляд тем ScienceDirect
- Фенофібрат - огляд тем ScienceDirect
- Стислий газоподібний водень - огляд тем ScienceDirect