Журнал рідкісних розладів: діагностика та терапія
1 Клініка медичної генетики, Дитяча лікарня Столлері, Едмонтон, Альберта, Канада
2 Програма з генетики та метаболізму, Регіональний орган охорони здоров'я Вінніпега та Університет Манітоби, Вінніпег, Манітоба, Канада
3 Кафедра біохімії та медичної генетики, Університет Манітоби, Вінніпег, Манітоба, Канада
4 Кафедра медичної генетики, Монреальська дитяча лікарня, Центр охорони здоров'я університету Макгілла, Монреаль, Квебек, Канада
5 Департамент медичної генетики, Університет Альберти, Едмонтон, Альберта, Канада
* Автор-кореспондент: Шайлі Джейн
Клініка медичної генетики, 8-53 корпус медичних наук, лікарня Університету Альберти
Дмонттон, AB, Канада T6G 2H7
Тел .: 1- (780) 407-7333
Електронна пошта: [електронна пошта захищена]
Цитування: Ghai SJ, Skinner S, et al. Сумісна делеція гена хромосоми Xp у трьох сім'ях, що охоплює гени OTC, RPGR та TSPAN7. J Рідкісний Dis Diagn Ther. 2015, 1: 1. doi: 10.21767/2380-7245.10003
Анотація
Дефіцит орнітинтранскарбамілази (OTCD) є найпоширенішим розладом циклу сечовини. Класична презентація у чоловіків - гіперамоніємічна енцефалопатія в ранньому неонатальному періоді. З огляду на Х-зчеплене успадкування OTCD, вигляд у жінок дуже мінливий. Ми представляємо три родини з різними суміжними делеціями гена на хромосомі Xp. Видалення RPGR, OTC та TSPAN7 є загальним для всіх трьох сімей в нашій серії. Ці випадки підкреслюють мінливий фенотип у виявленні носіїв жіночої статі OTCD, складність управління OTCD та складні проблеми, пов’язані з можливістю трансплантації печінки, коли багато інших генетичних факторів відіграють роль.
Ключові слова
Орнітин-транскарбамілаза; Дефіцит орнітину транскарбамілази; Сумісна делеція гена; Позабіржовий; RPGR; TSPAN7
Скорочення
CGH: порівняльна геномна гібридизація; ЕРТ: безперервна замісна ниркова терапія; MLPA: Мультиплексне підсилення зондом, залежне від лігування; OTCD: дефіцит орнітину транскарбамілази; Безрецептурні: Орнітин-транскарбамілаза SNP: Поліморфізм одиничного нуклеотиду
Вступ
Цикл сечовини функціонує для перетворення аміаку, побічного продукту розпаду білка, в сечовину, яка може безпечно виводитися організмом. Найбільш поширеним розладом циклу сечовини, дефіцитом орнітину транскарбамілази (OMIM 311250) (OTCD), є Х-зчеплений стан із частотою 1: 14000 [1]. Більшість чоловіків з OTCD мають ранню неонатальну гіперамоніємічну енцефалопатію, яка схильна до неврологічних образ та ранньої смерті. Застосування ниркового гемодіалізу або еквівалентів, препаратів для збору аміаку, синтетичних сумішей та обмеження дієтичних білків може забезпечити виживання у грудному віці, після чого можна розглянути питання про трансплантацію печінки. Щодо гетерозиготних жіночих носіїв, приблизно 20% мають симптоми, починаючи від гіперамоніємічної енцефалопатії новонароджених та закінчуючи поведінковими змінами у дорослих та когнітивними затримками [2,3].
Поєднання гіперамонемії, підвищеного рівня глютаміну в плазмі та підвищеної оротової кислоти в сечі на додаток до можливого зниження вмісту цитруліну в плазмі крові призводить до підозри на OTCD. Для діагностичного підтвердження можна провести аналіз печінкових ферментів; однак це технічно складно. Таким чином, підтвердження найчастіше досягається молекулярним аналізом; і вважається золотим стандартом тестування у жінок та в пренатальних випадках [4]. Мутації виявляються лише приблизно у 80% усіх випадків позабіржової торгівлі [5]. З них понад 80% становлять міссенс або безглузді мутації [6], а 10-15% можуть бути пов’язані з частковою або повною делецією генів [7]. З використанням масиву CGH, MLPA та масиву SNP масиву описано безліч суміжних делецій генів, що включають OTC-ген [4, 8-13].
Ми описуємо три неспоріднені сімейства з різними суміжними делеціями гена в хромосомі Xp. Видалення RPGR, OTC та TSPAN7 є загальним для всіх цих сімей. Ми підкреслюємо вплив делецій багатьох генів, що оточують позабіржовий локус, на остаточний фенотип OTCD та його управління.
Клінічний звіт
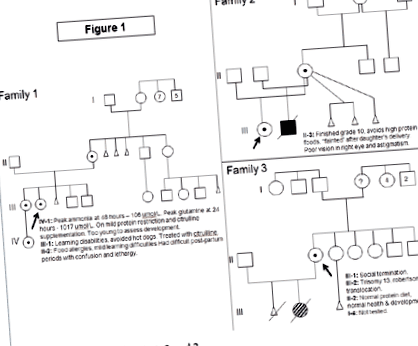
Сім'я 1 (Фігура 1)
Індекс випадків, жінки, представлений у віці 12 років із маренням, блювотою, слабкістю та втратою ваги. Дослідження при діагностиці показали: аміак 242 ммоль/л (норма 5-35 ммоль/л), глютамін 2000 ммоль/л (норма: 450-750), цитрулін 25 ммоль/л (1-40), орнітин 103 ммоль/л ( 50-100), але оротової кислоти не було підвищено. У минулому в анамнезі виявлено затримку розвитку, зафіксовану у віці 8-12 місяців. У неї була тенденція до періодичної блювоти, головних болів, млявості та ненормальної поведінки, які покращувались, уникаючи м’ясних та молочних продуктів. У неї була вроджена гіпоплазія зорового нерва. У 12 років вона функціонувала на рівні 3-4 років. МРТ головного мозку показала атрофію кори в лівій лобовій області. З моменту встановлення діагнозу лікування включало обмеження дієтичного білка, доповнене формулою циклінексу, фенілбутиратом натрію та L-цитруліном. Наразі їй 24 роки, вона має когнітивні затримки, не має виконавчих функцій і не може жити самостійно. З моменту встановлення діагнозу її найвищий вміст аміаку становив 406 ммоль/л, але глутамін ніколи не перевищував 2000 ммоль/л. Вона неодноразово приймалася через гіперамоніємічну енцефалопатію, але не має інших медичних ускладнень.
Фігура 1 Родоводи для сім'ї 1, 2 та 3.
Її старша сестра мала труднощі з навчанням і була "сварливою" під час менструацій. Вона уникала хот-догів, які викликали головний біль і блювоту, але переносила (інші) продукти з високим вмістом білка. Її дослідження при діагностиці показали: аміак 27 момоль/л, глутамін 1100 момоль/л, цитрулін 6 момоль/л, орнітин 125 ммоль/л. Добавки L-цитруліну були її єдиним методом лікування. З моменту встановлення діагнозу її пік аміаку становив 95 ммоль/л, а глутамін ніколи не перевищував 1100 ммоль/л. Нещодавно у неї були випадки вагітності та пологів, пік аміаку після пологів становив 64 мкмоль/л, а глютаміну - 852 ммоль/л.
Сім'я 2 (Фігура 1)
Індекс випадків, жінки, представлений у віці 7 місяців із зворотом спини та аномальною ЕЕГ. При постановці діагнозу аміак становив 388 мкмоль/л, орнітин 32 мкмоль/л, цитрулін не виявляється, глютамін 1112 ммоль/л з підвищеною оротовою кислотою. У минулому в анамнезі спостерігалися періодичні епізоди блювоти, починаючи з двотижневого віку, відмова від процвітання та затримка розвитку. МРТ головного мозку показала патологічну мієлінізацію з мікроцефалією та атрофією. У віці 10 років у неї не було судом, але вона суттєво затримується у розвитку. У неї також є ністагм, амбліопія, короткозорість і двосторонні тонкі зорові нерви. Її сучасне лікування полягає у обмеженні білка, доповненому формулою Циклінекс, L-цитруліном та фенілбутиратом натрію.
У наступній вагітності її мати відмовилася від пренатальної діагностики і народила хлопчика. Його аміак постійно збільшувався і становив 512 ммоль/л до 2-го дня життя, що вимагало проведення ЕРТ (діаліз). Пізніше він отримував дієту з обмеженим вмістом білка, L-цитрулін, фенілбутират натрію та формулу Циклінекс. У нього не вийшло процвітати до 4-місячного віку, оскільки випробування щодо збільшення харчового білка призвели до гіперамонемії. У 12 місяців він мав захворювання печінки (гіпоальбумінемія, набряки, асцит та легка коагулопатія), гіпотиреоз, періодична потреба у переливанні pRBC, недостатність росту, затримка розвитку (функціонувала на 2-3-місячному рівні) та шкірні висипання. В цей час випробування з підвищеним вмістом білка (1 - 1,2 г білка/кг/день) переносилися без виникнення гіперамонемії, але нормалізація білкового статусу не призвела до поліпшення загальної клінічної картини. Рівень аміаку не досяг піку вище рівня, встановленого при постановці діагнозу. Він став залежним від вентиляції і не вважався кандидатом на трансплантацію печінки. Він помер через поліорганну недостатність у віці 14 місяців.
Сім'я 3 (Фігура 1)
У випадку з індексом 24-річна жінка, яка не мала проблем зі здоров’ям чи проблемами розвитку, народила дівчинку. У цієї дитини була трисомія 13 через Робертсонівську транслокацію. Цитогенетичні дослідження випадку індексу та її партнера були нормальними щодо транслокації, але випадково виявили делецію Х-хромосоми у випадку індексу. На момент встановлення діагнозу аміак у неї був нормальним: глютамін 487 ммоль/л, цитрулін 19 мкмоль/л та аргінін 74 ммоль/л. Вона не обмежувала дієтичний білок і не мала проблем із розвитком та когнітивною діяльністю. Вона вивчала психологію в університеті.
Генетичне тестування
Сім'я 1: Молекулярний аналіз позарецептурних препаратів на момент первинного діагнозу був недоступний. Каріотип у випадку індексу показав, за оцінками, делецію Xp21.1 (46, X, del (X) (p21.1p21.1)) з роздільною здатністю 600 смуг у 5 Мб. Для уточнення точок зупинки в 2012 році було замовлено масив CGH. Тестування виявило втрату гетерозиготної кількості копій 8,05 Мб на Xp між нуклеотидами 30,376,093-38,432,866 (NCBI36/hg18; CytoChip ISCA 8x60K v2.0), що відповідає цитогенетичному розташуванню Xp11. 4-Xp21.2. Це корелює з втратою 25 генів, що кодують білок RefSeq.
Сімейство 2: секвенування гена OTC у випадку індексу неодноразово не могло ампліфікувати будь-який генний продукт, що припускає грубу делецію. Масив CGH для брата індексу виявив гемізиготну втрату при Xp11.4 з мінімальним інтервалом, що охоплює нуклеотиди 38 068 450 - 38 810 601, що відповідає втраті 0,742 Мб (GRCh37/hg19, Oligo V8.1.1). Це корелює з втратою 5 генів, що кодують білок RefSeq.
Сімейство 3: Після виявлення аномального каріотипу масив CGH у індексному випадку підтвердив втрату гетерозиготної кількості копії 9,88 Мб між нуклеотидами 33,798,269-43,675,842, що відповідає цитогенетичному розташуванню Xp11,3-Xp21,1 (GRCh37/hg19). Це корелює з втратою 35 генів, що кодують білок Refseq. (Малюнок 2,Таблиця 1)
Малюнок 2 Браузер UCSC з геномами, що відображає перекриття між мікроделеціями трьох сімейств. Сім'я 1 = Суцільна сім'я 2 = (зірочка); Сімейство 3 = (суцільна крапка). Загальні видалені гени = поле
| Координати каріотипу | Xp11.4-Xp21.2 | Xp11.4 | Xp11.3-Xp21.1 |
| Розрахункові точки зупинки видалення (hg19) | chrX: 30 466 172-38 547 922 * | chrX: 38 068 450 - 38 810 601 | chrX: 33,798,269-43,675,842 |
| GK | Дефіцит гліцеролкінази (300474) | ||
| DMD | М’язова дистрофія Дюшенна; М’язова дистрофія Беккера; розширена кардіоміопатія (300377) | ||
| XK | Синдром Маклеода, з хронічною гранулематозною хворобою або без неї (314850) | ||
| CYBB | Сімейний атиповий мікобактеріоз/Хронічна гранулематозна хвороба (300481) | ||
| RPGR | Конусо-стрижнева дистрофія; Дегенерація жовтої плями; Пігментний ретиніт; Пігментний ретиніт, зчеплені з Х та синореспіраторні інфекції, із глухотою або без неї (312610) | ||
| Позабіржові | Дефіцит орнітин-транскарбамілази (300461) | ||
| TSPAN7 | X-пов'язана розумова відсталість (300096) | ||
| BCOR | Синдромічна мікрофтальмія; окуло-фаціально-кардіо-стоматологічний синдром (300166) | ||
| ATP6AP2 | Розумова відсталість, пов'язана Х-типом, тип Гедера (300423) | ||
| USP9X | Розумова відсталість, зв’язана Х 99 (300919) | ||
| NYX | Нічна сліпота, вроджена нерухома (повна), 1А, зчеплене з Х (310500) | ||
| СОЧИНА | Синдром FG 4 (300422); Розумова відсталість, із ністагмом або без нього (300422); Розумова відсталість та мікроцефалія з гіпоплазією понтину та мозочка (300749) | ||
| МАОА | Синдром Бруннера (300615) |
Таблиця 1: Суміжні делеції генів та гени OMIM для трьох сімей.
Обговорення
Хромосома Х, як було відзначено, є гарячою точкою для геномної перебудови, і тому вона схильна до копіювання змін числа, таких як делеції [14]. Імовірні пояснення змін кількості копій області Xp включають внутрішньомолекулярну гомологічну рекомбінацію [15, 16] та/або прослизання ДНК [16]. Завдяки сучасній технології CGH та масиву SNP масиву стало можливо ідентифікувати мікроделеції, які раніше могли бути пропущені каріотипом, а також стало набагато простіше визначити ступінь делецій, як великих, так і малих. Це дозволяє нам краще зрозуміти фенотипові зміни в обмінних умовах, такі як OTCD.
У сім'ях 1 та 2 повідомлялося про численні викидні, і це підвищує ймовірність внутрішньоутробної летальності, ймовірно у чоловіків, через мікроделецію. Це ще раз підкреслює, що аберрації кількості копій цього багатого генами регіону сильно перешкоджають розвитку множинних систем органів.
На закінчення ми представляємо три родини із сусідньою делецією Xp регіону, що охоплює OTC, RPGR і TSPAN7 з кількома членами, усі з різними фенотипами. Такі випадки підкреслюють необхідність повного з’ясування основної молекулярної патології, оскільки це змінить лікування та можливість кандидатури на трансплантацію печінки при OTCD. Це також дозволяє нам краще зрозуміти функції оточуючих генів та їх можливі взаємодії.
Конфлікт інтересів
Автори не мають конфлікту інтересів для розголошення
Подяка
Ми вдячні родинам та пацієнтам за надання згоди та підтримку цього проекту.
- Гени Безкоштовний повнотекстовий одомашнений кляп Ген дрозофіли LTR ретротранспозони задіяний у
- COVID-19 та похоронна індустрія Сім'ї мають можливість розглянути Manchester Ink Link
- COVID-19 змінює похорони та те, як сумують сім'ї
- Вплив 8-тижневої дієтичної добавки мікроелементів на експресію генів в елітному гандболі
- FEAST Підтримка та ресурси для сімей, які постраждали від розладів харчування