Меню списку журналів
Інструменти
Слідкуйте за журналом
Секція імунології, Інститут експериментальної медичної науки, Лундський університет, Лунд, Швеція
Секція імунології, Інститут експериментальної медичної науки, Лундський університет, Лунд, Швеція
Кафедра дитячої онкології/гематології, Університетська лікарня Сконе, Лунд, Швеція
Секція імунології, Інститут експериментальної медичної науки, Лундський університет, Лунд, Швеція
Листування: Девід Брайдер, доктор філософії, секція імунології, Інститут експериментальної медичної науки, Університет Лунда, BMC D14, Klinikgatan 32, 221 84 Лунд, Швеція. Шукати інші статті цього автора
Секція імунології, Інститут експериментальної медичної науки, Лундський університет, Лунд, Швеція
Секція імунології, Інститут експериментальної медичної науки, Лундський університет, Лунд, Швеція
Кафедра дитячої онкології/гематології, Університетська лікарня Сконе, Лунд, Швеція
Секція імунології, Інститут експериментальної медичної науки, Лундський університет, Лунд, Швеція
Листування: Девід Брайдер, доктор філософії, секція імунології, Інститут експериментальної медичної науки, Університет Лунда, BMC D14, Klinikgatan 32, 221 84 Лунд, Швеція. Шукати інші статті цього автора
Анотація
Вступ
Фізіологічний процес старіння супроводжується загальною втратою фізичної форми та різким збільшенням поширеності багатьох наших найбільш руйнівних захворювань, включаючи деменцію, аутоімунітет та рак. Оскільки тривалість життя людської популяції постійно розширюється, надзвичайно необхідне більш глибоке розуміння механізмів, що лежать в основі процесу старіння. Це важливо не тільки для розуміння розвитку хвороби з урахуванням віку, але також і з довгостроковою метою досягнення загального більш здорового стану на пізніх етапах життя [1] - цілі, яку можна передбачити досягти шляхом зміни або, принаймні, гальмування вікового розпаду в організмі.
Хоча було висунуто багаторазові спроби сформулювати більш універсальні теорії про причини старіння, старіння багатоклітинних організмів, безсумнівно, є прогресивним багатопараметричним процесом [2], який характеризується асинхронними/сегментарними фенотипами різних органів [3]. Незважаючи на це, зростаючий консенсус підтримує асоціацію зростаючого віку та відмови належним чином підтримувати гомеостаз органів та тканин або повернутися до гомеостатичних умов після стресу чи травми [4]. Вважається, що стовбурові клітини, що перебувають у тканинах, і які були визначені в більшості дорослих органів та тканин [5], причинно пов’язані з процесом старіння [4]. З точки зору того, що основною функцією стовбурових клітин є підтримка гомеостазу тканин шляхом заповнення клітин, втрачених внаслідок різних образ, вклад стовбурових клітин у процес старіння представляється інтуїтивним [5]. Це, не в останню чергу, тому що пов'язані з віком мутаційні події або інші форми макромолекулярних пошкоджень, отримані на рівні соматичних стовбурових клітин, ризикують поширюватися до диференційованого потомства. Зрештою, це може передбачати компрометацію або виробництва, або функції диференційованих кінцевих продуктів.
Прояв старіння HSC та його значення для старіння імунної системи
Одним органом, який критично залежить від функції стовбурових клітин дорослої людини, є система крові або гемопоетична система [5]. У цій системі всі клітини крові походять від рідкісних кісткових мозку (БМ), що відновлюються, гемопоетичних стовбурових клітин (HSC), які здатні ініціювати поетапний та ієрархічний каскад диференціації. Це передбачає генерацію різних проміжних типів клітин-попередників з поступово звуженим потенціалом диференціації, в яких кінцевим результатом є генерація зрілих ефекторних клітин крові, що належать до однієї з кількох різних ліній [5].
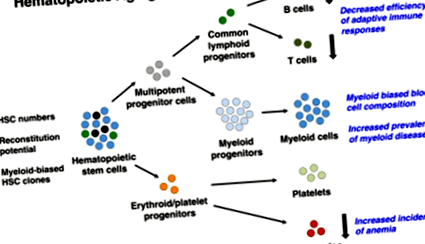
Беручи до уваги не тільки те, що поширеність різних гематологічних захворювань різко зростає з віком [35], але і те, що вони переважно походять від мієлоїдних ліній [9], спокусливо припустити, що пов'язаний з віком перекіс мієлоїдів може лежати в основі декількох клінічно значущі фенотипи, такі як знижена адаптаційна імунна компетентність та збільшення поширеності декількох мієлогенних захворювань (рис. 1). Безпосередньо на підтримку цієї інтерпретації є висновки, що BCR/ABL злитий онкоген, який часто є причиною як хронічного лімфоїдного, так і мієлоїдного лейкозу, був здатним викликати мієлоїдний лейкоз лише при оцінці в контексті старіння [9]. Уздовж тієї самої лінії, MLLВстановлено, що лейкемія, пов’язана з немовлятами, включає лімфоїдні попередники з різними схемами перебудови рецепторів імуноглобуліну/Т-клітин у порівнянні з тими, що спостерігаються в подальшому житті [36], і, фактично, в обох MLL‐Переставлений і BCR ‐ ABLПозитивний лейкоз, вік є важливим прогностичним фактором виживання [37].
Вікові зміни в системі кровотворення. Ряд імунологічних недоліків виникає як наслідок похилого віку і, як вважають, залежать від внутрішніх змін клітин, що відбуваються у вікових HSC, для їх підтримання та розмноження. Вони, в свою чергу, змінюють склад гемопоетичної ієрархії та загальний вихід клітин крові. HSC також збільшується в кількості, що, можливо, відображає компенсаторну реакцію, спричинену їх загальною зниженою кровотворною здатністю. Оскільки в пулі HSC переважають клони HSC з мієлоїдно-упередженим диференціаційним потенціалом (зображені як світло-блакитні HSC), велика кількість збалансованих (зображених як чорні HSC) та лімфоїдно-упереджених HSC (зображених як зелені HSC) зменшується з віком. Це призводить до перекошеного складу клітин крові, в якому периферичні мієлоїдні клітини стають більш домінуючими, тоді як як лімфоїдні попередники, так і наївні В і Т лімфоцити зменшуються в достатку. Абревіатура: HSC, гемопоетичні стовбурові клітини.
Моделі, запропоновані для пояснення зниженої кровотворної здатності застарілого пулу HSC. (А): Модель зміщення популяції дозволяє припустити, що всі HSC є однорідними на ранніх стадіях життя (світло-сірі кола) і що більшість клонів HSC поступово (темні сірі кола) функціонально змінюються з настанням віку. Це в кінцевому підсумку призводить до прояву старіння, при якому більшість, якщо не всі, клони HSC сильно функціонально скомпрометовані (темно-сірі кола). (B): Натомість модель клональної селекції передбачає, що пул HSC неоднорідний і що збільшення віку призводить до поступового розширення селективних клонів HSC (зображується як розширення чорних кіл). З похилим віком ці клони HSC домінують у пулі HSC, і залишається мало, якщо є, «молодих» клонів HSC. (C): У композитній моделі старіння призводить до селективного розширення певних клонів HSC (чорні кола), що супроводжується іншими клонами HSC, що стають функціонально скомпрометованими із збільшенням віку (темно-сірі кола). При глибокому старінні пул HSC складається з високої частки мієлоїдно-упереджених HSC і загального різко зниженого кровотворного потенціалу більшості клонів HSC. Абревіатура: HSC, гемопоетичні стовбурові клітини.
Тригери старіння
З еволюційної точки зору старіння в цілому можна вважати результатом селективного тиску. Якщо це так, старіння повинно мати один або кілька основних генетичних компонентів, які зберігають необхідні ресурси для більшої популяції, шляхом вилучення особин, які пережили свої репродуктивні роки [42]. Однак також пропонується старіння внаслідок накопичення мутацій ДНК [43] і плейотропних генів: генів, які є вигідними на ранніх етапах життя, але невигідними із збільшенням віку [44]. Незважаючи на те, що стає все більш очевидним, що фактори навколишнього середовища впливають на придатність організму, набагато інша тривалість життя багатьох видів у природі підтверджує думку про те, що старіння може регулюватися безпосередньо [45]. Слід зазначити, однак, що більшість тварин у природі піддаються передчасній смерті, наприклад, від хвороб чи хижацтва, і, як правило, не мають характеристик, пов'язаних із старінням людини [46]. У зв'язку з цим старіння людини, включаючи зниження імунної відповіді з віком, може розглядатися як еволюційно молода "проблема", яка є результатом тривалої тривалості життя, спричиненої загальним підвищенням якості життя та покращенням стану здоров'я.
Більшість досліджень старіння HSC вивчали з використанням моделей мишей, точніше штаму миші C57Bl/6. Природно, це турбує загальну придатність отриманих висновків та їх переклад для людей. Однак обнадійливим стає все більш очевидним, що кілька фенотипів старіння зберігаються не лише між альтернативними штамами мишей [7 - 9], а й, що важливіше, при старінні гемопоетичного організму людини (рис. 1) [10]. Наприклад, нещодавно людям похилого віку було запропоновано асоціюватись із підвищеною частотою HSC, що має потенціал мієлоїдно-упередженої диференціації [10]. Інші подібності з мишачою системою включають чітке зменшення кількості найпримітивніших лімфоїдних родоначальників та часте виникнення легкої анемії [11]. Таким чином, декілька ключових аспектів старіння крові гемопоетично, здається, еволюційно і внутрішньо збереженими, і, що найголовніше, їх можна вивчати за допомогою модельних організмів з меншою тривалістю життя - критична проблема для експериментального встановлення причинності.
Внутрішньоклітинні зміни, що супроводжують старіння HSC
Пошкодження ДНК
Молекулярні медіатори старіння гемопоетичних стовбурових клітин (HSC) та їх наслідки при зворотному розвитку. (А): Зважаючи на тривалий термін служби, HSC, як пропонується, особливо схильний до набуття пов'язаних з віком пошкоджень ДНК у вигляді делецій, мутацій та/або ерозії теломер. Якби пошкодження ДНК було головним рушієм старіння HSC, стратегії зворотного розвитку ускладнювалися б незворотним характером змін. (B): Витримані HSC містять епігеномні зміни у вигляді зміненого розподілу метилювання ДНК та модифікацій гістонів, що лежать в основі зміненого транскриптома застарілих HSC. Зміна таких змін повинна мати потенціал для функціонального омолодження функцій HSC у віці.
Транскрипційні та епігенетичні підписи старіння HSC
Досягнення ізоляції клітин дозволило виділити різні незрілі популяції гемопоетичних клітин з високою чистотою. Скориставшись цим, протягом останніх років кілька досліджень провели широке профілювання експресії генів безпосередньо на молодих та вікових ГСК [8, 13, 15, 23, 25, 61, 70, 71]. У сукупності ці роботи показали, що закономірності експресії генів молодих HSC з віком чітко змінюються. Цікаво, що кілька генів, які регулюються з віком, важливі для диференціації мієлоїдних клітин, тоді як багато регульованих генів асоціюються з лімфопоезом [8]. Ці висновки забезпечують молекулярну підтримку вікового мієлоїдного перекосу системи крові і припускають, що принаймні деякі фенотипи, що виникають під час старіння HSC, мають підстави для транскрипції.
Таким чином, сукупні дані, таким чином, підтверджують, що старіння HSC сильно асоціюється з транскрипційним та епігенетичним "дрейфом" (рис. 3B), крім потенційної ролі отримання ДНК-пошкодження з віком. Однак, хоча внесок епігенетики в процес старіння починає бути загальновідомим, слід визнати невирішене питання про те, чи є ці зміни рушієм чи, скоріше, наслідками прогресуючого віку.
Чи оборотний стан старіння HSC?
Хоча в багатьох випадках опосередковані, викладені результати спільно стверджують, що старіння середовища та потенційно фактори, що утворюються в ньому, також можуть впливати на прояв стану старіння HSC. Однак, оскільки трансплантація застарілих HSC у молоде середовище відновлює застарілу систему кровотворення, внутрішні зміни клітин у застарілих HSC повинні бути достатніми, принаймні для підтримання фізіологічного стану старіння HSC.
Перспективи майбутнього, терапія та виклики
Висновок
- Мікробна різноманітність кишечника перед трансплантацією стовбурових клітин може вплинути на виживання
- Хронічна втома дуже поширена у тих, хто пережив аутологічну трансплантацію стовбурових клітин та
- Огляд EDiets 2020 - Отримати або варто спробувати Ось чому
- Підбір редактора Психосоціальний вплив алергії на харчові продукти для підлітків Огляд літератури -
- Огляд мисок для сніданку Daily Harvest Чи смачні вони на суму 7 доларів за кожну Business Insider